名校
解题方法
1 . 含SO2和H2S废气的治理可以变废为宝,使硫资源得以利用。
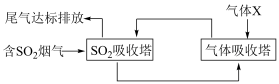
(1)一种处理SO2废气的工艺流程如图所示。_______ ;SO2吸收塔中发生反应化学方程式为_______ 。
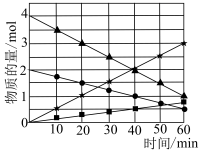
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:_______ 。_______ 。
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:_______ 。(必须使用 的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。_______ 。
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为_______ 。
(1)一种处理SO2废气的工艺流程如图所示。
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:
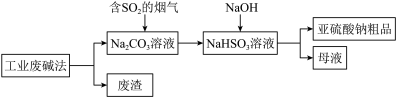
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。
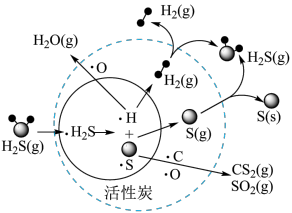
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为
您最近一年使用:0次
2024-02-13更新
|
428次组卷
|
2卷引用:江苏省盐城市盐城一中、射阳中学、滨海中学2023-2024学年高一上学期期末联考化学试卷
名校
解题方法
2 .  在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(1)在 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备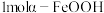 理论上需要
理论上需要 的物质的量为
的物质的量为___________  ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(2) 的结构中,每个
的结构中,每个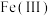 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构___________ 。 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。___________ 。
②工业可使用四氯乙烯 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是___________ 。
③部分环状分子(如苯)中由于存在大 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是___________ 。
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(1)在
 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备
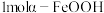 理论上需要
理论上需要 的物质的量为
的物质的量为 ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(2)
 的结构中,每个
的结构中,每个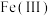 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构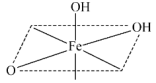
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。
②工业可使用四氯乙烯
 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是③部分环状分子(如苯)中由于存在大
 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是
您最近一年使用:0次
2024-02-13更新
|
791次组卷
|
4卷引用:江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题
3 . 反应 可用于去除氮氧化物。
可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
 可用于去除氮氧化物。
可用于去除氮氧化物。 催化该反应的过程如图所示。下列说法正确的是
催化该反应的过程如图所示。下列说法正确的是
A.反应过程中, 参与反应,降低了反应的焓变 参与反应,降低了反应的焓变 |
B.该反应的平衡常数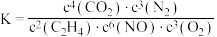 |
C.其他条件不变时,增大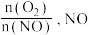 的平衡转化率下降 的平衡转化率下降 |
D.步骤Ⅲ中每消耗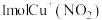 ,转移电子数目为 ,转移电子数目为 |
您最近一年使用:0次
2024-02-13更新
|
807次组卷
|
6卷引用:江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题
江苏省南通市2024届高三上学期第一次调研测试(一模)化学试题(已下线)化学(江苏卷03)-2024年高考押题预测卷江苏省无锡市锡东高级中学2023-2024学年高三下学期5月月考化学试题江苏省无锡市市北高级中学2023-2024学年高二下学期5月期中考试化学试题(已下线)专题06 化学反应速率与化学平衡-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)FHgkyldyjhx07
名校
解题方法
4 . ⅤA族元素及其化合物应用广泛。 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷
。工业上用白磷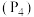 与
与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元弱酸
反应制备一元弱酸 。雌黄
。雌黄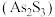 和
和 在盐酸中反应转化为雄黄
在盐酸中反应转化为雄黄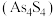 和
和 (沸点114℃)并放出
(沸点114℃)并放出 气体。砷化镓(GaAs)是第三代半导体材料,熔点高,硬度大。下列反应的化学或离子方程式错误的是
气体。砷化镓(GaAs)是第三代半导体材料,熔点高,硬度大。下列反应的化学或离子方程式错误的是
 催化氧化生成NO,NO继续被氧化为
催化氧化生成NO,NO继续被氧化为 ,将
,将 通入水中制取
通入水中制取 。工业上用白磷
。工业上用白磷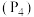 与
与 反应生成
反应生成 和一种盐,该盐可与
和一种盐,该盐可与 反应制备一元弱酸
反应制备一元弱酸 。雌黄
。雌黄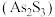 和
和 在盐酸中反应转化为雄黄
在盐酸中反应转化为雄黄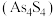 和
和 (沸点114℃)并放出
(沸点114℃)并放出 气体。砷化镓(GaAs)是第三代半导体材料,熔点高,硬度大。下列反应的化学或离子方程式错误的是
气体。砷化镓(GaAs)是第三代半导体材料,熔点高,硬度大。下列反应的化学或离子方程式错误的是A. 制 制 的离子方程式: 的离子方程式: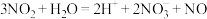 |
B.白磷与 溶液反应: 溶液反应: |
C. 与足量的 与足量的 溶液反应的离子方程式: 溶液反应的离子方程式: |
D.雌黄制备雄黄的方程式: |
您最近一年使用:0次
2024-02-08更新
|
371次组卷
|
3卷引用: 江苏省徐州市第七中学2023-2024学年高三上学期1月月考化学试题
5 . 碱式次氯酸镁 是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有
是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有 等]制备碱式次氯酸镁的流程如下。
等]制备碱式次氯酸镁的流程如下。

(1)“煅烧”在700℃高温下进行,煅烧得到 的同时,生成气体的化学式为
的同时,生成气体的化学式为___________ 。
(2)“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为___________ 。
(3)“沉淀”步骤制备 时需控制
时需控制 约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为
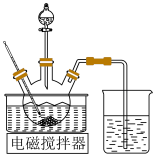
约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为________ 。用下图所示装置制备 。将
。将 晶体与
晶体与 溶液、
溶液、 溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是
溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是___________ 溶液(填化学式)。
(4)向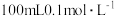 的
的 溶液中加入适量
溶液中加入适量 溶液、
溶液、 溶液,过滤,洗涤,干燥得到
溶液,过滤,洗涤,干燥得到 固体。为测定其组成,将所得固体溶于酸,再加入过量的
固体。为测定其组成,将所得固体溶于酸,再加入过量的 溶液,充分反应生成
溶液,充分反应生成 和
和 。测得生成的
。测得生成的 为
为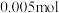 。计算
。计算 的化学式
的化学式_________ (写出计算过程)。
 是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有
是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有 等]制备碱式次氯酸镁的流程如下。
等]制备碱式次氯酸镁的流程如下。
(1)“煅烧”在700℃高温下进行,煅烧得到
 的同时,生成气体的化学式为
的同时,生成气体的化学式为(2)“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为
(3)“沉淀”步骤制备
 时需控制
时需控制 约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为
约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为 。将
。将 晶体与
晶体与 溶液、
溶液、 溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是
溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是
(4)向
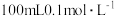 的
的 溶液中加入适量
溶液中加入适量 溶液、
溶液、 溶液,过滤,洗涤,干燥得到
溶液,过滤,洗涤,干燥得到 固体。为测定其组成,将所得固体溶于酸,再加入过量的
固体。为测定其组成,将所得固体溶于酸,再加入过量的 溶液,充分反应生成
溶液,充分反应生成 和
和 。测得生成的
。测得生成的 为
为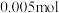 。计算
。计算 的化学式
的化学式
您最近一年使用:0次
6 . 草酸钠(Na2C2O4),为草酸的钠盐,白色晶体,可溶于水,具有还原性,可作分析实验的基准试剂。分析实验中的计算要求保留四位有效数字,现分析实验室需配制 的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。
的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。
(1)计算及称量:经计算后用分析天平准确称取______ g草酸钠晶体。
(2)溶解:将草酸钠晶体转移至100mL______ 中,用适量的蒸馏水溶解,恢复至室温。
(3)转移:将恢复至室温后的溶液用玻璃棒小心地引流到______ 中,用蒸馏水______ 。轻轻振荡,使溶液混合均匀。
(4)定容:缓缓地将蒸馏水注入容量瓶中,直到液面距刻度线1~2cm时,改用______ 滴加蒸馏水至溶液凹液面正好与刻度线相切,塞上瓶塞,反复上下颠倒,摇匀。
(5)用配制的草酸钠溶液来测定高锰酸钾溶液的浓度,测定原理如下:______
 (配平方程式)
(配平方程式)
取该草酸钠溶液25.00mL,用一定浓度的高锰酸钾溶液滴定,恰好反应时,消耗高锰酸钾溶液22.00mL,则高锰酸钾溶液的浓度为______  。(写出计算过程)
。(写出计算过程)
 的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。
的草酸钠溶液100mL,用于标定高锰酸钾标准溶液的浓度。(1)计算及称量:经计算后用分析天平准确称取
(2)溶解:将草酸钠晶体转移至100mL
(3)转移:将恢复至室温后的溶液用玻璃棒小心地引流到
(4)定容:缓缓地将蒸馏水注入容量瓶中,直到液面距刻度线1~2cm时,改用
(5)用配制的草酸钠溶液来测定高锰酸钾溶液的浓度,测定原理如下:
 (配平方程式)
(配平方程式)取该草酸钠溶液25.00mL,用一定浓度的高锰酸钾溶液滴定,恰好反应时,消耗高锰酸钾溶液22.00mL,则高锰酸钾溶液的浓度为
 。(写出计算过程)
。(写出计算过程)
您最近一年使用:0次
7 .  的治理是当前生态环境保护中的重要课题之一,回答下列问题:
的治理是当前生态环境保护中的重要课题之一,回答下列问题:
(1)氮元素的常见单质有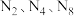 。
。 中原子之间只形成
中原子之间只形成 键,且均达到最外层8电子稳定结构,
键,且均达到最外层8电子稳定结构, 的结构式为
的结构式为______________ *.
(2) 催化还原
催化还原 ,保持其它初始条件不变,使用甲、乙催化剂时,
,保持其它初始条件不变,使用甲、乙催化剂时, 转化率随温度的变化如图1所示。
转化率随温度的变化如图1所示。 点对应的速率
点对应的速率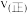
______________ 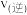 (填“>”“<”或“=”).
(填“>”“<”或“=”).

(3)将含 和
和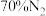 的混合气体以一定流速通过装有催化剂的反应器,发生反应:
的混合气体以一定流速通过装有催化剂的反应器,发生反应: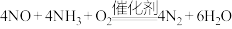 。
。 去除率随反应温度变化如图2所示.在
去除率随反应温度变化如图2所示.在 范围内,
范围内, 去除率随温度的升高而迅速上升的主要原因是
去除率随温度的升高而迅速上升的主要原因是______________ 。
(4)电解氧化吸收法可将废气中的 转变为硝态氮。向
转变为硝态氮。向 溶液(起始
溶液(起始 调至9)中通入
调至9)中通入 ,电解产生的
,电解产生的 将
将 氧化为
氧化为 ,从而实现
,从而实现 的去除.电解过程中测得溶液中相关成分的浓度变化与电流强度的关系如图3所示。
的去除.电解过程中测得溶液中相关成分的浓度变化与电流强度的关系如图3所示。
已知氧化性: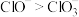 ;
;
①电解液中 氧化
氧化 的离子方程式为
的离子方程式为______________ 。
②电流强度大于 后,随电流强度的增加,
后,随电流强度的增加, 去除率
去除率______________ (填“上升”“下降”或“不变”),原因是______________ 。

 的治理是当前生态环境保护中的重要课题之一,回答下列问题:
的治理是当前生态环境保护中的重要课题之一,回答下列问题:(1)氮元素的常见单质有
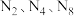 。
。 中原子之间只形成
中原子之间只形成 键,且均达到最外层8电子稳定结构,
键,且均达到最外层8电子稳定结构, 的结构式为
的结构式为(2)
 催化还原
催化还原 ,保持其它初始条件不变,使用甲、乙催化剂时,
,保持其它初始条件不变,使用甲、乙催化剂时, 转化率随温度的变化如图1所示。
转化率随温度的变化如图1所示。 点对应的速率
点对应的速率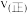
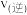 (填“>”“<”或“=”).
(填“>”“<”或“=”).
(3)将含
 和
和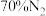 的混合气体以一定流速通过装有催化剂的反应器,发生反应:
的混合气体以一定流速通过装有催化剂的反应器,发生反应: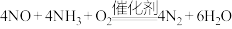 。
。 去除率随反应温度变化如图2所示.在
去除率随反应温度变化如图2所示.在 范围内,
范围内, 去除率随温度的升高而迅速上升的主要原因是
去除率随温度的升高而迅速上升的主要原因是(4)电解氧化吸收法可将废气中的
 转变为硝态氮。向
转变为硝态氮。向 溶液(起始
溶液(起始 调至9)中通入
调至9)中通入 ,电解产生的
,电解产生的 将
将 氧化为
氧化为 ,从而实现
,从而实现 的去除.电解过程中测得溶液中相关成分的浓度变化与电流强度的关系如图3所示。
的去除.电解过程中测得溶液中相关成分的浓度变化与电流强度的关系如图3所示。已知氧化性:
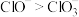 ;
;①电解液中
 氧化
氧化 的离子方程式为
的离子方程式为②电流强度大于
 后,随电流强度的增加,
后,随电流强度的增加, 去除率
去除率
您最近一年使用:0次
解题方法
8 . 自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。
(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。 的结构式为
的结构式为___________ 。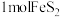 与
与 和
和 溶液反应转化为
溶液反应转化为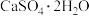 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为___________  。
。
(2)工业上利用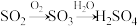 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。___________ (写出两点)。
②装置Ⅲ用于吸收 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是___________ (填字母)。
A. 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸
③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是___________ 。若用 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将___________ (填“增大”“减小”或“不变”)。
(3) 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。___________ 。
(4) 的“再生”是在
的“再生”是在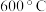 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是___________ 。
 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。
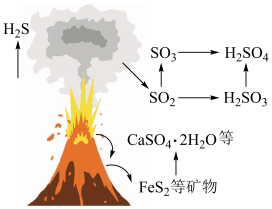
 的结构式为
的结构式为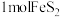 与
与 和
和 溶液反应转化为
溶液反应转化为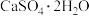 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为 。
。(2)工业上利用
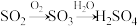 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。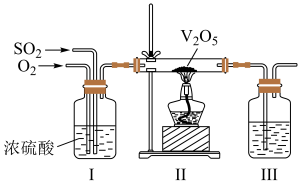
②装置Ⅲ用于吸收
 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是A.
 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是
 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将(3)
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。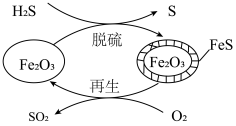
(4)
 的“再生”是在
的“再生”是在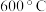 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是
您最近一年使用:0次
2024-02-04更新
|
620次组卷
|
2卷引用:江苏省扬州市2023-2024学年高一上学期1月期末考试化学试题
名校
解题方法
9 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)烟气中CO2的捕集可通过如下所示的物质转化实现。
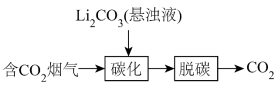
“脱碳”的化学反应方程式为_________ 。
(2)研究脱除烟气中的NO也是环境保护、促进社会可持续发展的重要课题。有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示,该过程可描述为_______ 。

(3)2021年9月,《科学》杂志发表论文,介绍人类首次以二氧化碳为原料,不依赖植物光合作用,直接经过11步路径人工合成淀粉。前两步,是先将二氧化碳还原为甲醛。
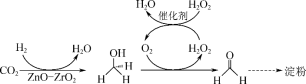
请写出前两步总反应的化学方程式:_________ 。
(4)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如左图所示。其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:

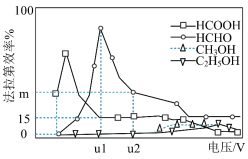
法拉第效率(FE)表示为:FE(B)%= ×100%
×100%
①b电极生成HCOOH的电极反应式为_______ 。
②科研小组利用13CO2代替原有的CO2进行研究,其目的是________ 。
③当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为_______ 。
(1)烟气中CO2的捕集可通过如下所示的物质转化实现。

“脱碳”的化学反应方程式为
(2)研究脱除烟气中的NO也是环境保护、促进社会可持续发展的重要课题。有氧条件下,在Fe基催化剂表面,NH3还原NO的反应机理如图所示,该过程可描述为

(3)2021年9月,《科学》杂志发表论文,介绍人类首次以二氧化碳为原料,不依赖植物光合作用,直接经过11步路径人工合成淀粉。前两步,是先将二氧化碳还原为甲醛。

请写出前两步总反应的化学方程式:
(4)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如左图所示。其他条件一定时,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如图所示:


法拉第效率(FE)表示为:FE(B)%=
 ×100%
×100%①b电极生成HCOOH的电极反应式为
②科研小组利用13CO2代替原有的CO2进行研究,其目的是
③当电解电压为U2V时,电解生成的HCOOH和HCHO的物质的量之比为3:2,则生成HCHO的法拉第效率m为
您最近一年使用:0次
解题方法
10 . 丙烯是重要的有机化合物,具有广泛应用。
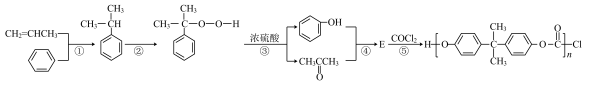
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。______ 。
(2)反应②的原子利用率为100%,加入的氧化剂是______ (填分子式)。
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择______ (选填序号)。
A.NaOH B. C.
C.
(4)E的分子式为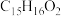 ,则其结构简式为
,则其结构简式为______ 。
Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂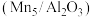 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。______ (选填“Ce”、“Co”)改善催化剂的催化活性效果更加显著。
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。______ ,乙为______ 。(用化学式表示)
②若参加反应的丙烯与NO物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为______ 。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。
(2)反应②的原子利用率为100%,加入的氧化剂是
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择
A.NaOH B.
 C.
C.
(4)E的分子式为
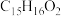 ,则其结构简式为
,则其结构简式为Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂
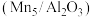 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。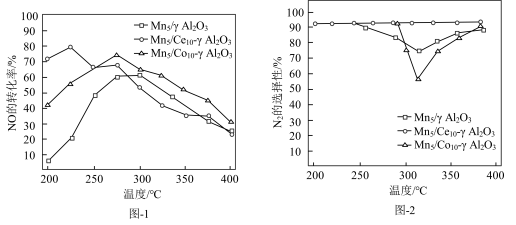
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性
 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。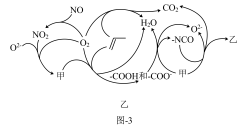
②若参加反应的丙烯与NO物质的量之比为
 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次



