解题方法
1 . 尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
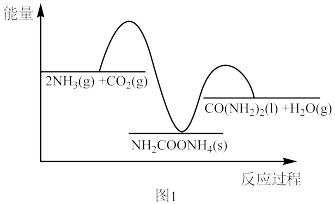
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
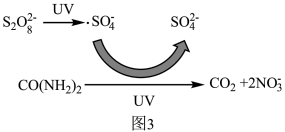
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
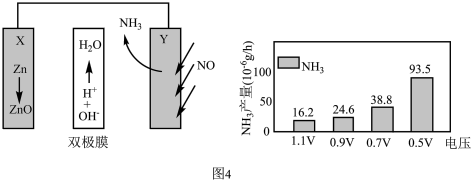
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
解题方法
2 . 铈可用作优良的环保材料。现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备碳酸铈的工艺流程如下:___________ 。
(2)“酸浸”步骤中产生的气体为___________ (化学式)。
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是___________ (已知Ksp[Fe(OH)3]=8×10-38;Ksp[Ce(OH)3]=1×10-22;lg2=0.3,离子浓度小于1×10-5mol/L认为沉淀完全)。
(4)“沉淀”步骤中发生反应的离子方程式为___________ 。
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为___________ 。
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;___________ 。
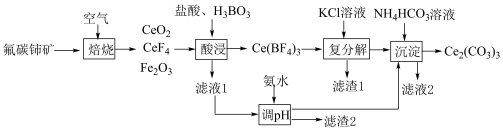
(2)“酸浸”步骤中产生的气体为
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是
(4)“沉淀”步骤中发生反应的离子方程式为
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;
您最近一年使用:0次
名校
3 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: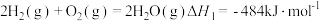
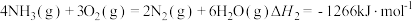
则 的
的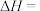
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为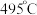 时,
时, 的温度为
的温度为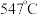 ,而
,而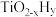 的温度为
的温度为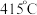 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为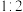 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为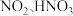 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
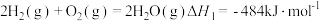
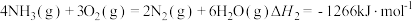
则
 的
的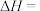
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为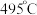 时,
时, 的温度为
的温度为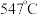 ,而
,而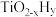 的温度为
的温度为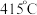 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是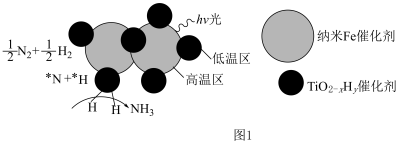
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。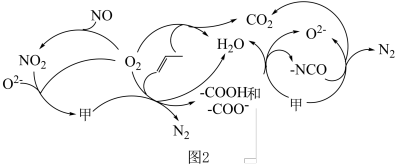
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为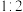 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为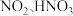 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: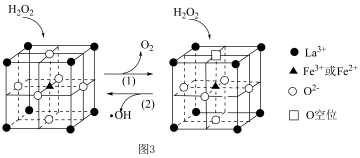
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
4 . 电解锰渣主要含 、
、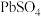 、
、 、
、 。利用电解锰回收铅的工艺如图所示[已知:
。利用电解锰回收铅的工艺如图所示[已知: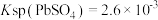 ]:
]:
①“还原酸浸”时, 氧化
氧化 生成
生成 的离子方程式为
的离子方程式为_______ 。
②“浸出液”含有的盐类主要有 和
和_______ (填化学式)。
③从平衡移动的角度分析“浸铅”反应发生的原因:_______ 。
(2)利用 可制备
可制备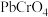 。以
。以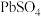 、
、 和
和 为原料,通过混合后进行沉淀转化可制得
为原料,通过混合后进行沉淀转化可制得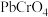 。已知:
。已知: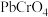 的产率随
的产率随 的变化如图1所示。
的变化如图1所示。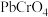 时,控制
时,控制 约为8的原因是
约为8的原因是_______ 。
②设计如图装置(均为惰性电极)电解 溶液制取
溶液制取 。图中右侧电极产生的气体为
。图中右侧电极产生的气体为_______ 。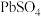 可制得
可制得 。
。 受热分解为
受热分解为 的
的 和
和 价的混合氧化物,
价的混合氧化物, 价的
价的 能氧化浓盐酸生成
能氧化浓盐酸生成 。现将
。现将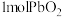 加热分解得到
加热分解得到 ,向“剩余固体”中加入足量的浓盐酸得到
,向“剩余固体”中加入足量的浓盐酸得到 。生成的
。生成的 和
和 的物质的量相等。计算“剩余固体”中
的物质的量相等。计算“剩余固体”中 原子个数比。(写出计算过程)
原子个数比。(写出计算过程)_______ 。
 、
、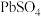 、
、 、
、 。利用电解锰回收铅的工艺如图所示[已知:
。利用电解锰回收铅的工艺如图所示[已知: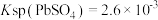 ]:
]:
①“还原酸浸”时,
 氧化
氧化 生成
生成 的离子方程式为
的离子方程式为②“浸出液”含有的盐类主要有
 和
和③从平衡移动的角度分析“浸铅”反应发生的原因:
(2)利用
 可制备
可制备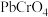 。以
。以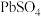 、
、 和
和 为原料,通过混合后进行沉淀转化可制得
为原料,通过混合后进行沉淀转化可制得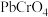 。已知:
。已知: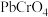 的产率随
的产率随 的变化如图1所示。
的变化如图1所示。
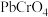 时,控制
时,控制 约为8的原因是
约为8的原因是②设计如图装置(均为惰性电极)电解
 溶液制取
溶液制取 。图中右侧电极产生的气体为
。图中右侧电极产生的气体为
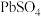 可制得
可制得 。
。 受热分解为
受热分解为 的
的 和
和 价的混合氧化物,
价的混合氧化物, 价的
价的 能氧化浓盐酸生成
能氧化浓盐酸生成 。现将
。现将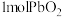 加热分解得到
加热分解得到 ,向“剩余固体”中加入足量的浓盐酸得到
,向“剩余固体”中加入足量的浓盐酸得到 。生成的
。生成的 和
和 的物质的量相等。计算“剩余固体”中
的物质的量相等。计算“剩余固体”中 原子个数比。(写出计算过程)
原子个数比。(写出计算过程)
您最近一年使用:0次
2024-03-02更新
|
417次组卷
|
2卷引用:江苏省海安高级中学2023-2024学年高三下学期开学考试化学试题
名校
5 . 硫及其化合物种类繁多,在生产生活中应用广泛。下图是硫及其部分化合物的“价类二维图”。

(1)硫元素在元素周期表中的位置是_______ 。
(2)从氧化还原的角度分析,欲制备硫代硫酸钠( ),下列方案合理的是
),下列方案合理的是____ (填序号)。
① 和
和 ②
② 和浓
和浓 ③
③ 和
和 ④
④ 和
和
(3)硫代硫酸钠( )常用作纸浆漂白的脱氯剂,实验室可用下图装置制备少量
)常用作纸浆漂白的脱氯剂,实验室可用下图装置制备少量 。
。
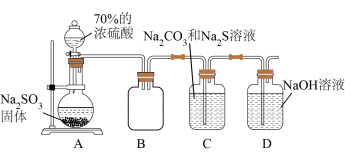
①实验室制备少量: 气体也可以用浓硫酸与
气体也可以用浓硫酸与 反应,该反应的化学方程式是
反应,该反应的化学方程式是_________ 。
②装置B的作用是________ 。装置C中发生反应生成 的同时放出
的同时放出 ,该反应的离子方程式是
,该反应的离子方程式是________ 。
③装置D的作用是______ 。若装置D中是足量氨水,则与 反应的离子方程式是
反应的离子方程式是_____ 。

(1)硫元素在元素周期表中的位置是
(2)从氧化还原的角度分析,欲制备硫代硫酸钠(
 ),下列方案合理的是
),下列方案合理的是①
 和
和 ②
② 和浓
和浓 ③
③ 和
和 ④
④ 和
和
(3)硫代硫酸钠(
 )常用作纸浆漂白的脱氯剂,实验室可用下图装置制备少量
)常用作纸浆漂白的脱氯剂,实验室可用下图装置制备少量 。
。
①实验室制备少量:
 气体也可以用浓硫酸与
气体也可以用浓硫酸与 反应,该反应的化学方程式是
反应,该反应的化学方程式是②装置B的作用是
 的同时放出
的同时放出 ,该反应的离子方程式是
,该反应的离子方程式是③装置D的作用是
 反应的离子方程式是
反应的离子方程式是
您最近一年使用:0次
名校
解题方法
6 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

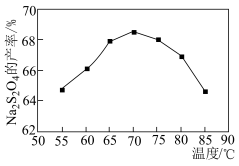
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
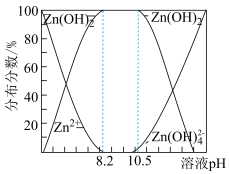
②二价锌在水溶液中的存在形式与pH的关系如图所示。
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近一年使用:0次
2024-02-22更新
|
346次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
解题方法
7 . 将 转化为有机物是实现“碳中和”的有效途径和研究热点。
转化为有机物是实现“碳中和”的有效途径和研究热点。
(1)通过电解法可将 转化为
转化为 的装置如图所示。
的装置如图所示。
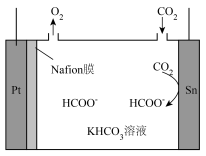
①写出阴极的电极反应式___________ 。
②已知:Nafion膜为一种阳离子交换膜,只允许阳离子及水分子通过,电池工作时在Pt电极覆盖一层Nafion膜的主要目的是___________ 。
(2)电解催化还原 用某复合金属作为电极时,复合金属吸附二氧化碳的位置不同,产物也不一样。复合金属优先与O原子结合,生成的产物主要为HCOOH.复合金属优先与C结合,生成的产物主要为
用某复合金属作为电极时,复合金属吸附二氧化碳的位置不同,产物也不一样。复合金属优先与O原子结合,生成的产物主要为HCOOH.复合金属优先与C结合,生成的产物主要为 或
或 。该复合金属催化还原
。该复合金属催化还原 可能的机理及各产物的物质的量分数如图所示,
可能的机理及各产物的物质的量分数如图所示,
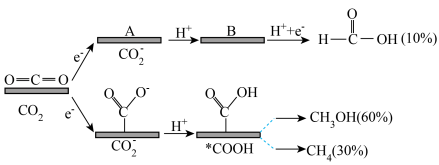
①画出图中中间体B的结构___________ 。
②若有 完全转化,反应过程中转移的电子数为
完全转化,反应过程中转移的电子数为___________ mol。
(3)铁水热法还原 转化为
转化为 的过程如下所示,
的过程如下所示,
制氢: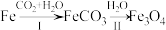
合成: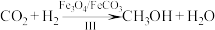
加热条件下,将一定量的Fe、 和
和 投入容器中进行反应,所得固体中各组分的质量分数及生成
投入容器中进行反应,所得固体中各组分的质量分数及生成 的体积随反应时间的变化如下表所示,
的体积随反应时间的变化如下表所示,
①书写步骤Ⅱ的化学反应方程式___________ 。
②从1小时后, 质量分数逐渐下降的主要原因是
质量分数逐渐下降的主要原因是___________ 。
 转化为有机物是实现“碳中和”的有效途径和研究热点。
转化为有机物是实现“碳中和”的有效途径和研究热点。(1)通过电解法可将
 转化为
转化为 的装置如图所示。
的装置如图所示。
①写出阴极的电极反应式
②已知:Nafion膜为一种阳离子交换膜,只允许阳离子及水分子通过,电池工作时在Pt电极覆盖一层Nafion膜的主要目的是
(2)电解催化还原
 用某复合金属作为电极时,复合金属吸附二氧化碳的位置不同,产物也不一样。复合金属优先与O原子结合,生成的产物主要为HCOOH.复合金属优先与C结合,生成的产物主要为
用某复合金属作为电极时,复合金属吸附二氧化碳的位置不同,产物也不一样。复合金属优先与O原子结合,生成的产物主要为HCOOH.复合金属优先与C结合,生成的产物主要为 或
或 。该复合金属催化还原
。该复合金属催化还原 可能的机理及各产物的物质的量分数如图所示,
可能的机理及各产物的物质的量分数如图所示,
①画出图中中间体B的结构
②若有
 完全转化,反应过程中转移的电子数为
完全转化,反应过程中转移的电子数为(3)铁水热法还原
 转化为
转化为 的过程如下所示,
的过程如下所示,制氢:
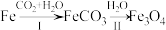
合成:
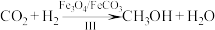
加热条件下,将一定量的Fe、
 和
和 投入容器中进行反应,所得固体中各组分的质量分数及生成
投入容器中进行反应,所得固体中各组分的质量分数及生成 的体积随反应时间的变化如下表所示,
的体积随反应时间的变化如下表所示,| 反应时间(小时) | Fe(%) |  (%) (%) |  (%) (%) |  (mL) (mL) |
| 1 | 47.3 | 19.1 | 33.6 | 260 |
| 2 | 46.9 | 20.1 | 33 | 370 |
| 3 | 45.5 | 25.5 | 30 | 400 |
| 4 | 36.8 | 37.6 | 25.6 | 480 |
②从1小时后,
 质量分数逐渐下降的主要原因是
质量分数逐渐下降的主要原因是
您最近一年使用:0次
解题方法
8 . 生活中常用的消毒剂有含氯消毒剂、双氧水等。
Ⅰ.实验室模拟获得少量漂白粉的装置如图

(1)实验室可以用 和浓盐酸反应制取氮气,反应方程式如下:
和浓盐酸反应制取氮气,反应方程式如下:
①浓盐酸在反应中显示出来的性质是___________ ;
②请用双线桥表示该反应电子转移的方向和数目:___________
 ;
;
③D装置的作用是___________ 。
(2)已知:a.氯气和石灰乳在反应的过程中会放出热量。
b.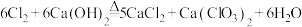
①写出制取漂白粉的化学方程式:___________ 。
②兴趣小组制得的漂白粉中 的含量远超过预期,而
的含量远超过预期,而 含量明显偏低,主要原因可能是
含量明显偏低,主要原因可能是___________ 。
Ⅱ.亚氯酸钠( )是一种高效的消毒剂和漂白剂。Mathieson法制备亚氯酸钠的流程如图:
)是一种高效的消毒剂和漂白剂。Mathieson法制备亚氯酸钠的流程如图:
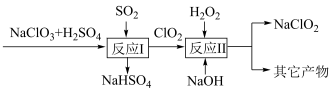
(3)①反应Ⅰ的氧化剂是___________ (写化学式,下同)。
②反应Ⅱ中其它产物除了 外还有
外还有___________ ,当 和
和 的物质的量为
的物质的量为 混合时完全反应,则反应Ⅱ的化学方程式为
混合时完全反应,则反应Ⅱ的化学方程式为___________ 。
Ⅰ.实验室模拟获得少量漂白粉的装置如图

(1)实验室可以用
 和浓盐酸反应制取氮气,反应方程式如下:
和浓盐酸反应制取氮气,反应方程式如下:
①浓盐酸在反应中显示出来的性质是
②请用双线桥表示该反应电子转移的方向和数目:
 ;
;③D装置的作用是
(2)已知:a.氯气和石灰乳在反应的过程中会放出热量。
b.
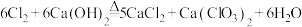
①写出制取漂白粉的化学方程式:
②兴趣小组制得的漂白粉中
 的含量远超过预期,而
的含量远超过预期,而 含量明显偏低,主要原因可能是
含量明显偏低,主要原因可能是Ⅱ.亚氯酸钠(
 )是一种高效的消毒剂和漂白剂。Mathieson法制备亚氯酸钠的流程如图:
)是一种高效的消毒剂和漂白剂。Mathieson法制备亚氯酸钠的流程如图:
(3)①反应Ⅰ的氧化剂是
②反应Ⅱ中其它产物除了
 外还有
外还有 和
和 的物质的量为
的物质的量为 混合时完全反应,则反应Ⅱ的化学方程式为
混合时完全反应,则反应Ⅱ的化学方程式为
您最近一年使用:0次
名校
解题方法
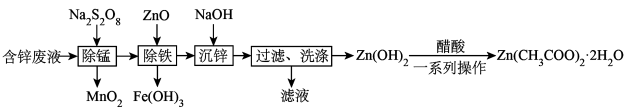
9 . 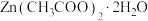 常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为
常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的
,含少量的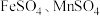 )为原料制备
)为原料制备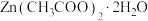 的实验流程如图所示:
的实验流程如图所示:
请回答下列问题:
(1)已知 中存在一个过氧键
中存在一个过氧键 ,则过二硫酸钠
,则过二硫酸钠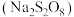 中
中 元素的化合价为
元素的化合价为_____________ ;“除锰”阶段被氧化的元素有_____________ (填元素名称)。
(2)加入 能“除铁”的原因:
能“除铁”的原因: 消耗
消耗 使溶液
使溶液 调整至
调整至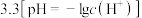 左右时,能使溶液中的
左右时,能使溶液中的 完全转化为
完全转化为 沉淀,则该阶段发生总反应的离子方程式为
沉淀,则该阶段发生总反应的离子方程式为_________ 。
(3)“沉锌”过程中通常加入 。
。
① 在水溶液中的电离方程式为
在水溶液中的电离方程式为_____________________ 。
②向饱和食盐水中加入与 等物质的量的
等物质的量的 ,固体时发生反应的化学方程式为
,固体时发生反应的化学方程式为_____________________________________________________________________________ 。
(4)
_____________ (填“属于”或“不属于”)盐,其与醋酸反应生成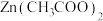 的离子方程式为
的离子方程式为_____________________________________________________ 。
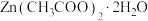 常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为
常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的
,含少量的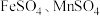 )为原料制备
)为原料制备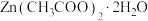 的实验流程如图所示:
的实验流程如图所示:
请回答下列问题:
(1)已知
 中存在一个过氧键
中存在一个过氧键 ,则过二硫酸钠
,则过二硫酸钠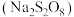 中
中 元素的化合价为
元素的化合价为(2)加入
 能“除铁”的原因:
能“除铁”的原因: 消耗
消耗 使溶液
使溶液 调整至
调整至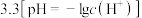 左右时,能使溶液中的
左右时,能使溶液中的 完全转化为
完全转化为 沉淀,则该阶段发生总反应的离子方程式为
沉淀,则该阶段发生总反应的离子方程式为(3)“沉锌”过程中通常加入
 。
。①
 在水溶液中的电离方程式为
在水溶液中的电离方程式为②向饱和食盐水中加入与
 等物质的量的
等物质的量的 ,固体时发生反应的化学方程式为
,固体时发生反应的化学方程式为(4)

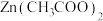 的离子方程式为
的离子方程式为
您最近一年使用:0次
2024-02-17更新
|
287次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期第一次月考化学试题
名校
10 . 有效去除大气和水体中的氮氧化物是环境保护的重要课题。
(1)某学者使用 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。
①通入 的目的是
的目的是________ 。
②若不通入 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是_____ 。
(2)含氯化合物可将废气中的 转化成
转化成 脱除。
脱除。
①提高废气中 脱除率的可行措施有
脱除率的可行措施有______ (填字母)。
A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL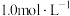
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是______ 。
③按一定流速将含 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是______ 。
(3)有人研究了用纳米零价铁去除水体中 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是_______ 。

(1)某学者使用
 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。①通入
 的目的是
的目的是②若不通入
 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是(2)含氯化合物可将废气中的
 转化成
转化成 脱除。
脱除。①提高废气中
 脱除率的可行措施有
脱除率的可行措施有A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL
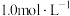
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是③按一定流速将含
 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是(3)有人研究了用纳米零价铁去除水体中
 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是
您最近一年使用:0次
2024-02-16更新
|
153次组卷
|
2卷引用:江苏省泰州中学2023-2024学年高一上学期期末考试化学试题



