2024·江苏·模拟预测
1 . 硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。工业上用软锰矿(主要成分为MnO2,含铁、铝的化合物等杂质)制得硫酸锰的流程如下:_______ 。此过程中,如果SO2废气中混有空气,有副反应发生,部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2,原因是_______ (用平衡移动原理结合化学方程式解释),欲消除生成的硫酸,试剂A最好是_______ 。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(2)SO2气体中混有空气,实验测得酸浸液中Mn2+、 的浓度随反应时间t变化如下图,产生该现象的原因是
的浓度随反应时间t变化如下图,产生该现象的原因是_______ 。_______ ;溶液的pH不能超过6的原因是_______ 。
(4)硫酸锰的溶解度曲线如下图所示,请设计由滤液制备MnSO4·H2O晶体的实验方案:_______ 。(实验中须用到的试剂:80~90℃的蒸馏水:除常用仪器外须使用的仪器:真空干燥箱。)

a.MnCO3 b.MnO2 c.CaO d.CaCO3
(2)SO2气体中混有空气,实验测得酸浸液中Mn2+、
 的浓度随反应时间t变化如下图,产生该现象的原因是
的浓度随反应时间t变化如下图,产生该现象的原因是
(4)硫酸锰的溶解度曲线如下图所示,请设计由滤液制备MnSO4·H2O晶体的实验方案:

您最近一年使用:0次
名校
解题方法
2 . 有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: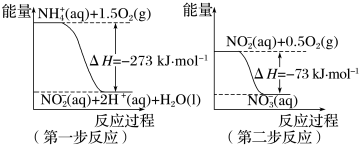
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
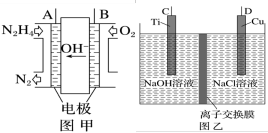
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
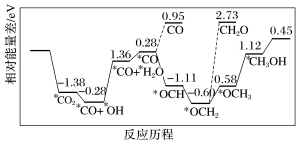
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。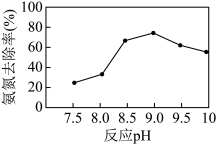
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近一年使用:0次
3 . AgCl可溶于氨水生成Ag(NH3)2Cl,Ag(NH3)2Cl与NH3反应可生成Ag。反应如下:4Ag(NH3)2Cl + N2H4 + 4H2O = 4Ag↓ + N2↑ + 4NH4Cl + 4NH3·H2O。下列关于该反应说法正确的是
| A.Ag(NH3)2Cl发生氧化反应 |
| B.还原性:N2H4<Ag |
C.N2H4的结构式为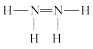 |
| D.每生成标准状况下11.2LN2,反应中转移2mol电子 |
您最近一年使用:0次
名校
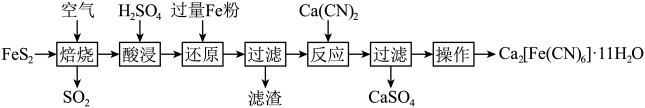
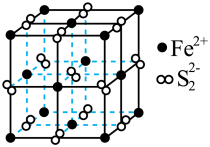
4 . 一种以 (晶胞如下图所示)为原料制备
(晶胞如下图所示)为原料制备 的工艺流程如下:
的工艺流程如下:
下列说法正确的是
 (晶胞如下图所示)为原料制备
(晶胞如下图所示)为原料制备 的工艺流程如下:
的工艺流程如下:

下列说法正确的是
A.焙烧每生成1mol 转移4mol电子 转移4mol电子 |
B. 晶胞中距离每个 晶胞中距离每个 最近的 最近的 有6个 有6个 |
C.“还原”得到的滤液中大量存在 、 、 、 、 |
D. 各元素电负性的大小顺序: 各元素电负性的大小顺序: |
您最近一年使用:0次
名校
解题方法
5 . 汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一、请回答下列问题:
(1)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),一定温度下,在容积为10L的恒容密闭容器中进行该反应,起始时充入0.4molCO、0.3molNO,1min达平衡,测得CO的物质的量为0.16mol,则
①从开始到平衡时的反应速率v(CO)=_______ mol·L-1·min-1。
②NO的平衡转化率为_______ 。
(2)研究在相同时间内不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的可能原因是_______ 。_______ 反应。(填“氧化”或“还原”)
②外电路中,电子流动方向是_______ (填A或B)。
A.从 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极
③ 电极上的电极反应式为
电极上的电极反应式为_______ 。
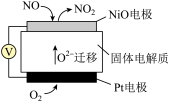
(4)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的 排放,SCR(选择性催化还原)工作原理如图b所示,NSR(
排放,SCR(选择性催化还原)工作原理如图b所示,NSR( 储存还原)工作原理如图c所示。
储存还原)工作原理如图c所示。 )的水溶液热分解为
)的水溶液热分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
②SCR催化过程中,当燃油中含硫量较高时,尾气中 在
在 作用下会形成
作用下会形成 ,使催化剂中毒,用化学方程式表示
,使催化剂中毒,用化学方程式表示 的形成:
的形成:_______ 。
③NSR转换中,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,图中NO的去除机理可描述为
的储存和还原,图中NO的去除机理可描述为_______ 。
(1)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),一定温度下,在容积为10L的恒容密闭容器中进行该反应,起始时充入0.4molCO、0.3molNO,1min达平衡,测得CO的物质的量为0.16mol,则
①从开始到平衡时的反应速率v(CO)=
②NO的平衡转化率为
(2)研究在相同时间内不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的可能原因是

②外电路中,电子流动方向是
A.从
 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极③
 电极上的电极反应式为
电极上的电极反应式为(4)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的
 排放,SCR(选择性催化还原)工作原理如图b所示,NSR(
排放,SCR(选择性催化还原)工作原理如图b所示,NSR( 储存还原)工作原理如图c所示。
储存还原)工作原理如图c所示。
 )的水溶液热分解为
)的水溶液热分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②SCR催化过程中,当燃油中含硫量较高时,尾气中
 在
在 作用下会形成
作用下会形成 ,使催化剂中毒,用化学方程式表示
,使催化剂中毒,用化学方程式表示 的形成:
的形成:③NSR转换中,通过
 和
和 的相互转化实现
的相互转化实现 的储存和还原,图中NO的去除机理可描述为
的储存和还原,图中NO的去除机理可描述为
您最近一年使用:0次
6 . “价类”二维图体现了元素的分类观、转化观,下图是 元素及其化合物的“价类”二维图。下列说法正确的是
元素及其化合物的“价类”二维图。下列说法正确的是
 元素及其化合物的“价类”二维图。下列说法正确的是
元素及其化合物的“价类”二维图。下列说法正确的是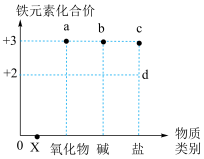
| A.a到b可以一步实现 | B.实验室保存d的溶液可以加入少量铜粉 |
| C.b为红褐色固体 | D.d转化为c需要加入还原剂 |
您最近一年使用:0次
名校
7 . 下列方程式或转化关系不正确的是
A.氨催化氧化生成N2O的化学方程式为2NH3+2O2 N2O+3H2O N2O+3H2O |
B.NH4Cl溶液与稀NaOH溶液反应的离子方程式为 +OH-=NH3∙H2O +OH-=NH3∙H2O |
C.N2 NH3 NH3 NH4Cl NH4Cl |
D.NH3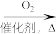 NO2 NO2 O2 O2 |
您最近一年使用:0次
名校
8 . 含氮化合物在工农业生产中有着十分重要的作用。铵盐、硝酸盐、尿素等可作植物生长的“食物”。但含氮化合物在生产和使用过程中产生的氮氧化物易造成光化学污染和硝酸型酸雨。所以氮氧化物需无害化处理,目前根据氮氧化物的来源处理的主流方法如下:
(1)方法一:工业废气(含 、
、 )利用石灰乳吸收,既能净化尾气,又能获得应用广泛的
)利用石灰乳吸收,既能净化尾气,又能获得应用广泛的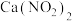 。
。
①写出该反应的方程式:___________ 。
②工业处理废气时,采用吸收塔,将废气从吸收塔底部通入,石灰乳从吸收塔顶部喷淋。这样操作的优点是:___________ 。
(2)方法二:“三元催化”是安装在汽车排气系统中最重要的机外净化装置。其工作原理是利用加装催化剂铑( )将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下:
)将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下:___________ 过程(填“吸热”或“放热”),还原产物为___________ ,当生成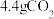 时,转移电子
时,转移电子___________  。
。
②请用文字描述过程I和过程II___________ 。
(1)方法一:工业废气(含
 、
、 )利用石灰乳吸收,既能净化尾气,又能获得应用广泛的
)利用石灰乳吸收,既能净化尾气,又能获得应用广泛的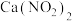 。
。①写出该反应的方程式:
②工业处理废气时,采用吸收塔,将废气从吸收塔底部通入,石灰乳从吸收塔顶部喷淋。这样操作的优点是:
(2)方法二:“三元催化”是安装在汽车排气系统中最重要的机外净化装置。其工作原理是利用加装催化剂铑(
 )将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下:
)将尾气中三种主要的有害物质转化为无害物质,该反应的过程示意图如下: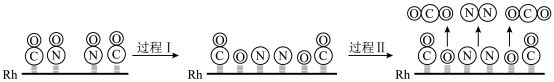
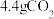 时,转移电子
时,转移电子 。
。②请用文字描述过程I和过程II
您最近一年使用:0次
9 . 实验室模拟“高炉煤气”(主要成分为: 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体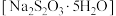 ,其部分实验过程如下:
,其部分实验过程如下: 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: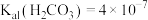 ,
,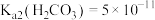 ;
;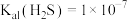 ,
,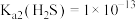 ;
;
(1)用70%硫酸和亚硫酸钠固体制取 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是___________ 。
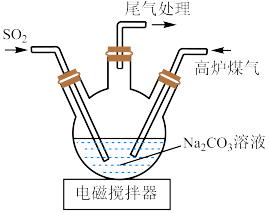
(2)三颈烧瓶中制取 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。
① 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: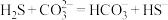 。该反应的平衡常数
。该反应的平衡常数
___________ 。
②写出三颈烧瓶中得到 的化学方程式
的化学方程式___________ 。
(3)尾气中含有大量 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为: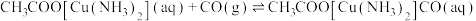
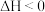
①研究发现尾气中过量 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是___________ 。
②写出吸收液再生的一种方法:___________ ,同时释放 ,达到资源化利用。
,达到资源化利用。
(4) 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: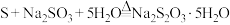 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取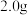 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中,___________ 。(实验中还需要使用的试剂有:乙醇、蒸馏水。)已知: 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:
 、
、 、
、 )和金属冶炼厂尾气(含
)和金属冶炼厂尾气(含 )为原料制备硫代硫酸钠晶体
)为原料制备硫代硫酸钠晶体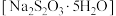 ,其部分实验过程如下:
,其部分实验过程如下: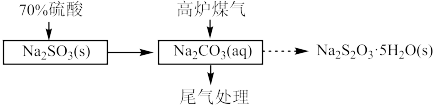
 和
和 常温下的电离平衡常数分别为:
常温下的电离平衡常数分别为: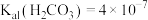 ,
,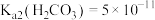 ;
;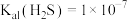 ,
,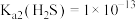 ;
;(1)用70%硫酸和亚硫酸钠固体制取
 ,而不是用10%的稀硫酸的原因是
,而不是用10%的稀硫酸的原因是(2)三颈烧瓶中制取
 分两步进行,
分两步进行, 与
与 溶液反应,
溶液反应, 再与它们反应的产物反应,得到
再与它们反应的产物反应,得到 。
。①
 与
与 溶液发生反应的离子方程式为:
溶液发生反应的离子方程式为: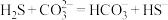 。该反应的平衡常数
。该反应的平衡常数
②写出三颈烧瓶中得到
 的化学方程式
的化学方程式(3)尾气中含有大量
 气体,可用醋酸亚铜氨溶液吸收,反应的方程式为:
气体,可用醋酸亚铜氨溶液吸收,反应的方程式为: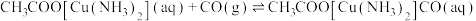
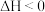
①研究发现尾气中过量
 会导致溶液吸收
会导致溶液吸收 的能力下降,原因是
的能力下降,原因是②写出吸收液再生的一种方法:
 ,达到资源化利用。
,达到资源化利用。(4)
 也可通过在溶液中发生下列反应制得:
也可通过在溶液中发生下列反应制得: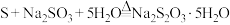 。补充完整制取
。补充完整制取 晶体的实验方案:称取
晶体的实验方案:称取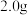 硫粉置于
硫粉置于 烧杯中,加少量乙醇使其湿润,再称取
烧杯中,加少量乙醇使其湿润,再称取 亚硫酸钠固体置于同一烧杯中,
亚硫酸钠固体置于同一烧杯中, 不溶于乙醇,其在水中的溶解度如下表:
不溶于乙醇,其在水中的溶解度如下表:| 温度/℃ | 0 | 10 | 20 | 30 | 40 |
| 溶解度/g | 50.2 | 59.7 | 70.1 | 83.2 | 104 |
您最近一年使用:0次
2024-04-23更新
|
172次组卷
|
2卷引用:2024届江苏省新高考基地学校高三下学期第五次大联考化学试题
10 . 金属 可以在高温条件下还原
可以在高温条件下还原 制备熔点较高金属
制备熔点较高金属 ,金属
,金属 是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原
是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原 制备金属
制备金属 ,工艺流程如图。下列说法
,工艺流程如图。下列说法不正确 的是
 可以在高温条件下还原
可以在高温条件下还原 制备熔点较高金属
制备熔点较高金属 ,金属
,金属 是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原
是一种重要的航空材料,其性质稳定,常温下不与稀盐酸反应;工业用镁还原 制备金属
制备金属 ,工艺流程如图。下列说法
,工艺流程如图。下列说法
A.工业上可通过电解熔融 制取金属 制取金属 |
B.用金属 还原 还原 过程中需要通入 过程中需要通入 作保护气 作保护气 |
C.“真空蒸馏”的目的是使 、 、 气化,实现与 气化,实现与 的分离 的分离 |
D.制得海绵针中含有少量金属 ,可以用稀盐酸浸泡除 ,可以用稀盐酸浸泡除 |
您最近一年使用:0次



