名校
解题方法
1 . 回答下列问题
(1)图1记录了1940~2000的60年间 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因______ 。 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:
①工业生产中的 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
碱液吸收法中沙及到的主要反应为: ,
, 。
。
若碱液回收尾气以后,溶液中 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为______ 。
氨还原法是在催化剂作用下,用 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为______ 、______ 。
若在相同条件下消耗的 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为______ 。
②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为______ 。
③结合社会生活中交通工具的变化,你认为 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?______ (请至少例举一条)
(1)图1记录了1940~2000的60年间
 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因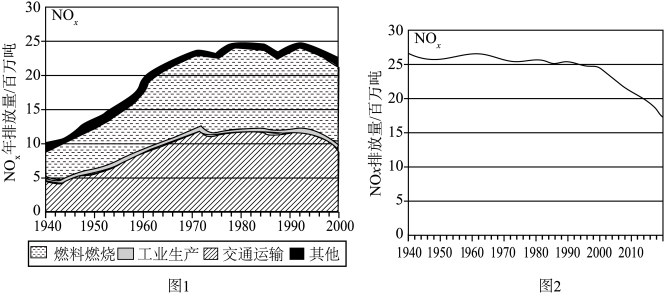
 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:①工业生产中的
 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。碱液吸收法中沙及到的主要反应为:
 ,
, 。
。若碱液回收尾气以后,溶液中
 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为氨还原法是在催化剂作用下,用
 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为若在相同条件下消耗的
 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为
③结合社会生活中交通工具的变化,你认为
 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?
您最近一年使用:0次
名校
解题方法
2 . 以下是一系列非金属元素间的置换反应,其中不能说明反应前的非金属单质的氧化性强于产物中非金属单质的氧化性的是
A. | B.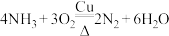 |
C. | D. |
您最近一年使用:0次
3 . 图表、坐标系、转化图等都是化学学科学习中常用的表达形式和工具,是高中生必备的基本技能之一。请大家通过阅读和分析,发现图示背后的化学原理,完成下列各题,并体会和感悟自然科学的研究方法和价值。
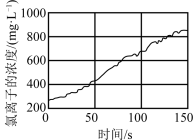
(1)某兴趣小组利用数字化实验测定光照过程中氯水中氯离子的浓度实验结果如图所示,请解释原因是___________ (用化学方程式表示)。 在空气中灼烧,测得灼烧过程中剩余固体的质量与起始
在空气中灼烧,测得灼烧过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时,
的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为___________ (化学式),请写出该反应的化学方程式___________ 。 可用于水体中
可用于水体中 的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得
的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所示。
浓度随反应时间的变化如图所示。 转化为
转化为 ,
,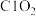 转化为
转化为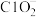 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②反应相同时间,水体中 浓度随pH增大而降低的原因是
浓度随pH增大而降低的原因是___________ 。
(4)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图所示,在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了___________ ,如果想要实现NaOH溶液的循环利用,你采取的措施是___________ 。
(1)某兴趣小组利用数字化实验测定光照过程中氯水中氯离子的浓度实验结果如图所示,请解释原因是
 在空气中灼烧,测得灼烧过程中剩余固体的质量与起始
在空气中灼烧,测得灼烧过程中剩余固体的质量与起始 的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时,
的质量的比值随温度变化的曲线如图所示。根据灼烧过程中铁元素守恒,可以通过计算确定800℃时, 氧化成含有两种元素的固体产物为
氧化成含有两种元素的固体产物为
 可用于水体中
可用于水体中 的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得
的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所示。
浓度随反应时间的变化如图所示。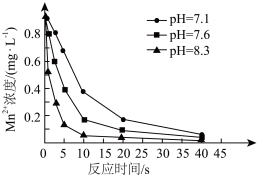
 转化为
转化为 ,
,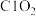 转化为
转化为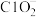 ,该反应的离子方程式为
,该反应的离子方程式为②反应相同时间,水体中
 浓度随pH增大而降低的原因是
浓度随pH增大而降低的原因是(4)某校科研人员利用NaOH溶液实现“碳捕获”的技术的装置如图所示,在整个“捕捉”过程中,将NaOH溶液喷成雾状是为了

您最近一年使用:0次
4 .  和
和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)碱液吸收。将硝酸工业的尾气(主要为 和
和 )通入
)通入 溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到
溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到 晶体。
晶体。
① 和
和 混合气体与
混合气体与 溶液反应生成
溶液反应生成 的离子方程式为
的离子方程式为______ .
②若使用 溶液代替
溶液代替 溶液,所得晶体中除含有
溶液,所得晶体中除含有 外,还有
外,还有______ (填化学式)。
(2)催化还原。汽车的尾气净化装置如图所示,在催化剂表面上 与
与 反应生成
反应生成 ,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是
,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是______ . 与
与 均转化为
均转化为 ,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。
,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。______ 。
②为使电池持续放电,离子交换膜应为______ 离子交换膜(填“阳”或“阴”)。
(4) 的氧化。已知
的氧化。已知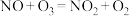 。室温下,固定进入反应器
。室温下,固定进入反应器 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中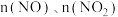 随反应前
随反应前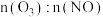 的变化如图所示。当
的变化如图所示。当 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是______ .
 和
和 等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。(1)碱液吸收。将硝酸工业的尾气(主要为
 和
和 )通入
)通入 溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到
溶液中充分吸收,所得溶液经浓缩、结晶、过滤,可以得到 晶体。
晶体。①
 和
和 混合气体与
混合气体与 溶液反应生成
溶液反应生成 的离子方程式为
的离子方程式为②若使用
 溶液代替
溶液代替 溶液,所得晶体中除含有
溶液,所得晶体中除含有 外,还有
外,还有(2)催化还原。汽车的尾气净化装置如图所示,在催化剂表面上
 与
与 反应生成
反应生成 ,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是
,若尾气的温度过高导致最终排放出的气体中氮氧化物浓度偏高,原因可能是
 与
与 均转化为
均转化为 ,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。
,既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。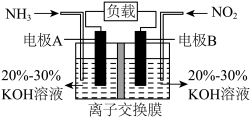
②为使电池持续放电,离子交换膜应为
(4)
 的氧化。已知
的氧化。已知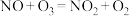 。室温下,固定进入反应器
。室温下,固定进入反应器 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中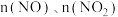 随反应前
随反应前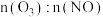 的变化如图所示。当
的变化如图所示。当 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是
您最近一年使用:0次
2024-05-07更新
|
191次组卷
|
3卷引用:江苏省连云港市东海县2023-2024学年高一下学期期中考试化学试题
江苏省连云港市东海县2023-2024学年高一下学期期中考试化学试题江苏省东海县2023-2024学年高一下学期期中考试化学试题(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
解题方法
5 . 含有氮氧化物(NO、NO2)的尾气和含有氨氮(NH3、 )的废水需处理后才能排放。
)的废水需处理后才能排放。
(1)氨氮污水直接排放入河流、湖泊导致的环境问题是_______ 。
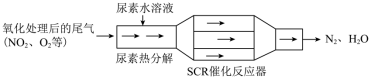
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:_______ 。
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。
② 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是_______ 。
(4)向含氨氮(NH3、 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。_______ 。
(5)含 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+_______ +2H2O。
 )的废水需处理后才能排放。
)的废水需处理后才能排放。(1)氨氮污水直接排放入河流、湖泊导致的环境问题是
(2)SCR(选择性催化还原)技术能有效降低柴油发动机中氮氧化物的排放,工作原理如图所示:
(3)用NaClO溶液吸收尾气中的NO,可提高NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 时发生反应的离子方程式为
时发生反应的离子方程式为②
 溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是
溶液的初始pH在4~8之间,pH越小,NO转化率越高,其原因是(4)向含氨氮(NH3、
 )废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。
)废水中加入NaClO溶液,使氨氮氧化成N2,NaClO的投加量[以m(Cl2)表示]对氨氮去除率的影响,实验结果如图所示。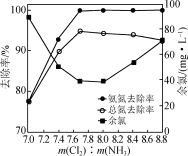
(5)含
 的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14
的废水可用二硫化亚铁(FeS2)处理,在反硝化细菌的作用下发生以下反应,请将离子方程式补充完整:14 +5FeS2+4H+
+5FeS2+4H+ 7N2↑+10
7N2↑+10 +
+
您最近一年使用:0次
6 . 高纯 在光热发电领域应用广泛,部分生产方法及性质研究如下:
在光热发电领域应用广泛,部分生产方法及性质研究如下: 、NO、
、NO、 。请回答下列问题:
。请回答下列问题:
(1)方法I中,5℃时反应的离子方程式是________ 。写出溶液A中的所有离子:________ .
(2)KOH溶液吸收NO、 ,反应方程式如下:
,反应方程式如下:
i.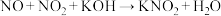 (未配平)
(未配平)
ii.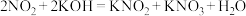
①配平并写出反应i的化学方程式:________ ;
②方法II中,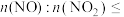
________ ,氮氧化物才能被足量的KOH溶液充分吸收。
(3)方法II中,“氧化吸收液”的目的是________ 。
(4)已知气体B是一种单质,则所得固体C为________ (填写化学式)。
(5)在某温度下, 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂 。
。
①写出 与
与 、
、 共热制取
共热制取 的化学方程式:
的化学方程式:________ 。
② 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:________ 。
 在光热发电领域应用广泛,部分生产方法及性质研究如下:
在光热发电领域应用广泛,部分生产方法及性质研究如下: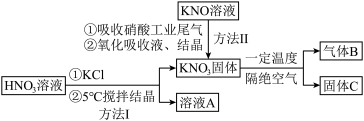
 、NO、
、NO、 。请回答下列问题:
。请回答下列问题:(1)方法I中,5℃时反应的离子方程式是
(2)KOH溶液吸收NO、
 ,反应方程式如下:
,反应方程式如下:i.
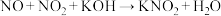 (未配平)
(未配平)ii.
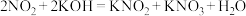
①配平并写出反应i的化学方程式:
②方法II中,
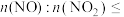
(3)方法II中,“氧化吸收液”的目的是
(4)已知气体B是一种单质,则所得固体C为
(5)在某温度下,
 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂 。
。①写出
 与
与 、
、 共热制取
共热制取 的化学方程式:
的化学方程式:②
 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性。请依据上述信息,设计检验沉淀中的金属元素的实验方案:
您最近一年使用:0次
名校
7 . 利用元素的化合价物质类别的坐标系,可以对含某元素的各物质性质有整体的认识。如图是硫元素的常见化合价与部分物质类别的对应关系。______ ;检验其阴离子的方法是______ 。
(2)化石燃料的燃烧可产生 ,在上述图表中它是
,在上述图表中它是______ (图中的字母),为避免过多 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为______ 。
②氧化的目的是将硫元素全部转化为 ,该过程中溶液pH
,该过程中溶液pH______ (填“升高”“不变”或“降低”)。
③排放海水与原海水相比,减少的 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为______ 。
(3)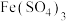 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为______ ;每脱除170kg X,消耗标准状况下 的体积为
的体积为______ L。
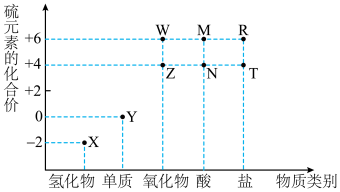
(2)化石燃料的燃烧可产生
 ,在上述图表中它是
,在上述图表中它是 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。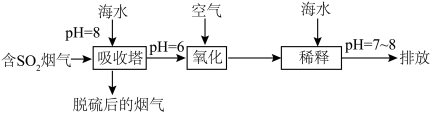
 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为②氧化的目的是将硫元素全部转化为
 ,该过程中溶液pH
,该过程中溶液pH③排放海水与原海水相比,减少的
 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为(3)
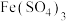 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为 的体积为
的体积为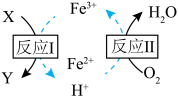
您最近一年使用:0次
名校
解题方法
8 . 海水是资源宝库,下图是对海水资源的综合利用的部分片段(其中某些操作或试剂已省略)。 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是______ 。
据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
有同学认为在除杂试剂的选择上,可以用 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?______ ,理由是______ 。
根据以上数据,至少可以判断海水中还存在没有列出的其它______ (填“阳离子”、“阴离子”)。
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是______ 。
实验室模拟上述反应过程,将 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式______ 。
再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是______ 。

 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
离子 | 物质的量含量(mol/kg) |
| 0.51 |
| 0.46 |
| 0.028 |
| 0.054 |
| 0.01 |
| 0.01 |
 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?根据以上数据,至少可以判断海水中还存在没有列出的其它
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是
实验室模拟上述反应过程,将
 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现
 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是
您最近一年使用:0次
名校
9 . 下列有关推理中得到的结论与事实不相符合的是
A.Cu可以还原 得到 得到 ,所以Fe也可以还原 ,所以Fe也可以还原 生成 生成 |
B.常温条件下,Cu与浓硝酸剧烈反应放出 气体,所以Fe和浓硝酸反应将更加剧烈 气体,所以Fe和浓硝酸反应将更加剧烈 |
C. 与NaOH溶液反应生成碳酸盐, 与NaOH溶液反应生成碳酸盐, 也与NaOH溶液反应生成亚硫酸盐 也与NaOH溶液反应生成亚硫酸盐 |
| D.亚硫酸的酸性强于碳酸,所以硫酸的酸性也强于碳酸 |
您最近一年使用:0次
2024·江苏·模拟预测
10 . 氮氧化物会严重污染空气,汽车尾气及一些工业生产的烟气中都含有氮氧化物,工业上常用催化转化法、氨还原法、氧化剂氧化法进行处理。回答下列问题:
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:
N2(g)+O2(g) 2NO(g) △H1=+180.0kJ·mol-1 ①
2NO(g) △H1=+180.0kJ·mol-1 ①
CO(g)+ O2(g)
O2(g)  CO2(g) △H2=-283.5kJ·mol-1 ②
CO2(g) △H2=-283.5kJ·mol-1 ②
则反应2CO(g)+2NO(g) N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=_______ 。
(2)在2L的密闭容器中充入1molNO2和2molCO,发生下述反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的
N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的_______ 点。_______ ,历程图中总反应的化学方程式为_______ 。 ,并放出热量。
,并放出热量。
①该反应的离子方程式为_______ 。
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++ =Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是_______ ;以NaClO2溶液为吸收剂,NO的氧化率随温度的变化情况,如图2所示,温度超过60℃后,NO氧化率下降,试解释其原因:_______ 。
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:
N2(g)+O2(g)
 2NO(g) △H1=+180.0kJ·mol-1 ①
2NO(g) △H1=+180.0kJ·mol-1 ①CO(g)+
 O2(g)
O2(g)  CO2(g) △H2=-283.5kJ·mol-1 ②
CO2(g) △H2=-283.5kJ·mol-1 ②则反应2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=(2)在2L的密闭容器中充入1molNO2和2molCO,发生下述反应:4CO(g)+2NO2(g)
 N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的
N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的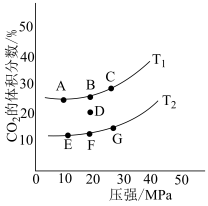

 ,并放出热量。
,并放出热量。①该反应的离子方程式为
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++
 =Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
您最近一年使用:0次








