名校
1 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取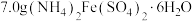 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至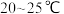 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加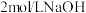 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于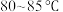 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,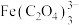 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
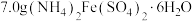 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至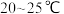 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加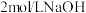 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于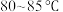 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
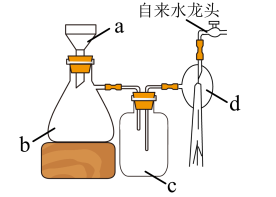
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,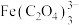 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
2024-05-26更新
|
393次组卷
|
3卷引用:江苏省南京外国语学校2024届高三下学期二模化学试题
2 . 实验室用磷矿脱镁废液制备 的实验过程可表示为
的实验过程可表示为 及少量
及少量 、
、 、
、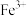 、
、 和
和 。
。
①向废液中加入 溶液调节
溶液调节 为
为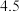 ,可达到
,可达到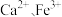 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为_________ 。
②将除杂净化后的清液控制在一定温度,加入 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是_______ 。 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是_______ 。
(2)实验室用如下方案测定 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取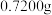 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成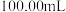 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用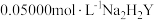 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗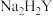 标准液
标准液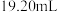 。计算该产品中
。计算该产品中 的纯度
的纯度_______ (写出计算过程)。
(3)恒温转化后的母液中主要含 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下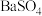 、
、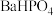 的溶度积常数依次为
的溶度积常数依次为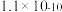 和
和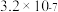 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中_______ ,过滤、用无水乙醇洗涤,干燥。
 的实验过程可表示为
的实验过程可表示为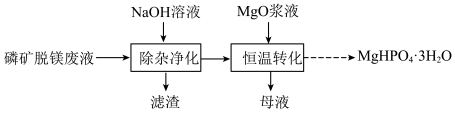
 及少量
及少量 、
、 、
、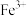 、
、 和
和 。
。①向废液中加入
 溶液调节
溶液调节 为
为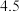 ,可达到
,可达到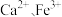 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为②将除杂净化后的清液控制在一定温度,加入
 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是
 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是(2)实验室用如下方案测定
 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取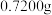 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成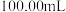 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用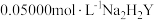 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗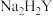 标准液
标准液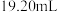 。计算该产品中
。计算该产品中 的纯度
的纯度(3)恒温转化后的母液中主要含
 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下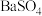 、
、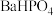 的溶度积常数依次为
的溶度积常数依次为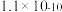 和
和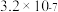 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中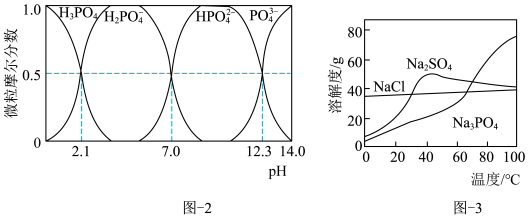
您最近一年使用:0次
3 . 以软锰矿浆(含 及少量
及少量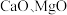 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。
(1)吸收 。
。
①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
②脱硫过程中软锰矿浆的 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是_______ 。 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿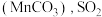 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是_______ 。
(2)净化 。
。
①过滤脱硫后的软锰矿浆液,用 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于_______  。(已知:
。(已知: 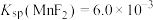 、
、 ,
, 、)
、)
②净化时生成的 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为_______ 。 。
。
①向反应器中加入 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:_______ 。
②实际生产中,常将 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入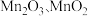 等,其原因是
等,其原因是_______ 。
 及少量
及少量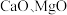 等)吸收烟气中
等)吸收烟气中 并制备高纯
并制备高纯 。
。(1)吸收
 。
。①将烟气与软锰矿浆在吸收塔中逆流接触,烟气中的
 被充分吸收,矿浆中的
被充分吸收,矿浆中的 转化为
转化为 。写出
。写出 与
与 发生反应的化学方程式:
发生反应的化学方程式:②脱硫过程中软锰矿浆的
 和
和 吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆
吸收率的变化关系如图所示。随着脱硫的进行,软锰矿浆 下降,但15小时前
下降,但15小时前 下降缓慢,其主要原因是
下降缓慢,其主要原因是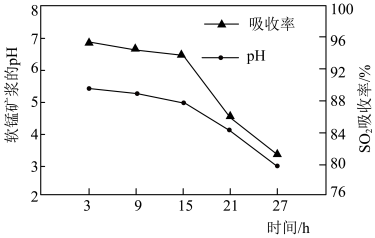
 吸收率急剧下降。此时加入菱锰矿
吸收率急剧下降。此时加入菱锰矿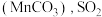 吸收率又可恢复至
吸收率又可恢复至 以上,其原因是
以上,其原因是(2)净化
 。
。①过滤脱硫后的软锰矿浆液,用
 沉淀除去所得滤液中的
沉淀除去所得滤液中的 、Mg2+(浓度小于
、Mg2+(浓度小于 )。此时应控制溶液中
)。此时应控制溶液中 略大于
略大于 。(已知:
。(已知: 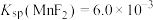 、
、 ,
, 、)
、)②净化时生成的
 沉淀晶胞结构如图所示。在
沉淀晶胞结构如图所示。在 晶胞中
晶胞中 周围距离最近的
周围距离最近的 形成的空隙构型为
形成的空隙构型为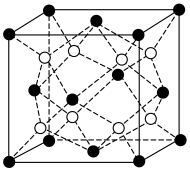
 。
。①向反应器中加入
 溶液,控制80℃恒温,搅拌下鼓入空气可制得
溶液,控制80℃恒温,搅拌下鼓入空气可制得 。写出生成
。写出生成 的离子方程式:
的离子方程式:②实际生产中,常将
 溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入
溶液和氨水并流加入反应器。若加入的氨水量不足,产品中会混入 等,其原因是
等,其原因是
您最近一年使用:0次
2024-05-25更新
|
319次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三下学期教学情况调研(二)(二模)化学试题
解题方法
4 . 利用电解产生的 与
与 发生反应生成高活性的羟基自由基(
发生反应生成高活性的羟基自由基( ,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是
,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是
 与
与 发生反应生成高活性的羟基自由基(
发生反应生成高活性的羟基自由基( ,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是
,有很强氧化性),能有效降解水体中的有机污染物,原理如图所示。下列说法正确的是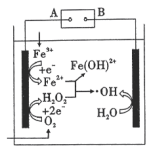
| A.电源的B极为负极 |
| B.生成羟基自由基的反应仅有一个 |
| C.利用羟基自由基来处理有机物,效率高、无污染 |
D.电解池外电路转移 电子,理论上可产生的 电子,理论上可产生的 为 为 |
您最近一年使用:0次
名校
5 . 研究 、
、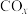 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
(1)采用 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: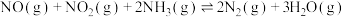 。以下说法正确的是______。
。以下说法正确的是______。
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:__________ 。(填“极性键”、“非极性键”或“极性键和非极性键”)。过程Ⅱ为__________ 过程(填“吸热”或“放热”)。
②已知过程Ⅰ的焓变为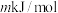 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为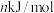 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:__________ 。
(3) 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为:__________ 。其中__________ 是催化剂(填化学符号)。______ (填选项)。(A.化学能转化为电能 B.电能转化为化学能),石墨Ⅰ是该电化学装置的______ (填选项)(A.正极 B.负极)石墨Ⅰ电极上发生的电极反应为__________ (提醒:介质为熔融 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为__________ 。
 、
、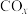 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。(1)采用
 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: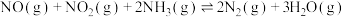 。以下说法正确的是______。
。以下说法正确的是______。A.使用催化剂更有利于提高 的平衡转化率 的平衡转化率 |
| B.及时吹脱水蒸气,可以提高脱氮率 |
| C.其他条件不变的条件下,改变压强对脱氮率没有影响 |
| D.烟气通过催化剂的流速越快,脱氮效果会越好 |
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:

②已知过程Ⅰ的焓变为
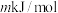 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为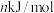 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:(3)
 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为: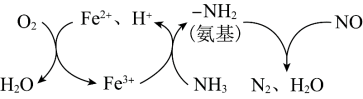
 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为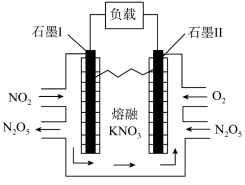
您最近一年使用:0次
名校
解题方法
6 . 氮化钛( )是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用
)是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用 在高温条件制备
在高温条件制备 并测定产率的装置如图所示(夹持装置省略)。
并测定产率的装置如图所示(夹持装置省略)。
(1)仪器a的名称是___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中的试剂是___________ 。
(3)实验尾气为无色气体,写出制备 反应的化学方程式;
反应的化学方程式;___________ 。
(4)D中 的作用是
的作用是___________ 。
(5)反应前称取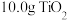 样品,反应后称得瓷舟中固体的质量为
样品,反应后称得瓷舟中固体的质量为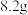 ,则
,则 的产率为
的产率为___________ 。
(6)已知 晶体的晶胞结构如图所示,氮原子位于钛原子围成的
晶体的晶胞结构如图所示,氮原子位于钛原子围成的___________ (填立体构型)的中心,假设钛原子与氮原子相切,则氮原子与钛原子半径的比值为_________ (列出计算式即可)。
 )是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用
)是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用 在高温条件制备
在高温条件制备 并测定产率的装置如图所示(夹持装置省略)。
并测定产率的装置如图所示(夹持装置省略)。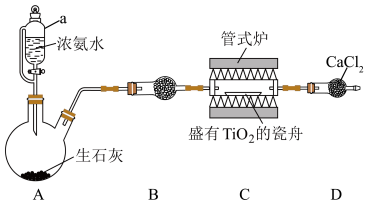
(1)仪器a的名称是
(2)装置B中的试剂是
(3)实验尾气为无色气体,写出制备
 反应的化学方程式;
反应的化学方程式;(4)D中
 的作用是
的作用是(5)反应前称取
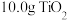 样品,反应后称得瓷舟中固体的质量为
样品,反应后称得瓷舟中固体的质量为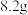 ,则
,则 的产率为
的产率为(6)已知
 晶体的晶胞结构如图所示,氮原子位于钛原子围成的
晶体的晶胞结构如图所示,氮原子位于钛原子围成的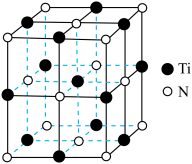
您最近一年使用:0次
名校
解题方法
7 . 五氧化二钒主要用作合金添加剂,含钒钢具有强度高,韧性大,耐磨性好等优良特性。工业上常用炼钢残渣(主要含 及少量铁粉、
及少量铁粉、 、
、 、
、 等杂质)为原料制取
等杂质)为原料制取 的一种工艺流程如图所示:
的一种工艺流程如图所示: 难溶于水,
难溶于水, 。
。
回答下列问题:
(1)基态钒原子的价层电子排布式为___________ 。
(2)“焙烧”时通入大量空气的作用是___________ 。
(3)“碱浸”所得滤渣的主要成分是___________ 。
(4)写出“沉硅、铝”反应的离子方程式:___________ 、___________ 。
(5)若滤液中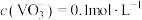 ,为使钒元素沉淀率达到
,为使钒元素沉淀率达到 ,应使“沉钒”后溶液中的
,应使“沉钒”后溶液中的 不低于
不低于___________ 。
(6)“沉钒”析出的 晶体需要洗涤,证明
晶体需要洗涤,证明 已洗涤干净的实验操作及现象为
已洗涤干净的实验操作及现象为___________ 。
(7)在空气中“煅烧”生成的气体可直接排放到空气中,写出反应的化学方程式:___________ 。
 及少量铁粉、
及少量铁粉、 、
、 、
、 等杂质)为原料制取
等杂质)为原料制取 的一种工艺流程如图所示:
的一种工艺流程如图所示: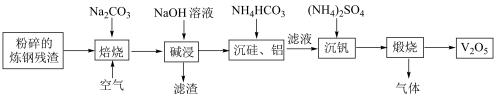
 难溶于水,
难溶于水, 。
。回答下列问题:
(1)基态钒原子的价层电子排布式为
(2)“焙烧”时通入大量空气的作用是
(3)“碱浸”所得滤渣的主要成分是
(4)写出“沉硅、铝”反应的离子方程式:
(5)若滤液中
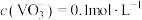 ,为使钒元素沉淀率达到
,为使钒元素沉淀率达到 ,应使“沉钒”后溶液中的
,应使“沉钒”后溶液中的 不低于
不低于(6)“沉钒”析出的
 晶体需要洗涤,证明
晶体需要洗涤,证明 已洗涤干净的实验操作及现象为
已洗涤干净的实验操作及现象为(7)在空气中“煅烧”生成的气体可直接排放到空气中,写出反应的化学方程式:
您最近一年使用:0次
8 . 锂电池的研发、使用及废电池的回收具有重要意义。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为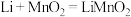 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是___________ (填序号)。
A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀 作电解质
作电解质
(2)钴酸锂( )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。
①钴酸锂电池放电时示意图如图1所示。放电时, 由
由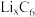 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式:___________ 。 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=___________ 。 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。___________ 。
②与 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:___________ 。
(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用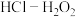 混合物作浸取剂。
混合物作浸取剂。
①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:___________ 。
②工业生产时在盐酸中加入 ,
, 的作用是
的作用是___________ 。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为
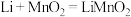 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀
 作电解质
作电解质(2)钴酸锂(
 )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。①钴酸锂电池放电时示意图如图1所示。放电时,
 由
由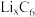 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式: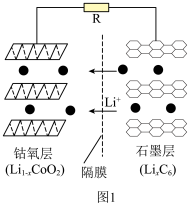
 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=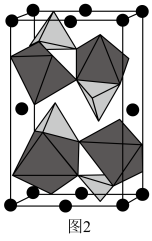
 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。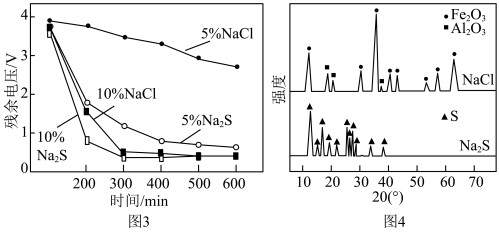
②与
 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为
 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用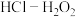 混合物作浸取剂。
混合物作浸取剂。①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:
②工业生产时在盐酸中加入
 ,
, 的作用是
的作用是
您最近一年使用:0次
解题方法
9 . 碱金属和碱土金属元素分别位于元素周期表的ⅠA族和ⅡA族,它们的化合物应用广泛。历史上曾以NaCl为原料生产NaOH作为化学工业开端的标志。 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如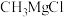 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。
碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如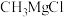 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
A.侯氏制碱法中的物质转化: |
B.由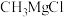 制备乙酸的物质转化: 制备乙酸的物质转化: |
C.电解饱和NaCl溶液的阴极反应: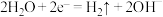 |
D. 与 与 共熔的反应: 共熔的反应: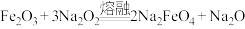 |
您最近一年使用:0次
解题方法
10 . 高效氧化剂亚氯酸钠( )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。
(1) 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为_______ 。
②“反应1”的产物 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是_______ 。
(2) 溶液对烟气脱硝。
溶液对烟气脱硝。
①酸性条件下, 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为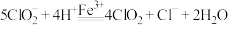 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:
I.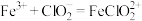 ;
;
Ⅱ._______ ;
Ⅲ.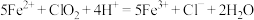 。
。
② 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。 增大而增大的原因是
增大而增大的原因是_______ 。
ii.温度升高,NO氧化率先增大后减小的可能原因是_______ 。
(3) 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为_______ 。
 )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。(1)
 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为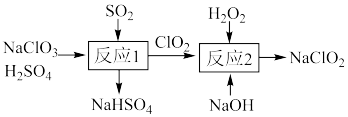
②“反应1”的产物
 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是(2)
 溶液对烟气脱硝。
溶液对烟气脱硝。①酸性条件下,
 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为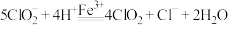 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:I.
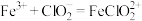 ;
;Ⅱ.
Ⅲ.
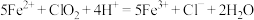 。
。②
 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。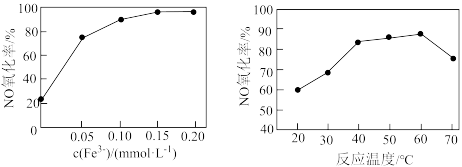
 增大而增大的原因是
增大而增大的原因是ii.温度升高,NO氧化率先增大后减小的可能原因是
(3)
 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为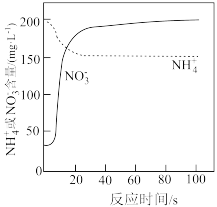
您最近一年使用:0次



