名校
1 . 关于反应K2H3IO6+9HI=2KI+4I2+6H2O (I:127),下列说法正确的是
| A.K2H3IO6发生还原反应 | B.KI是还原产物 |
| C.生成12.7g I2时,转移0.1mol电子 | D.还原剂与氧化剂的物质的量之比为1:7 |
您最近一年使用:0次
2 . 一定温度下,在 的四氯化碳溶液(
的四氯化碳溶液( )中发生分解反应:
)中发生分解反应: 。不同时刻测量放出的
。不同时刻测量放出的 体积,换算成
体积,换算成 浓度如下表所示(
浓度如下表所示( 为阿伏加德罗常数的值):
为阿伏加德罗常数的值):
下列说法错误的是
 的四氯化碳溶液(
的四氯化碳溶液( )中发生分解反应:
)中发生分解反应: 。不同时刻测量放出的
。不同时刻测量放出的 体积,换算成
体积,换算成 浓度如下表所示(
浓度如下表所示( 为阿伏加德罗常数的值):
为阿伏加德罗常数的值):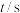 | 0 | 600 | 1200 | 1710 | 2220 | 2820 |
 | 1.40 | 0.96 | 0.66 | 0.48 | 0.35 | 0.24 |
| A.N、O均位于周期表中的p区 |
B.生成 时,转移电子的数目为 时,转移电子的数目为 |
C.反应 时,生成 时,生成 体积为 体积为 (标准状况) (标准状况) |
D.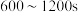 ,生成 ,生成 的平均速率为 的平均速率为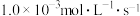 |
您最近一年使用:0次
名校
3 . 以重晶石(BaSO4)为原料生产白色颜料立德粉(ZnS和BaSO4混合物)的工艺流程如图所示:
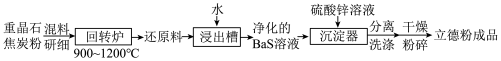
| A.混料研细的目的是加快回转炉中的反应速率 |
| B.回转炉中每生成1molBaS,有4mole-发生转移 |
| C.浸出槽的滤渣经处理后循环利用,可提高原料利用率 |
D.沉淀器中发生的反应为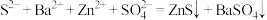 |
您最近一年使用:0次
2024-03-18更新
|
85次组卷
|
2卷引用:河南省名校联盟2023-2024学年高三上学期12月月考化学试题
4 . 已知酸性 溶液可与
溶液可与 反应生成
反应生成 和
和 。现将稀硫酸酸化的
。现将稀硫酸酸化的 溶液与
溶液与 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中
溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中 的物质的量随加入的KI的物质的量的变化关系如图所示(已知
的物质的量随加入的KI的物质的量的变化关系如图所示(已知 生成
生成 ),下列说法中正确的是
),下列说法中正确的是
 溶液可与
溶液可与 反应生成
反应生成 和
和 。现将稀硫酸酸化的
。现将稀硫酸酸化的 溶液与
溶液与 溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中
溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中 的物质的量随加入的KI的物质的量的变化关系如图所示(已知
的物质的量随加入的KI的物质的量的变化关系如图所示(已知 生成
生成 ),下列说法中正确的是
),下列说法中正确的是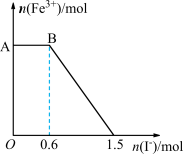
A.由图可知,氧化性: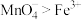 ,还原性: ,还原性: |
B.BC段发生的反应为 |
C. 与 与 反应的方程式中二者系数之比为1∶6 反应的方程式中二者系数之比为1∶6 |
D.开始加入的 为0.3mol 为0.3mol |
您最近一年使用:0次
2024-03-17更新
|
55次组卷
|
2卷引用:河南省焦作市博爱县第一中学2023-2024学年高一下学期4月期中考试化学试题
5 . 价类二维图是学习元素及其化合物知识的重要模型。它是以元素化合价为纵坐标,物质类别为横坐标的二维平面图像。如图为氯元素的价类二维图。___________ ,写出③的化学式___________ ,①中含有的化学键类型为___________ ,请用电子式表示物质⑤___________ 。
(2)写出实验室用二氧化锰固体与浓盐酸制备物质②的离子方程式___________ ,在该反应中浓盐酸体现了___________ 性。若制备标准状况下5.6L的物质②,则被氧化的HCl的质量为___________ 克。
(3)管道工人通常用浓氨水检查输送②的管道是否漏气,生成无色无味的气体,还有白烟生成,写出反应方程式___________ 。若有1mol气体生成,转移电子数为___________ 个。

(2)写出实验室用二氧化锰固体与浓盐酸制备物质②的离子方程式
(3)管道工人通常用浓氨水检查输送②的管道是否漏气,生成无色无味的气体,还有白烟生成,写出反应方程式
您最近一年使用:0次
6 . 写出下列反应中转移的电子数目。
(1)1molCl2和NaOH反应转移电子数_______ 。
(2)3molNO2和H2O反应转移电子数_______ 。
(1)1molCl2和NaOH反应转移电子数
(2)3molNO2和H2O反应转移电子数
您最近一年使用:0次
名校
7 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(3)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与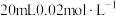 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(4)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(5)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为___________ 。

(2)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(3)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与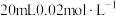 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(4)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(5)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为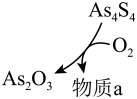
您最近一年使用:0次
2024-03-11更新
|
311次组卷
|
2卷引用:河南省新乡市原阳县实验高级中学2023-2024学年高一下学期3月月考化学试题
8 . 硫化氢的转化是资源利用和环境保护的重要研究课题.将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 ,其转化如图所示(
,其转化如图所示( 不溶于水).下列说法中,不正确的是
不溶于水).下列说法中,不正确的是

 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收
的混合溶液中回收 ,其转化如图所示(
,其转化如图所示( 不溶于水).下列说法中,不正确的是
不溶于水).下列说法中,不正确的是
A.过程①中,生成 的反应为 的反应为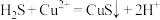 |
B.过程②中, 作氧化剂 作氧化剂 |
C.每生成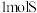 ,整个过程转移电子数为 ,整个过程转移电子数为 |
D.回收 的总反应为 的总反应为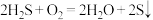 |
您最近一年使用:0次
9 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.25g质量分数为46%的乙醇水溶液中含有的氢原子数为 |
B.将22.4L(标准状况)Cl2通入足量水中,转移的电子数为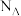 |
C.1molH2和1molO2在一定条件下完全反应,转移的电子数为 |
D.64gSO2和32gO2混合,反应一段时间后总原子数为 |
您最近一年使用:0次
名校
解题方法
10 . 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:
(1)FeCl3溶液用于腐蚀铜箔印刷线路板,该反应的离子方程式为___________ 。
(2)经检测某酸性废水中所含离子及其浓度如表所示:
则(Al3+)=___________ mol/L。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作I”所需要的玻璃仪器除烧杯外,还需要的是___________ 、___________ 。
②FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为___________ 。
③1.0kg含铁95%的废铁屑,操作I损失率为2%,操作Ⅱ损失率为1%,最后获得Fe2O3的质量为___________ kg。
(4)用托盘天平(1g以下用游码)称量绿矾(FeSO4∙7H2O)晶体配制450mL0.1mol/L溶液,需要绿矾的质量为___________ ;配制过程以下实验操作会导致所配溶液浓度偏低的是___________ 。
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻度线,未补加水
d.定容时,俯视刻度线
(1)FeCl3溶液用于腐蚀铜箔印刷线路板,该反应的离子方程式为
(2)经检测某酸性废水中所含离子及其浓度如表所示:
| 离子 |  |  |  |  |  |
| 浓度/(mol/L) | 2×10-2 | 1×10-1 | 2×10-2 | 1×10-1 |
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作I”所需要的玻璃仪器除烧杯外,还需要的是
②FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为
③1.0kg含铁95%的废铁屑,操作I损失率为2%,操作Ⅱ损失率为1%,最后获得Fe2O3的质量为
(4)用托盘天平(1g以下用游码)称量绿矾(FeSO4∙7H2O)晶体配制450mL0.1mol/L溶液,需要绿矾的质量为
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻度线,未补加水
d.定容时,俯视刻度线
您最近一年使用:0次
2024-03-04更新
|
88次组卷
|
2卷引用:河南省许昌高级中学2023-2024学年高一下学期开学化学试题



