1 . 化学离不开实验,请结合实验回答相应问题。
I.实验室需配制250mL浓度为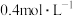 的
的 标准溶液进行有关实验。
标准溶液进行有关实验。
(1)配制时,先用托盘天平称取 固体
固体___________ g,然后进行下列操作,其中错误的是___________ (填标号)。
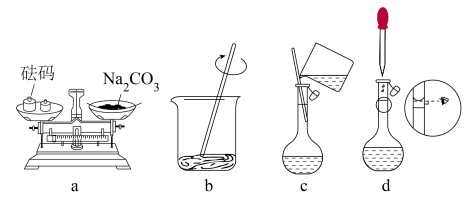
(2)下列有关容量瓶使用方法的操作中,正确的是___________(填标号)。
(3)___________ 
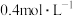 的
的 溶液与
溶液与
 的盐酸恰好完全反应生成
的盐酸恰好完全反应生成 。
。
II.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计如下图所示的实验装置。
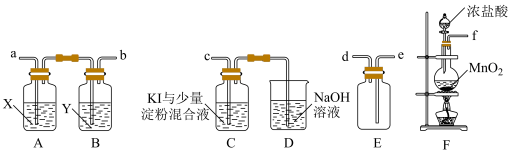
(4)整套装置的连接顺序是:f→___________ →c(按气体流动方向填各接口的小写字母,不重复)。
(5)B装置的作用是___________ 。
(6)某反应体系有反应物和生成物共7种: ,
, 、
、 、
、 、
、 、
、 、
、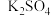 ,已知该反应过程中产生气泡,则该反应中的还原剂是
,已知该反应过程中产生气泡,则该反应中的还原剂是___________ (填化学式),请正确书写该反应的化学方程式___________ 。
I.实验室需配制250mL浓度为
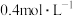 的
的 标准溶液进行有关实验。
标准溶液进行有关实验。(1)配制时,先用托盘天平称取
 固体
固体
(2)下列有关容量瓶使用方法的操作中,正确的是___________(填标号)。
| A.容量瓶只能用于配制溶液,不能储存溶液。 |
| B.进行容量瓶检漏时,容量瓶倒置一次即可。 |
| C.容量瓶用蒸馏水洗涤干净后,可以自然晾干或者烘箱烘干。 |
D. 固体在烧杯里完全溶解后,立即将溶液转移到容量瓶中。 固体在烧杯里完全溶解后,立即将溶液转移到容量瓶中。 |
(3)

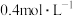 的
的 溶液与
溶液与
 的盐酸恰好完全反应生成
的盐酸恰好完全反应生成 。
。II.某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计如下图所示的实验装置。

(4)整套装置的连接顺序是:f→
(5)B装置的作用是
(6)某反应体系有反应物和生成物共7种:
 ,
, 、
、 、
、 、
、 、
、 、
、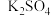 ,已知该反应过程中产生气泡,则该反应中的还原剂是
,已知该反应过程中产生气泡,则该反应中的还原剂是
您最近一年使用:0次
2 . 电子工业用 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。
(1)请写出 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式___________ 。
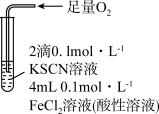
(2)某研究性学习小组为测定 溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:
溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:
①取少量待测液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是___________ 。
②溶液组成的测定:取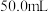 待测液,加入足量的
待测液,加入足量的 溶液,得到
溶液,得到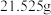 白色沉淀,则溶液中
白色沉淀,则溶液中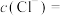
___________  。
。
(3)从腐蚀废液(主要含 、
、 、
、 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液,废液处理流程如下:
溶液,废液处理流程如下:
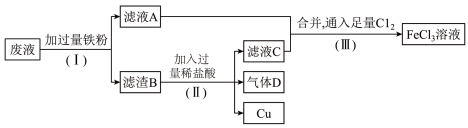
①滤渣B中主要含有___________ ,气体D是___________ 。
②写出步骤(Ⅲ)中生成 的化学方程式
的化学方程式___________ 。
③步骤(Ⅲ)中,将 换成
换成___________ 也能达到同样的目的,写出所换成的物质将 氧化为
氧化为 的离子方程式
的离子方程式___________ 。
 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,运用所学知识,回答下列问题。(1)请写出
 溶液与铜反应的离子方程式
溶液与铜反应的离子方程式(2)某研究性学习小组为测定
 溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:
溶液腐蚀铜后所得溶液的组成,进行了研究,其中部分实验如下:①取少量待测液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
②溶液组成的测定:取
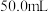 待测液,加入足量的
待测液,加入足量的 溶液,得到
溶液,得到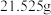 白色沉淀,则溶液中
白色沉淀,则溶液中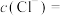
 。
。(3)从腐蚀废液(主要含
 、
、 、
、 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液,废液处理流程如下:
溶液,废液处理流程如下:
①滤渣B中主要含有
②写出步骤(Ⅲ)中生成
 的化学方程式
的化学方程式③步骤(Ⅲ)中,将
 换成
换成 氧化为
氧化为 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
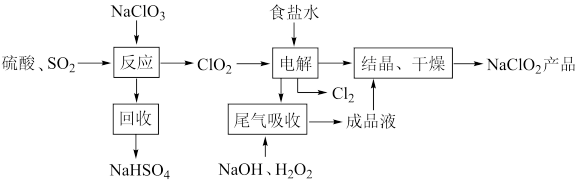
3 .  是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
(1) 中
中 的化合价为
的化合价为_______ 。
(2)写出“反应步骤中生成 的化学方程式
的化学方程式_______ 。
(3)“尾气吸收”是吸收“电解”过程排出的少量 ,发生如下反应:
,发生如下反应: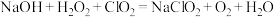
①配平化学方程式,并用单线桥表示电子转移方向和数目_______ 。
②此吸收反应中,氧化产物是_______ ,氧化剂与还原剂的个数比为_______ 。
③比较氧化性:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为_______  。(计算结果保留两位小数)
。(计算结果保留两位小数)
 是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
是一种重要的杀菌消毒剂,可通过上述制取的精制食盐水通过以下流程制备:
(1)
 中
中 的化合价为
的化合价为(2)写出“反应步骤中生成
 的化学方程式
的化学方程式(3)“尾气吸收”是吸收“电解”过程排出的少量
 ,发生如下反应:
,发生如下反应: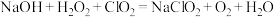
①配平化学方程式,并用单线桥表示电子转移方向和数目
②此吸收反应中,氧化产物是
③比较氧化性:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为 。(计算结果保留两位小数)
。(计算结果保留两位小数)
您最近一年使用:0次
名校
解题方法
4 . 碳酸锰MnCO3是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O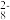 >MnO
>MnO >
>
可能用到的数据如下:
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为_____ ,
(2)在实验室进行步骤A操作时,可能用到的主要仪器为_____ 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是_____ 。
(4)步骤G发生的离子方程式为___ ,若Mn2+恰好沉淀完全时测得溶液中CO 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=_____ (mol/L)2。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O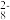 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O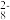 中S的化合价为
中S的化合价为_____ 。请写出对应的离子方程式_____ 。

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O
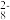 >MnO
>MnO >
>
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)基态锰原子的价层电子排布式为
(2)在实验室进行步骤A操作时,可能用到的主要仪器为
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是
(4)步骤G发生的离子方程式为
 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O
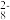 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O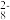 中S的化合价为
中S的化合价为
您最近一年使用:0次
名校
解题方法
5 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原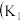 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。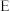 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
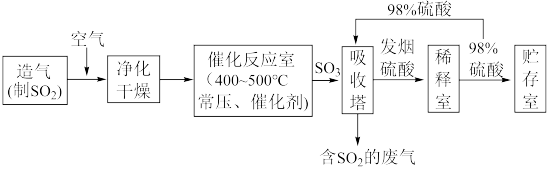
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: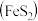 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原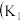 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
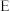 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
720次组卷
|
4卷引用:广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题
6 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
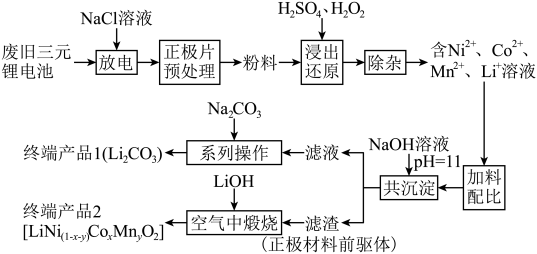
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为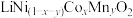 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的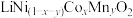 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
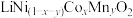 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
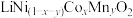 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
7 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和FeO)为原料,采用酸溶法制取 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
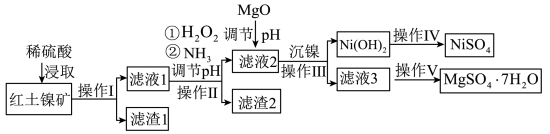
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入H2O2的作用是___________ (用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________ 。
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________ mol/L。
(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为___________ 。
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为___________ ;
②样品中镍元素的质量分数为___________ %(保留3位有效数字);
③以下操作,会使测定结果偏低的有___________ 。
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全(c<10-5mol/L)时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入H2O2的作用是
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为
②样品中镍元素的质量分数为
③以下操作,会使测定结果偏低的有
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
您最近一年使用:0次
名校
解题方法
8 .  是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
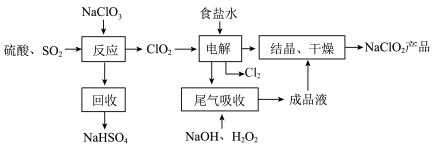
回答下列问题:
(1) 中
中 的化合价为
的化合价为___________ 。
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式___________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 ,要加入的试剂为
,要加入的试剂为___________ ,“电解”中还原产物是___________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 。此吸收反应中氧化剂与还原剂的物质的量之比为
。此吸收反应中氧化剂与还原剂的物质的量之比为___________ 。
 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 ,要加入的试剂为
,要加入的试剂为(4)“尾气吸收”是吸收“电解”过程排出的少量
 。此吸收反应中氧化剂与还原剂的物质的量之比为
。此吸收反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 某小组在探究 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。
资料:i.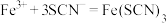 (红色),
(红色),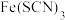 中
中 元素的化合价为
元素的化合价为 价
价
ii. 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了 的
的___________ 性,补全 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:___________ 。

(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是___________ 。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
分析上述三个实验,下列叙述不正确的是___________(填字母)。
(4)验证 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:___________ 。
 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。| 实验Ⅰ | 现象 |
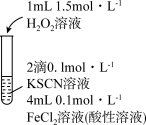 | 溶液变红,片刻红色褪去,有气体生成(经检验为 )。 )。 |
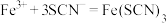 (红色),
(红色),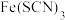 中
中 元素的化合价为
元素的化合价为 价
价ii.
 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀(1)实验Ⅰ体现了
 的
的 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
| 实验Ⅲ | 现象 |
 | 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和 溶液 溶液 | 无白色沉淀产生。 |
A.实验Ⅲ中发生了氧化还原反应: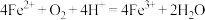 |
B.通过实验Ⅲ推出实验Ⅰ中氧化 的只有 的只有 |
C. 在该实验条件下不能使红色溶液褪色 在该实验条件下不能使红色溶液褪色 |
D.实验Ⅰ中红色褪去与 的氧化性有关 的氧化性有关 |
(4)验证
 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:
您最近一年使用:0次
2024·广东·模拟预测
名校
解题方法
10 . 含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和“药剂还原沉淀法”进行处理。
I. “Pb2+沉淀法”工艺流程如图。 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。
(1)铬元素的价电子排布式:_______ 。已知金属铬为体心立方晶体,密度为7.2g/cm3,求两个Cr原子的最小核间距_______ nm。(只写表达式,不计算)
(2)“氧化”过程中Cr(OH)3转化为 的离子方程式为
的离子方程式为_______ 。
(3)“沉降”过程中应调节pH范围是_______ ~10.5。
(4)已知25℃是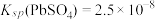 ;
;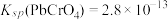 ;
; 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
II. “药剂还原沉淀法”工艺流程如图。 被Cr(VI)氧化为
被Cr(VI)氧化为_______ 。
(6)“沉淀”过程中,当溶液pH为8.6时,
_______  。
。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量mg/L | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
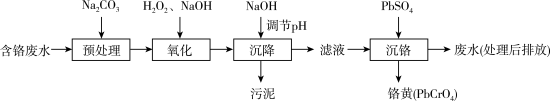
 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | — | 13.5 | 14.0 | 10.5 | 12.0 | |
(2)“氧化”过程中Cr(OH)3转化为
 的离子方程式为
的离子方程式为(3)“沉降”过程中应调节pH范围是
(4)已知25℃是
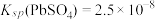 ;
;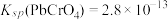 ;
; 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
II. “药剂还原沉淀法”工艺流程如图。
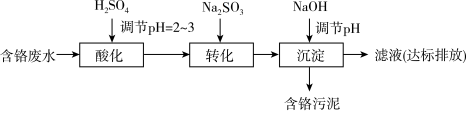
 被Cr(VI)氧化为
被Cr(VI)氧化为(6)“沉淀”过程中,当溶液pH为8.6时,

 。
。
您最近一年使用:0次



