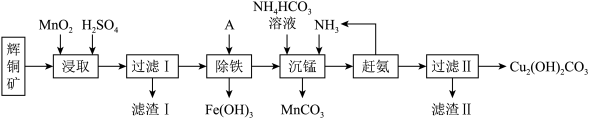
1 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量 Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
②Ksp[Fe(OH)3]=4.0×10−38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______ (任写一种)。
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:_________ 。
(3)常温下“除铁”时加入的试剂A可用____ ,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为_____ mol•L-1。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是_______ (写化学式)。
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是_______ 。

已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10−38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣I中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:
(3)常温下“除铁”时加入的试剂A可用
(4)滤液Ⅱ经蒸发结晶得到的盐主要是
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近半年使用:0次
2 . 北宋沈括《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述不正确的是
| A.胆矾能溶于水 | B.胆矾受热不分解 |
| C.“熬之则成胆矾”包含蒸发浓缩、结晶 | D.胆矾溶液能与铁发生置换反应 |
您最近半年使用:0次
2020-11-25更新
|
122次组卷
|
2卷引用:江苏扬州市2021届高三上学期期中调研化学试题
3 . 硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如图:
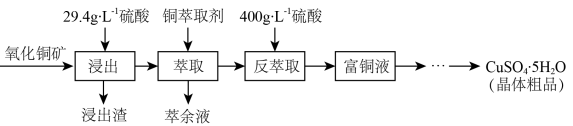
(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是________ 。
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时,“相比”(O/A)对铜萃取率的影响如图所示。在实际操作中“相比”应选择________ 。(填序号)
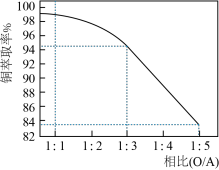
A.1:1 B.1:3 C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O)⇌CuR2(O)+2H+,反萃取加入400g·L-1硫酸的理由是________ 。
(4)从富铜液中获得较多晶体粗品的实验操作依次是______ 、_____ 、(填操作名称)过滤、干燥。
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的________ 性质。

(1)浸出时所用硫酸的质量浓度(单位体积的溶液所含溶质的质量)为29.4g·L-1,其物质的量浓度是
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃取硫酸浸出液中的铜离子,测得当萃取时间为120s时,“相比”(O/A)对铜萃取率的影响如图所示。在实际操作中“相比”应选择

A.1:1 B.1:3 C.1:5
(3)已知铜萃取剂可用HR(O)表示,萃取过程可表示为:Cu2++2HR(O)⇌CuR2(O)+2H+,反萃取加入400g·L-1硫酸的理由是
(4)从富铜液中获得较多晶体粗品的实验操作依次是
(5)游泳场馆常用硫酸铜作杀菌剂,这是利用了CuSO4的
您最近半年使用:0次
名校
解题方法
4 . 为除去下列待提纯物质中的杂质(括号内为杂质),选用的试剂及操作方法均正确的是
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | 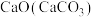 | 水 | 溶解、过滤、结晶 |
B |  | 氧气 | 点燃 |
C |  | 氢氧化钠溶液 | 过滤 |
D | 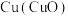 | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2020-11-24更新
|
187次组卷
|
9卷引用:福建省厦门双十中学2018-2019学年高一上学期入学考试化学试题
福建省厦门双十中学2018-2019学年高一上学期入学考试化学试题安徽省舒城中学2020-2021学年高一上学期开学考试化学试题云南省弥勒市第一中学2020-2021学年高一上学期第一次月考化学试题宁夏银川一中2020-2021学年高一上学期期中考试化学试题陕西省黄陵县中学2020-2021学年高一上学期期中考试化学试题(高新部)四川师范大学万达中学2020-2021学年高一9月月考化学试题河南省商丘市第一高级中学2020-2021学年高一上学期期中考试化学试题四川省广元市川师大万达中学2020-2021学年高一上学期期中考试化学试题广东省惠州市惠州中学2020-2021学年高一上学期期中测试化学试题
5 . 下列有关实验现象、原理、方法和结论不正确的是( )
| A.用红外光谱仪来测定分子的立体构型 |
| B.向硫酸铜溶液中加入NaOH溶液,形成蓝色沉淀后再加入NaOH溶液,沉淀溶解,得到深蓝色溶液 |
| C.用X-射线衍射实验来区分晶体和非晶体 |
D.向I2的CCl4溶液中加入浓KI水溶液,振荡试管,溶液紫色变浅,是由于在水溶液中发生反应:I2+I-=I |
您最近半年使用:0次
解题方法
6 . 氯化亚铜(CuCl)是有机合成中应用广泛的催化剂。它微溶于水,不溶于乙醇,露置于潮湿的空气中易被氧化,但在干燥的空气中稳定,见光会分解。)废紫铜制备氯化亚铜的工艺流程如图:

请回答下列问题:
(1)为加快反应Ⅰ的速率,可以采取的措施有______ 、_____ 。(填两点)
(2)有大量Cl-存在时,Na2SO3可将CuCl2还原成[CuCl2]-,反应Ⅱ中Na2SO3要缓慢加到溶液中,原因是___ 。
(3)先酸洗再醇洗的目的是______ 。
(4)上述亚硫酸钠纯度要求高,实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如图所示:
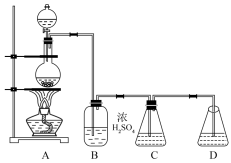
将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
①装置B中浓H2SO4的作用:_____ ;
②Na2CO3溶液要分装在两个锥形瓶中的理由是____ ;写出C中发生反应的离子方程式_____ ;
③通SO2结束后,加Na2CO3的目的是_______ 。

请回答下列问题:
(1)为加快反应Ⅰ的速率,可以采取的措施有
(2)有大量Cl-存在时,Na2SO3可将CuCl2还原成[CuCl2]-,反应Ⅱ中Na2SO3要缓慢加到溶液中,原因是
(3)先酸洗再醇洗的目的是
(4)上述亚硫酸钠纯度要求高,实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如图所示:

将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
①装置B中浓H2SO4的作用:
②Na2CO3溶液要分装在两个锥形瓶中的理由是
③通SO2结束后,加Na2CO3的目的是
您最近半年使用:0次
名校
解题方法
7 . 氧化亚铜(Cu2O)是一种附加值较高的铜类物质,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
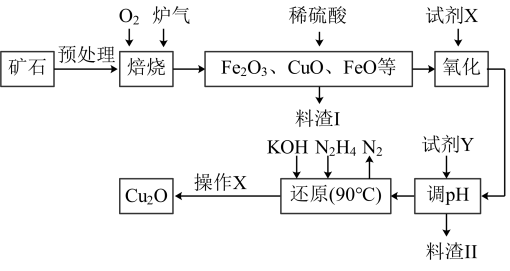
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是_______ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为_______ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:_______ 。
(3)加入试剂Y调pH时,pH的调控范围是_______ 。
(4)写出用N2H4制备Cu2O的化学方程式:______ ,操作X包括过滤、洗涤、烘干,其中过滤后,可以通过______ 的方法检验固体物质是否已被洗涤干净。
(5)Cu2O也常用电解法制备,流程如下:
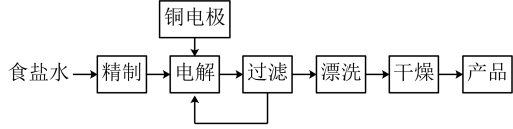
已知:①Cu2O为暗红色的固体,有毒 ②部分难溶物的颜色和常温下的Ksp如下表所示:
实验室模拟电解装置如图所示,观察到的现象如下:

①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。则:
①电解池的阳极反应式为_____ 。
②b极附近的白色沉淀开始变成黄色,此时溶液中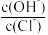 =
=_____ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)Cu2O也常用电解法制备,流程如下:

已知:①Cu2O为暗红色的固体,有毒 ②部分难溶物的颜色和常温下的Ksp如下表所示:
| 难溶物 | Cu(OH)2 | CuOH | CuCl | Cu2O |
| 颜色 | 蓝色 | 黄色 | 白色 | 红色 |
| Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |

①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。则:
①电解池的阳极反应式为
②b极附近的白色沉淀开始变成黄色,此时溶液中
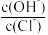 =
=
您最近半年使用:0次
8 . 下列说法正确的是( )
| A.加热胆矾晶体失去结晶水,得到白色的无水硫酸铜,这一过程叫风化 |
| B.家用石碱久置后,由块状变成粉末状,这一变化是风化的结果 |
| C.水蒸气通过固体氢氧化钠时,固体表面出现水珠,这是固体氢氧化钠潮解的缘故 |
| D.从冰箱中取出物体,表面很快出现水珠,这种现象叫潮解 |
您最近半年使用:0次
名校
解题方法
9 . A、B、C、D 四种可溶性盐,其阳离子分别是 Na+、Ba2+、Cu2+、Ag+中的某一种, 阴离子分别是 Cl-、 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:
①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A_____ 、B_____ 、C_____ 、D_____ 。
(2)写出下列反应的离子方程式:
①C+D_____ ;
②B+D_____ ;
③C+HCl→气体_____ 。
 、
、 、
、 中的某一种。现做以下实验:
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有 5mL 蒸馏水的四支试管中,只有 B 盐溶液呈蓝色。
②分别向 4 支试管中加入 2mL 稀盐酸,发现 A 盐溶液中产生白色沉淀,C 盐溶液中有较多气泡产生,而 D 盐溶液无明显现象。
(1)根据上述事实,推断这四种盐的化学式分别为:A
(2)写出下列反应的离子方程式:
①C+D
②B+D
③C+HCl→气体
您最近半年使用:0次
2020-11-22更新
|
197次组卷
|
7卷引用:成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题
2020·浙江·模拟预测
解题方法
10 . Ⅰ.磁性材料A由两种元素组成,为探究其组成和性质,设计并完成如下实验:

(1)A的化学式为________________ 。
(2)用化学方程式表示气体C与氯水反应生成D的过程:_________ 。
(3)B溶于盐酸后生成的物质F可用于净水,结合离子方程式说明其原因:_____________ 。
Ⅱ.某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:
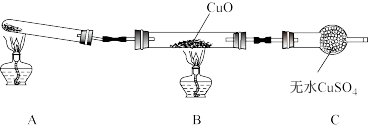
(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是:________ 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。NH3与CuO反应生成的红色物质中可能含有Cu2O,写出氨气与CuO反应生成Cu2O的化学方程式__________ 。
(3)已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性差(Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:_______ 。

(1)A的化学式为
(2)用化学方程式表示气体C与氯水反应生成D的过程:
(3)B溶于盐酸后生成的物质F可用于净水,结合离子方程式说明其原因:
Ⅱ.某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

(1)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是:
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。NH3与CuO反应生成的红色物质中可能含有Cu2O,写出氨气与CuO反应生成Cu2O的化学方程式
(3)已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性差(Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
您最近半年使用:0次



