1 .  在超高压下转化为平行六面体的
在超高压下转化为平行六面体的 分子(如图)。下列说法错误的是
分子(如图)。下列说法错误的是
 在超高压下转化为平行六面体的
在超高压下转化为平行六面体的 分子(如图)。下列说法错误的是
分子(如图)。下列说法错误的是
A. 和 和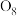 互为同素异形体 互为同素异形体 | B. 中存在不同的氧氧键 中存在不同的氧氧键 |
C. 转化为 转化为 是熵减反应 是熵减反应 | D.常压低温下 能稳定存在 能稳定存在 |
您最近一年使用:0次
名校
2 . 环己烯(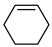 )是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。
)是一种重要的化学试剂,主要用于有机合成和油类萃取。利用环己烷脱氢制备环己烯的反应原理如下。


氧化脱氢:
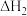
回答下列问题:
(1)已知几种化学键的键能数据如下表所示。
| 化学键 | H-H | C-H | C-C | C=C |
| 键能/(kJ·mol–1) | 436 | 413 | 348 | 615 |
(2)科技工作者结合实验与计算机模拟结果,研究环己烷直接脱氢制环己烯的反应历程(如图所示),其中吸附在催化剂表面的物种用*表示。
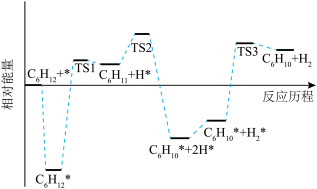
 的焓变小于零的原因是
的焓变小于零的原因是②
 脱氢的速率
脱氢的速率 *脱氢的速率。
*脱氢的速率。③在恒容密闭容器中充入一定量的环己烷,其初始压强为p kPa,发生直接脱氢反应达到平衡时,环己烷的转化率为x,则反应I的标准平衡常数Kθ=
 gG(g)+hH(g),Kθ=
gG(g)+hH(g),Kθ= ,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压]。
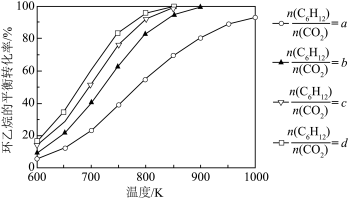
,其中pθ=100 kPa,pG、pH、pD、pE为各组分的平衡分压]。(3)在压强恒为p kPa的密闭容器中充入不同投料比的环己烷和CO2,在不同温度下达到平衡时,环己烷的转化率如下图所示,则a、b、c的大小关系为
您最近一年使用:0次
3 . 正丁烷催化裂解为化工行业提供了丰富的原料,相关反应如下:
反应Ⅰ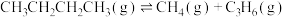
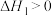
反应Ⅱ

回答下列问题:
(1)已知 ,
,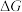 随着温度变化的三种趋势如图1中曲线所示。能用来表示反应Ⅱ的曲线是
随着温度变化的三种趋势如图1中曲线所示。能用来表示反应Ⅱ的曲线是___________ (填“x”、“y”或“z”)。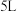 密闭的刚性容器中通入
密闭的刚性容器中通入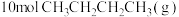 发生反应Ⅰ、反应Ⅱ,保持温度不变,正丁烷、丙烯的浓度随时间的变化关系如图2所示。
发生反应Ⅰ、反应Ⅱ,保持温度不变,正丁烷、丙烯的浓度随时间的变化关系如图2所示。
① 内
内
___________  。
。
②反应达到平衡后的压强是反应前的___________ 倍。
③反应Ⅱ的平衡常数
___________ 。
④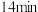 时,降低温度,丙烯的浓度随时间的变化对应图2中的曲线
时,降低温度,丙烯的浓度随时间的变化对应图2中的曲线___________ (填标号)。
(3)采用选择性膜技术(可选择性地让某气体通过而脱离体系)可提高 的选择性,其原因是
的选择性,其原因是___________ 。
(4)工业生产时向正丁烷中混入一定量的水蒸气以减少积碳对催化剂活性的影响,结合化学方程式说明这样操作的原因___________ 。
反应Ⅰ
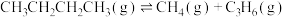
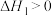
反应Ⅱ


回答下列问题:
(1)已知
 ,
,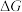 随着温度变化的三种趋势如图1中曲线所示。能用来表示反应Ⅱ的曲线是
随着温度变化的三种趋势如图1中曲线所示。能用来表示反应Ⅱ的曲线是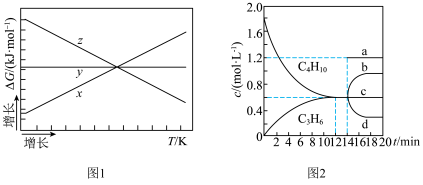
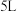 密闭的刚性容器中通入
密闭的刚性容器中通入 发生反应Ⅰ、反应Ⅱ,保持温度不变,正丁烷、丙烯的浓度随时间的变化关系如图2所示。
发生反应Ⅰ、反应Ⅱ,保持温度不变,正丁烷、丙烯的浓度随时间的变化关系如图2所示。①
 内
内
 。
。②反应达到平衡后的压强是反应前的
③反应Ⅱ的平衡常数

④
 时,降低温度,丙烯的浓度随时间的变化对应图2中的曲线
时,降低温度,丙烯的浓度随时间的变化对应图2中的曲线(3)采用选择性膜技术(可选择性地让某气体通过而脱离体系)可提高
 的选择性,其原因是
的选择性,其原因是(4)工业生产时向正丁烷中混入一定量的水蒸气以减少积碳对催化剂活性的影响,结合化学方程式说明这样操作的原因
您最近一年使用:0次
名校
4 . 环境保护与绿色发展是新时代人们关心的共同话题。NO是大气主要污染物,因此对工业烟气脱硝是工业生产中的重要一环。煤燃烧排放的烟气含有NO,脱除的方法有多种。
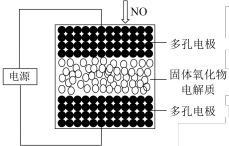
(1)利用固体氧化物电解池可将NO直接转化为N2,纽扣式电化学还原器结构单元如图所示,电解时,阴极发生的电极反应式为___________ 。
I.NO(aq)+HClO(aq)⇌NO2(aq)+HCl(aq) ΔH=akJ·mol−1
Ⅱ.3NO2(aq)+H2O(l)⇌2HNO3(aq)+NO(aq) ΔH=bkJ·mol−1
①NO(aq)转化为HNO3(aq)的热化学方程式___________ 。
②为提高NO脱除率,工业上常向NaClO溶液中加入稀硫酸调节 ,溶液初始pH与NO的脱除率如下表所示。
,溶液初始pH与NO的脱除率如下表所示。
pH影响NO脱除率的原因是___________ 。
(3)理论上可采用加热使NO分解的方法处理:2NO(g)⇌N2(g)+O2(g)。已知该反应的正反应活化能为728kJ·mol−1,逆反应的活化能为910kJ·mol−1;正反应熵变为-24.8J·K-1·mol−1.实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因________ 。
(4)近期科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C-OH,其电离平衡可表示为C-OH⇌C-O-+H+),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化:HNO3+C→C-OH+NO2↑+H2O
预氧化:KMnO4+C→C-OH+MnO2+K2MnO4
预氧化:H2O2+C→C-OH+H2O
吸附:C-OH(s)+NO(g)⇌C-OH…NO(s)ΔH<0
NO吸附实验在25℃下进行,将一定比例的N2与NO混合气体在 恒压下,以相同速率
恒压下,以相同速率持续 通入到等量的、不同预氧化试剂处理的活性炭中(图像中“原始-C”表示未经处理的活性炭),获得“NO捕获率-通气时间”的变化图:
①下列描述正确的是___________ 。
A.25℃下原始-C在通气约175分钟后吸附效果超过了H2O2-C
B.若其他条件不变,增大混合气体中N2物质的量分数,吸附平衡会正向移动
C.KMnO4-C在实验中吸附效果不佳,可能是活性炭表面孔隙被MnO2、K2MnO4堵塞
D.升高温度,等量活性炭催化剂吸附的NO分子总数会减少
②相比其他预氧化试剂处理的活性炭,HNO3-C吸附效果更佳,有研究者认为可能是HNO3引入了H+,增强了活性炭的表面活性。试利用勒夏特列原理予以解释___________ 。
(1)利用固体氧化物电解池可将NO直接转化为N2,纽扣式电化学还原器结构单元如图所示,电解时,阴极发生的电极反应式为
I.NO(aq)+HClO(aq)⇌NO2(aq)+HCl(aq) ΔH=akJ·mol−1
Ⅱ.3NO2(aq)+H2O(l)⇌2HNO3(aq)+NO(aq) ΔH=bkJ·mol−1
①NO(aq)转化为HNO3(aq)的热化学方程式
②为提高NO脱除率,工业上常向NaClO溶液中加入稀硫酸调节
 ,溶液初始pH与NO的脱除率如下表所示。
,溶液初始pH与NO的脱除率如下表所示。初始 | 3.5 | 4.5 | 5.5 | 6.5 | 7.5 |
| NO脱除率 | 91% | 88% | 83% | 65% | 51% |
(3)理论上可采用加热使NO分解的方法处理:2NO(g)⇌N2(g)+O2(g)。已知该反应的正反应活化能为728kJ·mol−1,逆反应的活化能为910kJ·mol−1;正反应熵变为-24.8J·K-1·mol−1.实际反应时发现加热至600℃时NO仍没有明显分解,请结合上述数据解释原因
(4)近期科学家发现活性炭表面的有机结构可以被强氧化剂氧化成酚羟基、羧基(均可表示为C-OH,其电离平衡可表示为C-OH⇌C-O-+H+),这些官能团可以使活性炭表面活性化,有利于NO的吸附。不同氧化剂的预氧化与吸附原理可表示为(未配平):
预氧化:HNO3+C→C-OH+NO2↑+H2O
预氧化:KMnO4+C→C-OH+MnO2+K2MnO4
预氧化:H2O2+C→C-OH+H2O
吸附:C-OH(s)+NO(g)⇌C-OH…NO(s)ΔH<0
NO吸附实验在25℃下进行,将一定比例的N2与NO混合气体在
 恒压下,以相同速率
恒压下,以相同速率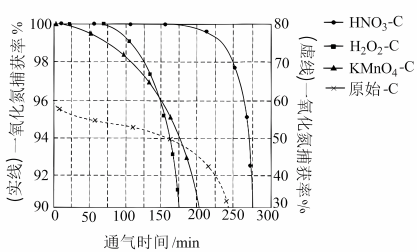
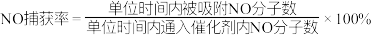
①下列描述正确的是
A.25℃下原始-C在通气约175分钟后吸附效果超过了H2O2-C
B.若其他条件不变,增大混合气体中N2物质的量分数,吸附平衡会正向移动
C.KMnO4-C在实验中吸附效果不佳,可能是活性炭表面孔隙被MnO2、K2MnO4堵塞
D.升高温度,等量活性炭催化剂吸附的NO分子总数会减少
②相比其他预氧化试剂处理的活性炭,HNO3-C吸附效果更佳,有研究者认为可能是HNO3引入了H+,增强了活性炭的表面活性。试利用勒夏特列原理予以解释
您最近一年使用:0次
5 . 环氧乙烷(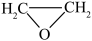 )常温下易燃易爆,其爆炸极限为5%~100%,常用于医学消毒,工业上使用特定的催化剂催化乙烯氧化法制备环氧乙烷,主要涉及反应:
)常温下易燃易爆,其爆炸极限为5%~100%,常用于医学消毒,工业上使用特定的催化剂催化乙烯氧化法制备环氧乙烷,主要涉及反应:
ⅰ.2C2H4(g)+O2(g) 2
2 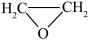 (g)
(g)
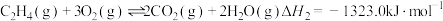
回答下列问题:
(1)已知
 ,键能
,键能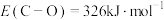 ,
,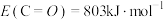 ,则
,则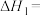
(2)环氧乙烷的合成采用的主催化剂都是银单质。将乙烯、氧气、氮气按体积比为2∶1∶7充入反应容器中,只发生反应ⅰ和ⅱ,压强恒定为pMPa,使用不同的助催化剂反应一定时间,乙烯的转化率与环氧乙烷的选择性随温度的变化如图所示(已知m处于平衡状态):
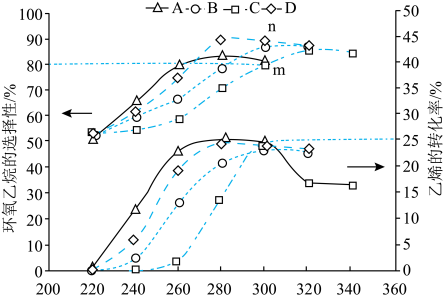
②应选择的适宜的条件是
③m点对应的反应ⅰ的平衡常数

 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。(3)我国科研工作者提出通过阴离子交换膜及合适的催化剂,先使CO2电催化转化为乙烯,乙烯再与另一电化学体系结合制备高附加值的环氧乙烷的工作原理如图所示:
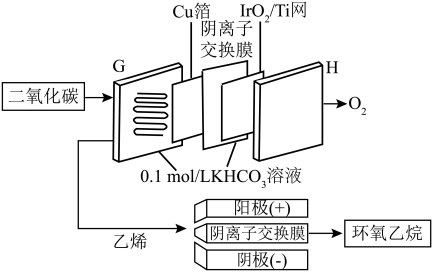
②电极H上生成10.08L(标准状况)O2时,理论上可得到环氧乙烷的质量为
您最近一年使用:0次
解题方法
6 . 利用 干重整反应:
干重整反应: ,不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。
,不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。 为吸附活性炭,该反应一般认为通过如图步骤来实现:
为吸附活性炭,该反应一般认为通过如图步骤来实现:
 干重整反应:
干重整反应: ,不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。
,不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。 为吸附活性炭,该反应一般认为通过如图步骤来实现:
为吸附活性炭,该反应一般认为通过如图步骤来实现: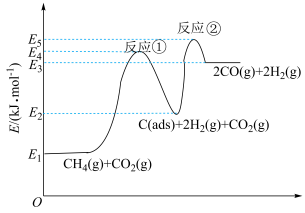
| A.反应①、②在高温条件下均能自发进行 |
| B.该反应速率主要由反应①决定 |
C.该反应的平衡常数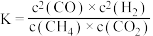 |
D.该反应中每产生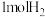 ,转移电子的数目约为 ,转移电子的数目约为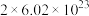 |
您最近一年使用:0次
7 . 气态 的一种工业制法流程如图:
的一种工业制法流程如图: 为阿伏加德罗常数的值②
为阿伏加德罗常数的值② 时,次磷酸(
时,次磷酸(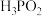 )的电离常数
)的电离常数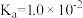 ,下列说法错误的是
,下列说法错误的是
 的一种工业制法流程如图:
的一种工业制法流程如图: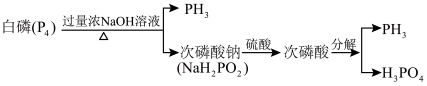
 为阿伏加德罗常数的值②
为阿伏加德罗常数的值② 时,次磷酸(
时,次磷酸(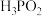 )的电离常数
)的电离常数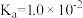 ,下列说法错误的是
,下列说法错误的是| A.液态次磷酸分解反应为熵增过程 |
B. 是非极性分子, 是非极性分子, 所含价层电子对数为 所含价层电子对数为 |
C.白磷与浓 溶液反应生成 溶液反应生成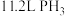 (标准状况下)时,转移电子的数目为 (标准状况下)时,转移电子的数目为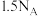 |
D.常温下,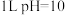 的 的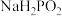 溶液中由水电离出的 溶液中由水电离出的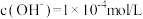 |
您最近一年使用:0次
2024-04-29更新
|
35次组卷
|
2卷引用:湖北省黄冈市2023-2024学年高二上学期期末调研考试化学试题
8 . 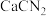 可以作为固态氮肥,并改善土壤酸性,通过
可以作为固态氮肥,并改善土壤酸性,通过 反应制备,下列说法错误的是
反应制备,下列说法错误的是
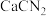 可以作为固态氮肥,并改善土壤酸性,通过
可以作为固态氮肥,并改善土壤酸性,通过 反应制备,下列说法错误的是
反应制备,下列说法错误的是| A.该反应为熵增过程 | B.该反应实现了氮的固定 |
| C.该反应需在无水条件下进行 | D. 的电子式为 的电子式为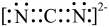 |
您最近一年使用:0次
名校
解题方法
9 . CaCN2可以作为固态氮肥,并改善土壤酸性,通过 反应制备。下列说法错误的是
反应制备。下列说法错误的是
 反应制备。下列说法错误的是
反应制备。下列说法错误的是| A.该反应为熵增过程 |
| B.该反应实现了氮的固定 |
| C.该反应需在无水条件下进行 |
D. 的电子式为 的电子式为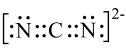 |
您最近一年使用:0次
2024-04-07更新
|
288次组卷
|
3卷引用:湖北省圆创联盟2024届高三三月联合测评(一模)化学试卷
名校
解题方法
10 . 下列化学理论、化工生产或实验事实引出的结论不正确的是
| 选项 | 事实 | 结论 |
| A | 化学反应的历程一般为:普通反应物分子 活化分子 活化分子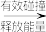 产物分子 产物分子 | 普通分子吸收能量转化为活化分子,活化分子间有适当的取向时,才能发生有效碰撞,生成产物分子 |
| B | 把Ba(OH)2•8H2O晶体与氯化铵晶体放入烧杯,用玻璃棒快速搅拌,烧杯变凉 | 反应物的总能量低于生成物的总能量 |
| C | 2NO(g)+2CO(g)=N2(g)+2CO2(g)反应△S<0,但是此反应可以自发进行 | 要判断反应自发进行的方向,必须综合考虑反应体系的焓变和熵变 |
| D | 在2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),把密闭容器的容积改为1L,重新发生该反应 2NH3(g),把密闭容器的容积改为1L,重新发生该反应 | 化学反应速率减慢 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-29更新
|
62次组卷
|
2卷引用:湖北省武汉市新洲区第一中学2024届高二上学期期末联考化学试题



