名校
1 . 合成氨是工业上的重要反应:N2(g)+3H2(g) 2NH3(g),下列说法
2NH3(g),下列说法不正确 的是
 2NH3(g),下列说法
2NH3(g),下列说法| A.增大压强既加快反应速率,又有利于平衡向合成氨方向移动 |
| B.反应达平衡状态后,单位时间内生成1molN2的同时消耗3molH2 |
| C.将氨分离出来,有利于平衡向合成氨方向移动 |
| D.铁作催化剂既加快反应速率,又有利于平衡向合成氨方向移动 |
您最近一年使用:0次
名校
解题方法
2 . 下列有关速率与平衡的说法正确的是
| A.化学反应速率改变,平衡一定移动 | B.平衡发生移动,平衡常数一定变化 |
| C.增加某种反应物的量,平衡一定正向移动 | D.平衡正向移动,反应物的转化率不一定增大 |
您最近一年使用:0次
2023-05-16更新
|
467次组卷
|
3卷引用:浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(选考班)试题
名校
解题方法
3 . 一定温度下,在恒容密闭容器中发生反应: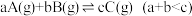 ,达平衡后将体积缩小为原来的一半,则C的体积分数
,达平衡后将体积缩小为原来的一半,则C的体积分数
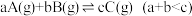 ,达平衡后将体积缩小为原来的一半,则C的体积分数
,达平衡后将体积缩小为原来的一半,则C的体积分数| A.变大 | B.变小 | C.不变 | D.无法判断 |
您最近一年使用:0次
2023-05-15更新
|
399次组卷
|
3卷引用: 重庆市第一中学校2022-2023学年高一下学期期中考试化学试题
解题方法
4 . 二氧化碳催化加氢合成乙烯是综合利用 的热点研究领域。相关的主要化学反应有:
的热点研究领域。相关的主要化学反应有:
Ⅰ.

Ⅱ.

Ⅲ.

(1)将 和
和 按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)
按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)
①当通入的气体总物质的量一定时,在固定体积、不同温度下,产物乙烯的体积分数随时间的变化如图1所示。试结合图1判断该反应自发进行的条件并说明理由___________ 。

②下列描述正确的是___________ 。
A.升高温度使反应的平衡常数增大
B.加压有助于反应的平衡正向移动
C.恒压时, 可以说明反应达到平衡
可以说明反应达到平衡
D.恒容时,再充入一定量 ,反应平衡体系中
,反应平衡体系中 增大
增大
(2)现将一定量的 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
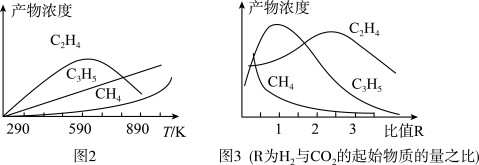
①结合图2和图3,该模拟工业生产制备乙烯的适宜条件为___________ 。
②725K时,将 和
和 的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中
的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中 和
和 的物质的量均为
的物质的量均为 mol,则在该温度下反应Ⅲ的平衡常数K为
mol,则在该温度下反应Ⅲ的平衡常数K为___________ 。
③在一定温度和压强条件下,为了提高反应物气体的转化率,采用了选择性膜技术,可选择性地让某气体通过而离开体系)。当选择性膜吸附乙烯气体时,可以降低副产物 的选择性(
的选择性( 选择性:生成
选择性:生成 消耗的
消耗的 的物质的量与总共转化了的
的物质的量与总共转化了的 的物质的量之比),请结合具体反应说明原因
的物质的量之比),请结合具体反应说明原因___________ 。
 的热点研究领域。相关的主要化学反应有:
的热点研究领域。相关的主要化学反应有:Ⅰ.


Ⅱ.


Ⅲ.


(1)将
 和
和 按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)
按物质的量之比为1:3投入一密闭容器中反应。(只考虑反应Ⅰ)①当通入的气体总物质的量一定时,在固定体积、不同温度下,产物乙烯的体积分数随时间的变化如图1所示。试结合图1判断该反应自发进行的条件并说明理由

②下列描述正确的是
A.升高温度使反应的平衡常数增大
B.加压有助于反应的平衡正向移动
C.恒压时,
 可以说明反应达到平衡
可以说明反应达到平衡D.恒容时,再充入一定量
 ,反应平衡体系中
,反应平衡体系中 增大
增大(2)现将一定量的
 和
和 置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应一段时间后测定生成物的浓度,得到图2和图3。
①结合图2和图3,该模拟工业生产制备乙烯的适宜条件为
②725K时,将
 和
和 的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中
的混合气体(体积比为1:3,总物质的量为4mol)在VL的固定容积容器中反应,并在一定催化剂下只进行反应Ⅰ和Ⅲ.达到平衡时,测得容器中 和
和 的物质的量均为
的物质的量均为 mol,则在该温度下反应Ⅲ的平衡常数K为
mol,则在该温度下反应Ⅲ的平衡常数K为③在一定温度和压强条件下,为了提高反应物气体的转化率,采用了选择性膜技术,可选择性地让某气体通过而离开体系)。当选择性膜吸附乙烯气体时,可以降低副产物
 的选择性(
的选择性( 选择性:生成
选择性:生成 消耗的
消耗的 的物质的量与总共转化了的
的物质的量与总共转化了的 的物质的量之比),请结合具体反应说明原因
的物质的量之比),请结合具体反应说明原因
您最近一年使用:0次
名校
5 . 甲烷是一种温室气体,将它转化为高附加值产品甲醇具有重要意义。目前工业上的甲烷转化大多需要先通过重整生成合成气(CO、 )再转化为甲醇,涉及的反应如下:
)再转化为甲醇,涉及的反应如下:
反应Ⅰ: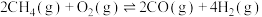

反应Ⅱ:
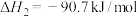
在密闭容器中通入3mol 和2mol
和2mol  ,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中
,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中 和
和 的平衡体积分数随温度变化如图所示。
的平衡体积分数随温度变化如图所示。

已知:对于反应Ⅱ, ,
, ,
, 、
、 为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是
为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是
 )再转化为甲醇,涉及的反应如下:
)再转化为甲醇,涉及的反应如下:反应Ⅰ:
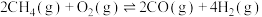

反应Ⅱ:

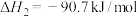
在密闭容器中通入3mol
 和2mol
和2mol  ,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中
,假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中 和
和 的平衡体积分数随温度变化如图所示。
的平衡体积分数随温度变化如图所示。
已知:对于反应Ⅱ,
 ,
, ,
, 、
、 为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是
为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是A.压强为0.2MPa时,表示 和 和 的曲线分别是b、d 的曲线分别是b、d |
| B.混合气体的平均相对分子质量保持不变时,说明反应体系已达到平衡 |
C.在升温的过程中,反应Ⅱ速率常数增大的倍数; > > |
D.500K,2MPa条件下,若平衡时CO的物质的量为1mol,则 的转化率约为66.7% 的转化率约为66.7% |
您最近一年使用:0次
2023-05-13更新
|
540次组卷
|
4卷引用:辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题
辽宁省沈阳市五校协作体2023-2024学年高三上学期期中考试化学试题 重庆市2023届高三下学期5月“三诊”化学试题(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)选择题11-14
6 . 著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面所作出的贡献。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图(铈常见的化合价为+3和+4):
的一种工艺流程如图(铈常见的化合价为+3和+4):
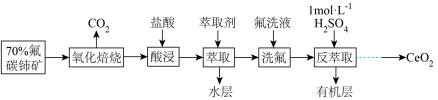
(1)氟碳铈矿“氧化焙烧”生成 ,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是
,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是___________ 。
(2)“酸浸”过程中产生大量黄绿色气体,写出 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:___________ 。
(3)有机物HT能将 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 (水层)+3HT(有机层)
(水层)+3HT(有机层)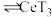 (有机层)
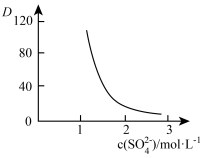
(有机层)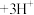 (水层)。保持其它条件不变时,分配比D(D表示
(水层)。保持其它条件不变时,分配比D(D表示 分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中
分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中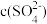 变化如图所示。“反萃取”时,工业上常选用
变化如图所示。“反萃取”时,工业上常选用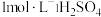 ,其作用为:
,其作用为:___________ ;同时还加入一定量的 的原因:
的原因:___________ 。
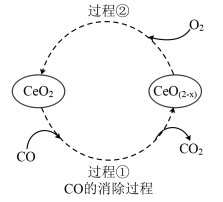
(4) 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式___________ 。尾气消除过程中
___________
 )为原料制备
)为原料制备 的一种工艺流程如图(铈常见的化合价为+3和+4):
的一种工艺流程如图(铈常见的化合价为+3和+4):
(1)氟碳铈矿“氧化焙烧”生成
 ,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是
,冷却后,不需要机械加工粉碎成细颗粒,就能与盐酸充分反应,其原因是(2)“酸浸”过程中产生大量黄绿色气体,写出
 与盐酸反应的离子方程式:
与盐酸反应的离子方程式:(3)有机物HT能将
 从水溶液中提取出来,该过程可表示为
从水溶液中提取出来,该过程可表示为 (水层)+3HT(有机层)
(水层)+3HT(有机层)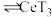 (有机层)
(有机层)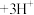 (水层)。保持其它条件不变时,分配比D(D表示
(水层)。保持其它条件不变时,分配比D(D表示 分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中
分别在有机层中与水层中存在形式的物质的量浓度之比)随起始料液中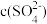 变化如图所示。“反萃取”时,工业上常选用
变化如图所示。“反萃取”时,工业上常选用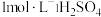 ,其作用为:
,其作用为: 的原因:
的原因:
(4)
 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式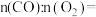

您最近一年使用:0次
7 . 硫、氮是主要的非金属元素,也是人类较早认识的化学元素。硫元素与氮元素也都是生命元素,在自然界中有重要的循环过程。人类对硫、氮元素的利用,其本质就是通过各种化学反应,实现物质之间的转化,如硫酸工业就是人类对硫元素的利用。
(1)生产、生活中,与SO2的大量排放有关的环境问题是_______。(选填编号)
(2)氮循环和硫循环是自然界中两种重要的元素循环过程。请选出下表中关于这两种循环的正确评价_______ 。(选填编号)
任选其中一种错误评价,解释判断理由:_______ 。
硫酸工业生产的核心阶段是转化,转化率越高,则硫的利用率越高,对环境影响也越小。转化阶段发生的反应:2SO2+O2 2SO3(放热反应)
2SO3(放热反应)
(3)上述反应中,反应物的总能量_______ (选填“大于”或“小于”)生成物的总能量。
(4)为合理利用反应中产生的热量,热交换器在硫酸工业中与下列_______设备合为一体。(选填编号)
(5)图中,Y处的气体是_______。(选填编号)
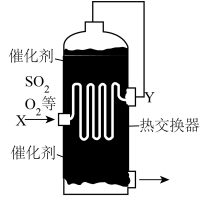
一定温度下,在容积为2L的密闭容器内,通入一定量的SO2和空气,在给定条件下发生反应生成SO3的物质的量浓度变化如下图所示:

(6)不能说明反应已达平衡状态的是_______。(选填编号)
(7)根据图上信息,从反应开始到第一次达到平衡状态时,SO3的平均反应速率为_______ 。
(8)在6min时,可能改变的条件是_______。(选填编号)
(9)对于该反应,能否通过改变条件使SO2完全转化为SO3?_______ (选填“能”或“不能”),原因是_______ 。
(1)生产、生活中,与SO2的大量排放有关的环境问题是_______。(选填编号)
| A.酸雨 | B.PM2.5 | C.温室效应 | D.白色污染 |
| 编号 | 比较 | 氮循环 | 硫循环 |
| ① | 异 | 氮元素会进入大气 | 硫循环不会进入大气 |
| ② | 氮元素可以有机化合物形式参与循环 | 硫元素都以无机化合物形式参与循环 | |
| ③ | 同 | 人类活动对氮循环和硫循环都造成了巨大影响 | |
| ④ | 氮循环和硫循环对环境影响都导致温室效应 | ||
硫酸工业生产的核心阶段是转化,转化率越高,则硫的利用率越高,对环境影响也越小。转化阶段发生的反应:2SO2+O2
 2SO3(放热反应)
2SO3(放热反应)(3)上述反应中,反应物的总能量
(4)为合理利用反应中产生的热量,热交换器在硫酸工业中与下列_______设备合为一体。(选填编号)
| A.沸腾炉 | B.净化器 | C.转化器 | D.吸收塔 |

| A.低温的SO2、O2 | B.低温的SO2、O2和SO3 |
| C.高温的SO2、O2 | D.高温的SO2、O2和SO3 |
一定温度下,在容积为2L的密闭容器内,通入一定量的SO2和空气,在给定条件下发生反应生成SO3的物质的量浓度变化如下图所示:

(6)不能说明反应已达平衡状态的是_______。(选填编号)
| A.v(SO2)正=2v(O2)逆 | B.压强不变 |
| C.SO2浓度不再发生变化 | D.密度不变 |
(8)在6min时,可能改变的条件是_______。(选填编号)
| A.降低温度 | B.增加O2浓度 |
| C.减小压强 | D.增加SO3浓度 |
您最近一年使用:0次
名校
8 . 一定温度下,向2.0L恒容密闭容器中充入4molSO2和2molO2发生反应: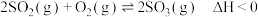 。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
下列说法正确的是
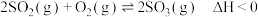 。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:
。经过一段时间后达到平衡,反应过程中测定的部分数据见下表: | 0 | 2 | 4 | 6 | 8 |
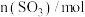 | 0 | 1.6 | 2.8 | 3.6 | 3.6 |
A.4s内反应的平均速率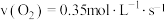 |
B.该反应的平衡常数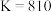 |
C.此温度下,若该容器中有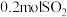 、 、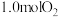 和 和 ,则反应逆向进行 ,则反应逆向进行 |
| D.当容器内密度保持不变时,该反应达到平衡状态 |
您最近一年使用:0次
2023-05-08更新
|
370次组卷
|
3卷引用:浙江省北斗联盟2022-2023学年高二下学期期中联考化学试题
名校
9 . 在密闭容器中,反应
 ,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
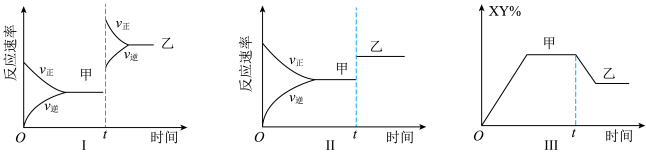

 ,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
,达到如下图甲平衡,在仅改变某一条件后达到乙平衡,对改变的条件下列分析正确的是
| A.图Ⅰ是增大反应物的浓度 |
| B.图Ⅱ一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强 |
| D.图Ⅲ是升高温度 |
您最近一年使用:0次
2023-05-07更新
|
605次组卷
|
3卷引用:广西玉林市博白县中学2022-2023学年高二下学期期中段考化学试题
广西玉林市博白县中学2022-2023学年高二下学期期中段考化学试题广西武鸣高中、北流高中、容县高中、博白县中学、玉林一中、玉林实验中学等八校联考2022-2023学年高二下学期期中测试化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)
名校
10 . 关于反应
 ,下列说法正确的是
,下列说法正确的是

 ,下列说法正确的是
,下列说法正确的是| A.该反应在高温条件下可以自发进行 |
| B.向反应容器中加入催化剂,反应自发进行的临界温度会降低 |
| C.恒容条件下,通入He和Ar组成的混合气体,压强会增大,反应的速率会加快 |
D.恒容条件下,可通入过量的CO2气体来提高 转化率并增大生成物 转化率并增大生成物 的浓度 的浓度 |
您最近一年使用:0次
2023-05-05更新
|
359次组卷
|
7卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高二上学期期中联考化学试题
云南省昆明市云南师范大学附属中学2023-2024学年高二上学期期中联考化学试题陕西省西安市长安区第一中学2022-2023学年高二上学期期末考试(理科)化学试题陕西省西安市长安区第一中学2022-2023学年高一下学期第二次质量检测化学试题新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期末考试化学试题(已下线)专题05 化学反应的方向 化学反应的调控 -【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题湖北省黄冈市黄梅国际育才高级中学2023-2024学年高二上学期12月月考化学试题



