名校
1 . 某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验Ⅰ:将Fe3+转化为Fe2+
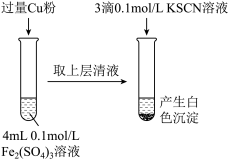
(1)Fe3+与Cu粉发生反应的离子方程式为_________________________________ 。
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③___________________________________ 。
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因___________________________________ 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明_____________________________ 。
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因_____________________________ 。
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为
(2)某学生用对比实验法探究白色沉淀产生的原因,请填写实验万案:
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL① | 产生白色沉淀 | CuSO4溶液与KSCN溶液反应产生了白色沉淀 |
| 步骤2:取4mL② | 无明显现象 |
查阅资料:
已知①SCN-的化学性质与I-相似 ②2Cu2++4I-=2CuI↓+I2
Cu2+与SCN-反应的离子方程式为③
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL0.1mol/LFeSO4溶液中加入 3mL0.5mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO
 Fe(NO)2+(棕色)
Fe(NO)2+(棕色)(3)用离子方程式解释NO产生的原因
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①反应Ⅰ是一个不可逆反应,设计实验方案加以证明
②请用化学平衡移动原理解释溶液由棕色变为黄色的原因
您最近一年使用:0次
2018-04-25更新
|
404次组卷
|
4卷引用:四川省泸州市泸县第五中学2023-2024学年高二上学期12月月考化学试题
2 . 在N2+3H2  2NH3(正反应为放热反应)的反应中,为了提高H2的利用率,可以采取的措施为
2NH3(正反应为放热反应)的反应中,为了提高H2的利用率,可以采取的措施为
 2NH3(正反应为放热反应)的反应中,为了提高H2的利用率,可以采取的措施为
2NH3(正反应为放热反应)的反应中,为了提高H2的利用率,可以采取的措施为| A.升温 | B.增大压强 | C.使用催化剂 | D.增大H2的浓度 |
您最近一年使用:0次
2018-03-26更新
|
1111次组卷
|
2卷引用:【全国百强校】四川省南充市阆中中学2020届高三化学选择题专项训练(30)
名校
3 . 下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g) ⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) ⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定移动
④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
①已达平衡的反应C(s)+H2O(g) ⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) ⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定移动
④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ |
| C.②③④ | D.①②③④ |
您最近一年使用:0次
2018-03-24更新
|
491次组卷
|
6卷引用:四川省阆中中学2017-2018学年高二下学期第一次月考化学试题
名校
解题方法
4 . 金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层) RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为______________________ 。
(2)萃取时应加入适量碱的作用是___________________ 。
(3)步骤④中反应的离子方程式为___________________ 。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____ mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______ 。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________ 。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______ mol/L(萃取的量=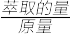 ×100%)
×100%)

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)
 RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)回答下列问题:
(1)步骤酸浸过程中发生氧化还原反应的化学方程式为
(2)萃取时应加入适量碱的作用是
(3)步骤④中反应的离子方程式为
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=
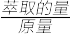 ×100%)
×100%)
您最近一年使用:0次
2018-03-20更新
|
588次组卷
|
4卷引用:四川省泸州市泸县第二中学2020届高三上学期第一次月考理综化学试题
名校
解题方法
5 . 缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq) H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
(1)已知:CO2(g) CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;
CO2(aq)+H2O(l) H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;
HCO (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;
CO2(g)+H2O(l) 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。
则上述电离方程式中ΔH =_____________ (用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为______________ 。(lg2=0.3)若pH升高,则c(H2CO3)/c(HCO )=
)=___________ (填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________ 。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH_______________ (填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
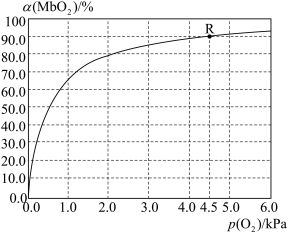
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________ (氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________ 。
Ⅰ.人体血液中存在平衡:H2CO3 (aq)
 H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) ΔH,该平衡可使血液的pH维持在一定范围内。(1)已知:CO2(g)
 CO2(aq) ΔH1=akJ·mol-l;
CO2(aq) ΔH1=akJ·mol-l;CO2(aq)+H2O(l)
 H2CO3 (aq) ΔH2=bkJ·mol-1;
H2CO3 (aq) ΔH2=bkJ·mol-1;HCO
 (aq)
(aq) H+(aq)+CO
H+(aq)+CO (aq) ΔH3=ckJ·mol-1;
(aq) ΔH3=ckJ·mol-1;CO2(g)+H2O(l)
 2H+(aq)+ CO
2H+(aq)+ CO (aq) ΔH4=dkJ·mol-1。
(aq) ΔH4=dkJ·mol-1。则上述电离方程式中ΔH =
(2)若某人血液中c(HCO
 ):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为
):c(H2CO3) = 20:1,pKa1(H2CO3)=6.1,则该人血液的pH为 )=
)=(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡

(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的ΔH
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:

①利用R点所示数据,计算37 ℃时该反应的平衡常数K=
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=
您最近一年使用:0次
2018-03-19更新
|
478次组卷
|
3卷引用:四川省泸县第二中学2020届高三上学期期末考试理综化学试题
名校
解题方法
6 . 下列解释事实的离子方程式不正确的是
| A.铝片放入NaOH 溶液中有气体产生: 2Al+ 2OH-+ 2H2O=2AlO2-+3H2↑ |
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:Cr2O72-(橙色)+ H2O 2CrO42-(黄色) + 2H+ 2CrO42-(黄色) + 2H+ |
C.用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4 + CO32-  CaCO3+ SO42- CaCO3+ SO42- |
| D.向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32-+ CO2 + H2O=H2SiO3(胶体) + CO32- |
您最近一年使用:0次
7 . 下列事实不能用化学平衡移动原理解释的是
| A.光照新制的氯水时,溶液的pH逐渐减小 |
| B.红棕色的NO2,加压后颜色先变深后变浅,但比原来要深 |
| C.500℃时比室温更利于合成氨 |
| D.用排饱和食盐水法收集Cl2 |
您最近一年使用:0次
8 . 利用硅胶作吸附工具有利于将雾霾中的NO转变为NO2。下列有关转化反应2NO+O2 2NO2的说法错误的是
2NO2的说法错误的是
 2NO2的说法错误的是
2NO2的说法错误的是| A.若增加反应体系的压强,c(NO)将减小 |
| B.v正(NO)=2v正(O2) |
| C.该反应的进行是有一定限度的 |
| D.可将吸附后的硅胶置于水中,通足量空气进行后续处理 |
您最近一年使用:0次
2018-01-29更新
|
258次组卷
|
2卷引用:四川省成都市2017-2018学年高二上学期期末考试化学试题
9 . 血红蛋白(Hb)易与O2结合生成HbO2, CO吸入肺中发生反应:CO+HbO2 O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
 O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是
O2+HbCO,平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。假设空气中氧气的体积分数为20%。据此,下列结论错误的是| A.当HbCO的浓度达到HbO2浓度的0.02倍时,反应达到平衡 |
| B.可以把CO中毒的病人放入高压氧仓中解毒 |
| C.血红蛋白结合CO的能力强于O2 |
| D.空气中CO的体积分数不能超过1.8×10-5,否则对人体有害 |
您最近一年使用:0次
名校
10 . 重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是| A.向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄 |
| B.氧化性:Cr2O72->Fe3+ |
| C.CrO42-和Fe2+在酸性溶液中能大量共存 |
| D.向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动 |
您最近一年使用:0次
2017-11-29更新
|
274次组卷
|
2卷引用:四川省成都外国语学校2019-2020学年高二上学期期中考试化学试题



