名校
1 . 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上用天然气为原料,分为两阶段制备甲醇:
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态的是_______ 。
A.体系的压强不再发生变化
B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
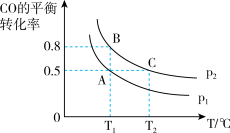
①比较A、B 两点压强大小PA_______ PB(填“>、<、=”)
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10mol CO和20mol H2,则在平衡状态 B 时,容器的体积V(B)=_______ L;
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH_______ 0(填“>、=、<”)
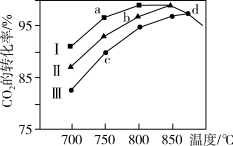
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是_______ ;CO2的转化率a 点比c点高的原因是_______ 。
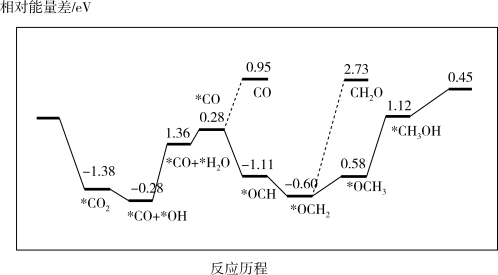
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为_______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化
B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①比较A、B 两点压强大小PA
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10mol CO和20mol H2,则在平衡状态 B 时,容器的体积V(B)=
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是

③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH

您最近一年使用:0次
2 . 燃煤电厂锅炉尾气中含有氮氧化物(主要成分NO),可通过主反应4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g) △H=-1627.7kJ·mol-1除去。温度高于300℃时会发生副反应:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-904.7kJ·mol-1。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,NO的转化率在不同催化剂作用下随温度变化的曲线如图所示。下列有关说法一定正确的是
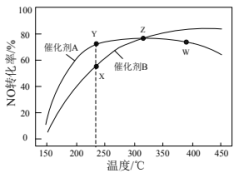

| A.N2(g)+O2(g)=2NO(g) △H=-180.7kJ·mol-1 |
| B.图中X点所示条件下,反应时间足够长,NO的转化率能达到Y点的值 |
| C.关于X、Y、Z三点,KX=KY,Z点反应达到化学平衡状态 |
| D.图中Z点到W点NO的转化率降低的原因是主反应的平衡逆向移动 |
您最近一年使用:0次
3 . 在不同体积的密闭容器中均投入0.5molCO和1molH2,在不同条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g)。实验测得平衡时H2的转化率随温度、压强的变化如图所示。下列说法错误的是
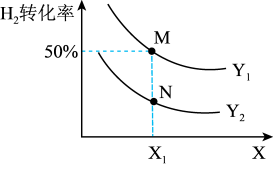

| A.X代表温度,且正反应放热 |
| B.Y代表压强,且Y1>Y2 |
| C.N点H2的转化率小于CO |
| D.若M点对应的容器体积为5L,则N点的平衡常数K=100 |
您最近一年使用:0次
4 . 已知反应: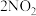 (红棕色)
(红棕色)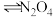 (无色)
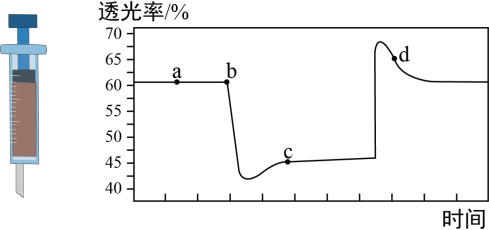
(无色)  。将一定量的
。将一定量的 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,则透光率越小)。下列说法,正确的是
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,则透光率越小)。下列说法,正确的是
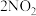 (红棕色)
(红棕色)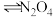 (无色)
(无色)  。将一定量的
。将一定量的 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,则透光率越小)。下列说法,正确的是
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,则透光率越小)。下列说法,正确的是
A.a点: (正) (正) (逆) d点: (逆) d点: (正) (正)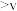 (逆) (逆) |
| B.b点对应的时刻改变的条件是将注射器压缩 |
C.c点与a点相比,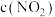 增大, 增大,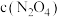 减小 减小 |
| D.若在c点将体系降低温度,其透光率将减小 |
您最近一年使用:0次
2022-08-28更新
|
152次组卷
|
3卷引用:河南省信阳市2021-2022学年高二上学期期中考试化学试题
2021高二·全国·专题练习
5 . 一定温度下,在密闭容器中发生反应:N2O4(g)⇌2NO2(g) ΔH>0,反应达到平衡时,下列说法不正确的是
| A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深 |
| B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变 |
| C.若体积不变,向容器中再加入一定量的N2O4,相对于原平衡,平衡向正反应方向移动,再次平衡时N2O4的转化率将升高 |
| D.若体积不变,升高温度,再次平衡时体系颜色加深 |
您最近一年使用:0次
名校
解题方法
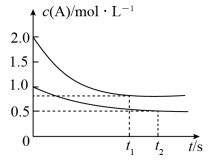
6 . 向甲、乙两个容积均为1L的恒容密闭容器中分别充入2molA、2molB和1molA、1molB,相同条件下,发生反应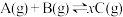 。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
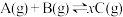 。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
。测得两容器中c(A)随时间t的变化关系如图所示。下列说法不正确的是
| A.x等于1 |
| B.向平衡后的乙容器中充入氦气,平衡不移动 |
| C.从平衡后的甲容器中移走1molC,重新达到平衡后各物质的体积分数与乙容器中的相同 |
D.若向乙容器中再充入1molA、1molB,则达到化学平衡时乙容器中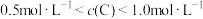 |
您最近一年使用:0次
解题方法
7 . 化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中不正确的是
A.恒温恒容的密闭容器中发生反应mA(g)+nB(g) pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深 pC(g),若B是有色物质,A,C均为无色物质,达到平衡后,加入一定量C,体系的颜色会变深 |
| B.一定温度下两个体积相同密闭容器中,分别放有二氧化氮、气态溴,起始时两个容器中气体颜色相同,若将容器体积压缩至原来的一半,则CNO2>CBr2 |
| C.综合考虑反应速率和限度,以及催化剂活性,合成氨一般选择400℃~500℃ |
D.恒温时,对于反应A(g)+3B(g) 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n% 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压为原来的两倍,则A体积分数仍为n% |
您最近一年使用:0次
名校
8 . 高温结构陶瓷氮化硅(Si3N4)可由石英与焦炭在高温的氮气流中通过以下反应制备: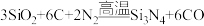 ,下列说法中错误的是
,下列说法中错误的是
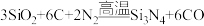 ,下列说法中错误的是
,下列说法中错误的是| A.氮化硅陶瓷是制造火箭发动机的理想材料 | B.氮气流的作用只是参与化学反应 |
| C.CO的沸点大于N2的沸点 | D.1molSi3N4中含有Si-N键数为12NA |
您最近一年使用:0次
2021-03-13更新
|
353次组卷
|
2卷引用:辽宁省沈阳市2021届高三教学质量监测(一)化学试题
2020·浙江金华·一模
名校
9 . 人体内的血红蛋白(Hb)可与O2结合形成HbO2,Hb(aq)也可以与CO结合,人体发生CO中毒的原理为:HbO2(aq)+CO(g) HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法不正确 的是
 HbCO(aq)+O2(g) ΔH<0.下列说法
HbCO(aq)+O2(g) ΔH<0.下列说法| A.海拔较高的地区由于气压较低,所以血红蛋白较难与O2结合,容易产生缺氧现象 |
| B.已知CO中毒为熵减过程,则理论上冬天比夏天可能更容易发生CO中毒现象 |
| C.把CO中毒的人转到高压氧仓中有助于缓解症状 |
D.此反应的平衡常数K=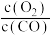 |
您最近一年使用:0次
2021-03-05更新
|
571次组卷
|
8卷引用:考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市第七中学校2021-2022学年高二上学期第一次月考化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)重庆市石柱中学校2021-2022学年高二上学期第一次月考化学试题甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题浙江省金华十校2021届高三11月选考化学模拟试卷(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
10 . 已知图一表示的是可逆反应C(s)+H2O(g) CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)
CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g) 2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
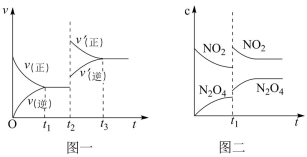
 CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)
CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g) 2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
2NO2(g)△H>0的浓度(c)随时间(t)的变化情况。下列说法中正确的是
| A.图一t2时改变的条件可能是升高了温度或增大了压强 |
| B.图一t2时改变的条件是增大压强,则反应的△H增大 |
| C.图二t1时改变的条件可能是升高了温度 |
| D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
您最近一年使用:0次
2021-03-04更新
|
902次组卷
|
8卷引用:新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(4-21班)试题
新疆乌苏市第一中学2020-2021学年高二下学期入学检测化学(4-21班)试题(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第2章 化学反应速率和化学平衡(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)四川省成都市简阳市阳安中学2021-2022学年高二上学期9月月考化学试卷广东省佛山市南海区桂城中学2021-2022学年高二上学期第一次月考化学试题(已下线)2.4 化学反应的调控(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)广东省徐闻县徐闻中学2022-2023学年高二上学期开学测试化学试题广东省广州市四校联考2022-2023学年高二上学期第一次月考化学试题



