名校
1 . 联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:

(1)碳元素在周期表中的位置是______________ 。
(2)将硅的元素符号填写在上述周期表相应的空格中。________
(3)在上述周期表中,用实线画出周期表的上方边界。_______
(4)第118号元素为Og(中文名“ ”,ào),下列说法不正确的是
”,ào),下列说法不正确的是____ 。
a.Og是第七周期0族元素
b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强
d.中子数为179的Og核素符号是

(1)碳元素在周期表中的位置是
(2)将硅的元素符号填写在上述周期表相应的空格中。
(3)在上述周期表中,用实线画出周期表的上方边界。
(4)第118号元素为Og(中文名“
 ”,ào),下列说法不正确的是
”,ào),下列说法不正确的是a.Og是第七周期0族元素
b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强
d.中子数为179的Og核素符号是

您最近一年使用:0次
名校
2 . 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。
(1)Q的原子结构示意图是________ 。
(2)Y、Z、W形成简单离子,其离子半径关系为________ (用离子符号表示)。
(3)用有关离子方程式表示Q、W元素的非金属性强弱______________
(4)Y的氢化物分子中含有18个电子,该分子中的共价键类型_____________________________ 。
(5)W的最高价氧化物对应的水化物的浓溶液与Cu反应的化学方程式为________________________ 。
| X | Y | ||||
| Z | W | Q | |||
(1)Q的原子结构示意图是
(2)Y、Z、W形成简单离子,其离子半径关系为
(3)用有关离子方程式表示Q、W元素的非金属性强弱
(4)Y的氢化物分子中含有18个电子,该分子中的共价键类型
(5)W的最高价氧化物对应的水化物的浓溶液与Cu反应的化学方程式为
您最近一年使用:0次
2019-03-12更新
|
293次组卷
|
2卷引用:河北省辛集一中2018-2019学年高二下学期返校考试化学试题
3 . 如表为元素周期表的一部分,标出了A~K共十种元素所在位置。请用元素符号或化学式 回答下列问题。
(1)10种元素中,化学性质最不活泼的是______ ,最活泼的金属是_____ 。
(2)C、E、F三种元素形成的简单离子半径最小的是_______ 。
(3)化合物C2B2的电子式为__________________ ;该化合物和AB2反应的化学方程式为__________________________________________ 。
(4)E的最高价氧化物属于________________ 性氧化物,它与氢氧化钠溶液反应的离子方程式为____________________________________________ 。
(5)D的单质在A、B形成化合物中燃烧的化学方程式为________________________ 。
(6)用电子式表示H与B组成的H2B型化合物的形成过程_____________________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | A | B | ||||||
| 3 | C | D | E | F | G | |||
| 4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是
(2)C、E、F三种元素形成的简单离子半径最小的是
(3)化合物C2B2的电子式为
(4)E的最高价氧化物属于
(5)D的单质在A、B形成化合物中燃烧的化学方程式为
(6)用电子式表示H与B组成的H2B型化合物的形成过程
您最近一年使用:0次
4 . 下表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:④_______ ;⑫________ 。
(2)画出原子的结构示意图:⑤_________ ;⑪________ 。
(3)在①~⑫元素中,金属性最强的元素是_________ ,非金属性最强的元素是_______ ,最不活泼的元素是________ (均填元素符号)。
(4)元素⑦与元素⑧相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是___________ (填序号)。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为_____ 。且该氧化物可溶解在强碱NaOH中其离子方程式_______ 。
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:④
(2)画出原子的结构示意图:⑤
(3)在①~⑫元素中,金属性最强的元素是
(4)元素⑦与元素⑧相比,非金属性较强的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为
您最近一年使用:0次
名校
5 . (1)原子序数大于4的主族元素A和B的离子Am+和Bn-,它们的核外电子排布相同,则:
①A和B的质子数之差为_________________ (用m、n 表示)。
②B和A的族序数之差为_________________ (用含m、n的代数式表示)。
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
①如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为_____________________ ;
②如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为_____________ 。
①A和B的质子数之差为
②B和A的族序数之差为
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。
①如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为
②如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为
您最近一年使用:0次
2018-04-01更新
|
280次组卷
|
2卷引用:河北省邢台市第一中学2017-2018学年高一下学期第一次月考化学试题
6 . 下图是元素周期表的一部分,表中的①~⑨中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________ 。
(2)地壳中含量最多的金属元素是_____________________________ 。
(3)②与④形成的化合物的电子式______________________________ 。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是___________ ,碱性最强的是____________ ,呈两性的氢氧化物是__________________ 。
 族 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)地壳中含量最多的金属元素是
(3)②与④形成的化合物的电子式
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
您最近一年使用:0次
2017-12-01更新
|
200次组卷
|
2卷引用:河北省唐山市滦县二中2017-2018学年高二期中考试化学(文)试卷
名校
7 . 下表是元素周期表的前三周期:
回答下列问题:
(1)J元素的名称:___________ 。
(2)G元素与I元素形成的化合物的电子式是___________ ,
A、G、E形成的化合物中含有的化学键类型为_____________________________ 。
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是_____________ ,
属于两性氢氧化物的是_______________ (用化合物的化学式表示)。
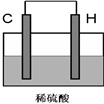
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为_________ 极(填正或负),并写出该电极反应式为:____________________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
回答下列问题:
(1)J元素的名称:
(2)G元素与I元素形成的化合物的电子式是
A、G、E形成的化合物中含有的化学键类型为
(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是
属于两性氢氧化物的是
(4)将H单质与C的一种单质(导体)按如下图装置连接,其中C极为

您最近一年使用:0次
2017-07-25更新
|
300次组卷
|
2卷引用:河北省枣强中学2017-2018学年高一下学期第一次月考化学试题
8 . 铁、铜、铬、镍及其化合物在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________ ,基态铁原子价电子排布式为___________ 。
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是______________ ,P、S元素第一电离能大小关系为_______________ 。
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为________ ;该配合物的熔点是170℃,则Ni(CO)n 属于 _______ 晶体。
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______ ,乙醇极易溶于水,其主要原因是_______________ 。
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为________ ,其晶胞边长为a cm,列式表示NiO晶体的密度为____ g/cm3(不必计算出结果,阿伏伽德罗常数的值为NA)。
(1)铁在元素周期表中的位置是
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为
(4)在铬的催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为
您最近一年使用:0次
2017-07-01更新
|
482次组卷
|
2卷引用:河北省鸡泽、曲周、邱县、馆陶四县2017-2018学年高二(2019届新高三)下学期期末联考化学试题
名校
解题方法
9 . 原子结构与元素周期表存在着内在联系。根据已学知识,请回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:第________ 周期第________ 族。
(2)写出原子序数最小的第Ⅷ族元素原子的核外电子排布式:____________ 。
(3)写出3p轨道上只有2个未成对电子的元素的符号:____________ 、____________ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:第
(2)写出原子序数最小的第Ⅷ族元素原子的核外电子排布式:
(3)写出3p轨道上只有2个未成对电子的元素的符号:
您最近一年使用:0次
2017-05-06更新
|
205次组卷
|
2卷引用:河北省馆陶县第一中学2016-2017学年高二下学期期中考试化学试题
名校
10 . 19世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:
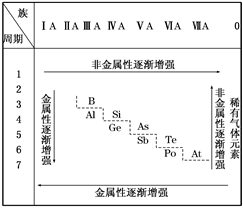
(1)门捷列夫的突出贡献是________ 。
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明________ 。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到________ 。
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子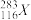 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是________ 。
A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合

(1)门捷列夫的突出贡献是
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子
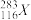 ,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是
,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
您最近一年使用:0次
2017-05-02更新
|
259次组卷
|
3卷引用:河北省唐山市开滦第二中学2017-2018学年高一4月月考化学试题



