名校
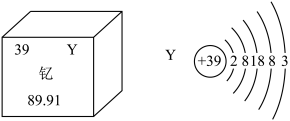
1 . 新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:_______ 个质子,左图中89.91表示的是_______ ;
(2)电子离核越远能量越高,越容易在反应中失去,Y的核外电子其占据_______ 个电子层;
(3)钇元素形成氧化物的化学式是_______ 。
(2)电子离核越远能量越高,越容易在反应中失去,Y的核外电子其占据
(3)钇元素形成氧化物的化学式是
您最近一年使用:0次
2022-10-08更新
|
327次组卷
|
3卷引用:福建师范大学附属中学2023-2024学年高一上学期期中练习卷化学试题
2 . 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)上述元素属于第三周期,且可以做半导体材料的是_______ (填字母代号)。
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ·mol-1):
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______ 。
②表中Y可能为以上13种元素中的_______ (填写字母)元素。用元素符号表示X和l形成化合物的电子式是_______ 。
(3)以上13种元素中,_______ (填写字母)元素原子失去核外第一个电子需要的能量最多。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中元素c位于_______ 区。
| b | |||||||||||||||||||
| h | j | ||||||||||||||||||
| a | c | f | i | l | m | ||||||||||||||
| e | g | ||||||||||||||||||
| d | k | ||||||||||||||||||
(1)上述元素属于第三周期,且可以做半导体材料的是
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ·mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量
②表中Y可能为以上13种元素中的
(3)以上13种元素中,
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中元素c位于
您最近一年使用:0次
解题方法
3 . 针对下面10种元素,完成以下各小题。
(1)地壳中含量最多的元素是_______ (填名称)。
(2)化学性质最不活泼的元素是_______ (填元素符号)。
(3)Al的原子结构示意图为_______ 。
(4)C与N相比,原子半径较小的是_______ 。
(5)最高价氧化物对应的水化物碱性最强的是_______ (填化学式)。
(6)MgO和Al2O3中,属于两性氧化物的是_______ 。
(7)S和Cl相比,元素非金属性较强的是_______ 。
(8)可用来制造光导纤维的物质是_______ ,晶体硅的主要用途是_______ (写出一种)。
(9)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:_______ 。
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(1)地壳中含量最多的元素是
(2)化学性质最不活泼的元素是
(3)Al的原子结构示意图为
(4)C与N相比,原子半径较小的是
(5)最高价氧化物对应的水化物碱性最强的是
(6)MgO和Al2O3中,属于两性氧化物的是
(7)S和Cl相比,元素非金属性较强的是
(8)可用来制造光导纤维的物质是
(9)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,请写出反应的化学方程式:
您最近一年使用:0次
名校
4 . 如表是元素周期表的一部分,根据表中给出的10种元素(其中X、Y分别表示某种化学元素),按要求作答。
(1)X、Y两种元素符号分别是____ 和____ 。
(2)Mg的原子序数为____ 。
(3)氧元素位于第二周期第____ 。
(4)表中失电子能力最强的原子是____ 。
(5)表中某原子最外层电子数为4,其元素符号是____ 。
(6)F与N相比,原子半径较小的是____ 。
(7)O2与S单质相比,更难与H2化合的是____ 。
(8)NH3中N元素的化合价为____ ,其水溶液呈____ (填“酸性”或“碱性”)。
(9)Cl2与水反应的生成物中具有漂白作用的是____ (填“HCl”或“HClO”),写出该反应的化学方程式:____ 。
(10)下列各项比较,符合相关性质递变规律的是____ (填标号)。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | N | O | F | X | ||||
| 3 | Na | Y | Al | Si | S | Cl |
(2)Mg的原子序数为
(3)氧元素位于第二周期第
(4)表中失电子能力最强的原子是
(5)表中某原子最外层电子数为4,其元素符号是
(6)F与N相比,原子半径较小的是
(7)O2与S单质相比,更难与H2化合的是
(8)NH3中N元素的化合价为
(9)Cl2与水反应的生成物中具有漂白作用的是
(10)下列各项比较,符合相关性质递变规律的是
| A.氧化性:O2>N2 | B.金属性:Na<Mg |
| C.酸性:H2SO4>HClO4 | D.碱性:NaOH<Mg(OH)2 |
您最近一年使用:0次
2022-07-11更新
|
448次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
5 . 许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛美誉为“未来钢铁”“战略金属”。基态钛原子中电子占据最高能级的符号为____ 。
(2)镓在周期表中的位置____ 。
(3)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因是____ 。
(4)下列Li原子电子排布图表示的状态中,能量最高的为____ (填字母)。
A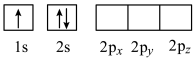 . B.
. B. 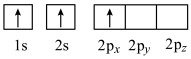 C.
C.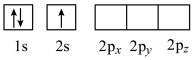
(5)Li+与H-具有相同的电子层结构,r(Li+)小于r(H-),原因是____ 。
(1)钛美誉为“未来钢铁”“战略金属”。基态钛原子中电子占据最高能级的符号为
(2)镓在周期表中的位置
(3)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因是
(4)下列Li原子电子排布图表示的状态中,能量最高的为
A
 . B.
. B.  C.
C.
(5)Li+与H-具有相同的电子层结构,r(Li+)小于r(H-),原因是
您最近一年使用:0次
6 . 1869年,门捷列夫总结出了元素周期表,还基于此预言了三种当时未被发现的元素,门捷列夫分别称它们为“类硼”、“类铝”与“类硅”。这三种元素在之后的几十年中陆续被发现,从而让人们意识到元素周期表具有重大价值。
(1)基态硼原子的最外层电子数为___________ 。“类硼”是与硼同族的第四周期元素,则“类硼”可能有的性质是___________ (填写下列字母)。
a.最高化合价为 b.该元素单质具有金属光泽
b.该元素单质具有金属光泽
c.该元素单质可与沸水反应置换出 d.该元素最高价氧化物对应水化物是强碱
d.该元素最高价氧化物对应水化物是强碱
(2)“类硼”最高价氯化物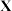 的熔点为
的熔点为 ,则
,则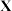 的化学式为
的化学式为___________ ,且该物质属于___________ 晶体。
(3)“类硅”与硅同族,且其基态原子中电子占据了4个能级组,则该元素处于第___________ 周期,其基态原子最外层有___________ 个未成对电子。“类硅”的原子半径___________ (填“>”、“<”或“=”)“类硼”的原子半径,“类硅”的电负性___________ (填“>”、“<”或“=”)“类硼”的电负性。
(4)“类铝”原子与铝原子具有相同的价电子数,与“类硼”是同一周期的两种不同元素。则“类铝”位于元素周期表___________ 区中,其基态原子的价电子的电子排布式为___________ 。
(1)基态硼原子的最外层电子数为
a.最高化合价为
 b.该元素单质具有金属光泽
b.该元素单质具有金属光泽c.该元素单质可与沸水反应置换出
 d.该元素最高价氧化物对应水化物是强碱
d.该元素最高价氧化物对应水化物是强碱(2)“类硼”最高价氯化物
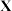 的熔点为
的熔点为 ,则
,则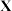 的化学式为
的化学式为(3)“类硅”与硅同族,且其基态原子中电子占据了4个能级组,则该元素处于第
(4)“类铝”原子与铝原子具有相同的价电子数,与“类硼”是同一周期的两种不同元素。则“类铝”位于元素周期表
您最近一年使用:0次
2022-06-29更新
|
238次组卷
|
3卷引用:福建省漳州市第三中学2022-2023学年高二下学期3月质量检测化学试题
福建省漳州市第三中学2022-2023学年高二下学期3月质量检测化学试题上海交通大学附属中学2021-2022 学年高一下学期阶段性考试化学试题(已下线)专题03 晶体结构与性质-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(上海专用)
7 . I.如图为元素周期表的一部分,请回答下列问题。

(1)图中阴影部分所示区域的元素称为_______ 元素,下列元素属于该区域的是_______ 。
A.Ba B.Mn C.I D.Rb
(2)下列说法不正确的是_______;
II.已知A、B、C、D、E、F六种短周期元素的原子半径和主要化合价如表:
(3)写出C元素在元素周期表中的位置_______ ;
(4)E和F的最高价氧化物的水化物相互反应的离子方程式为_______ ;
(5)以上元素的单质中还原性最强的是_______ (填化学式);
(6)上述某种元素其最高价氧化物的水化物与其气态氢化物相互反应的化学方程式_______ 。

(1)图中阴影部分所示区域的元素称为
A.Ba B.Mn C.I D.Rb
(2)下列说法不正确的是_______;
| A.最高正价与最低负价绝对值相等的元素一定处于IVA族 |
| B.图中①形成的最高价氧化物的水化物比③形成的最高价氧化物的水化物碱性强 |
| C.图中②的单质可与冷水剧烈反应 |
| D.同周期相邻主族元素的原子序数可能相差1、11或25 |
II.已知A、B、C、D、E、F六种短周期元素的原子半径和主要化合价如表:
| 元素代号 | A | B | C | D | E | F |
| 原子半径/nm | 0.074 | 0.075 | 0.077 | 0.160 | 0.186 | 0.143 |
| 主要化合价 |  |  、 、 |  、 、 |  |  |  |
(4)E和F的最高价氧化物的水化物相互反应的离子方程式为
(5)以上元素的单质中还原性最强的是
(6)上述某种元素其最高价氧化物的水化物与其气态氢化物相互反应的化学方程式
您最近一年使用:0次
名校
8 . 下表为元素周期表的一部分,请回答下列有关问题:
(1)元素②的一种核素可测定文物年代,这种核素的符号为___________ ,已知元素⑩的一种核素,其中子数为45,这种核素的符号为___________ 。
(2)由元素①和④可形成18电子的化合物,该化合物的化学式为___________ 。
(3)图中标出的元素的最高价氧化物对应的水化物中,酸性最强的是___________ (用化学式回答),写出该水化物与⑥的最高价氧化物的水化物反应的离子方程式___________ 。
(4)将⑤、⑥、⑨单质各1mol分别投入到足量的同浓度的盐酸中,预测实验结果:___________ 与盐酸反应最剧烈,___________ 与盐酸反应的速度最慢;___________ 与盐酸反应产生的气体最多。(用元素符号回答)
(5)元素的非金属性⑧___________ ⑩(填“>”或“<”);下列事实不能证明上述结论的是___________ 。
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(1)元素②的一种核素可测定文物年代,这种核素的符号为
(2)由元素①和④可形成18电子的化合物,该化合物的化学式为
(3)图中标出的元素的最高价氧化物对应的水化物中,酸性最强的是
(4)将⑤、⑥、⑨单质各1mol分别投入到足量的同浓度的盐酸中,预测实验结果:
(5)元素的非金属性⑧
A.元素⑧的单质与⑩的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑩的强
C.元素⑧和⑩的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑩的弱
E.元素⑧的氢化物的还原性比元素⑩的弱
您最近一年使用:0次
名校
9 . 下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
(1)画出①和③两种元素的原子1:2组成的化合物的电子式_______ 。
(2)元素①-⑩中化学性质最不活泼的元素是_______ (填元素符号)。
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是_______ (填离子符号)。
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为_______ 。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①-⑩中化学性质最不活泼的元素是
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有
您最近一年使用:0次
2022-04-04更新
|
400次组卷
|
2卷引用:福建省福州第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
10 . 如表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
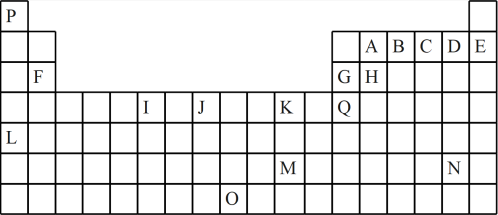
(1)I的最高化合价为____ ;K的元素名称为____ 。
(2)基态时G元素原子的电子排布式___ ,J元素原子的外围电子排布式___ 。
(3)下列对比正确的是___ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是____ 。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b. O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)元素B和C的气态氢化物热稳定性较强的是____ (填化学式)。

(1)I的最高化合价为
(2)基态时G元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b. O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)元素B和C的气态氢化物热稳定性较强的是
您最近一年使用:0次



