名校
解题方法
1 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1) 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
___________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为___________ 。
(2)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①碳化硅晶体中每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为________ , 的晶体类型是
的晶体类型是_______ 。
②基态 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为___________ 。
(3)利用 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)
 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①碳化硅晶体中每个
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为 的晶体类型是
的晶体类型是②基态
 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为(3)利用
 与
与 可制得氮化硅(
可制得氮化硅( )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是
您最近一年使用:0次
解题方法
2 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄( )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应:
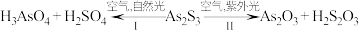
下列说法错误的是
 )褪色的主要原因是发生了以下两种化学反应:
)褪色的主要原因是发生了以下两种化学反应: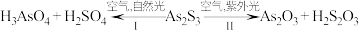
下列说法错误的是
A. 和 和 的空间构型都是正四面体形 的空间构型都是正四面体形 |
| B.反应Ⅰ和Ⅱ中均有两种氧化产物 |
C.反应Ⅰ和Ⅱ中,氧化1  转移的电子数之比为7∶3 转移的电子数之比为7∶3 |
D.反应Ⅰ和Ⅱ中,参加反应 的比值:反应Ⅰ 的比值:反应Ⅰ 反应Ⅱ 反应Ⅱ |
您最近一年使用:0次
名校
解题方法
3 . 二茂铁(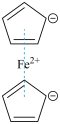 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1)Fe在周期表中的___________ 区,Fe变为Fe2+时是失去___________ 轨道电子;若受热后Fe的1个4s电子会跃迁至4p轨道,写出Fe的该激发态电子排布式:[Ar]___________ 。
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是___________ ,配位原子为___________ 。
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为___________ ;H3O+中氧原子的杂化方式为___________ ,H3O+空间构型为___________ 。
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元( )所取代(如图乙)。
)所取代(如图乙)。

一个T-碳晶胞中含有___________ 个碳原子,已知T-碳的密度约为金刚石的一半。则T-碳晶胞的边长和金刚石晶胞的边长之比为___________ 。
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)Fe在周期表中的
(2)羰基铁粉【Fe(CO)5】中铁元素的配位数是
(3)二茂铁的衍生物可和H3O+等微粒产生静电作用,H、O和C的电负性由大到小的顺序为
(4)T-碳是碳的一种同素异形体,其晶体结构可以看成是金刚石晶体(如图甲)中每 个碳原子被一个由四个碳原子组成的正四面体结构单元(
 )所取代(如图乙)。
)所取代(如图乙)。
一个T-碳晶胞中含有
您最近一年使用:0次
名校
解题方法
4 . A~E是周期表中1~36号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多。
(1)基态B原子的价电子中,两种自旋状态的电子数之比为___________ 。 中C原子的杂化方式为
中C原子的杂化方式为___________ 。
(2)已知元素的电负性:C>D,则C与D形成的化合物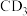 的空间构型为
的空间构型为___________ ,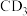 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为___________ 。
(3)E位于元素周期表的___________ 区。
(4)已知常温下 的水解常数
的水解常数 。
。
常温下,含等物质的量浓度的HBC与NaBC的混合溶液显___________ (填“酸”“碱”或“中”)性,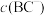
___________ (填“>”“<”或“=”)c(HBC)。常温下,若将 盐酸与
盐酸与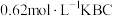 溶液等体积混合后恰好得到中性溶液,则c=
溶液等体积混合后恰好得到中性溶液,则c=___________ (小数点后保留4位数字)。
(1)基态B原子的价电子中,两种自旋状态的电子数之比为
 中C原子的杂化方式为
中C原子的杂化方式为(2)已知元素的电负性:C>D,则C与D形成的化合物
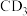 的空间构型为
的空间构型为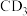 与水发生水解反应的化学方程式为
与水发生水解反应的化学方程式为(3)E位于元素周期表的
(4)已知常温下
 的水解常数
的水解常数 。
。常温下,含等物质的量浓度的HBC与NaBC的混合溶液显
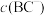
 盐酸与
盐酸与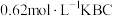 溶液等体积混合后恰好得到中性溶液,则c=
溶液等体积混合后恰好得到中性溶液,则c=
您最近一年使用:0次
2023-12-03更新
|
487次组卷
|
3卷引用:辽宁省沈阳市五校协作体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 我国在新材料领域的研究有重大突破,为“天宫”空间站的建设提供了物质基础。“天宫”空间站使用的材料中含有C、N、Si、P、Fe等元素。回答下列问题:
(1)基态硅原子的价电子排布式为___________ ,其基态原子核外有___________ 种不同空间运动状态的电子。
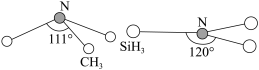
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物的结构和性质存在较大差异。化合物 (三角锥形)和
(三角锥形)和 (平面形)的结构如图所示,则二者中N的杂化方式分别为
(平面形)的结构如图所示,则二者中N的杂化方式分别为___________ ,更易形成配合物的是___________ 。
(3)白磷在氯气中燃烧可以得到 和
和 ,其中气态
,其中气态 分子的空间结构为
分子的空间结构为________ 。
(4) 晶体的晶胞如图所示,晶胞边长为a nm。设
晶体的晶胞如图所示,晶胞边长为a nm。设 为阿伏加德罗常数的值,则晶体密度的计算表达式为
为阿伏加德罗常数的值,则晶体密度的计算表达式为___________  ;晶胞中
;晶胞中 位于
位于 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为___________ nm。

(1)基态硅原子的价电子排布式为
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物的结构和性质存在较大差异。化合物
 (三角锥形)和
(三角锥形)和 (平面形)的结构如图所示,则二者中N的杂化方式分别为
(平面形)的结构如图所示,则二者中N的杂化方式分别为
(3)白磷在氯气中燃烧可以得到
 和
和 ,其中气态
,其中气态 分子的空间结构为
分子的空间结构为(4)
 晶体的晶胞如图所示,晶胞边长为a nm。设
晶体的晶胞如图所示,晶胞边长为a nm。设 为阿伏加德罗常数的值,则晶体密度的计算表达式为
为阿伏加德罗常数的值,则晶体密度的计算表达式为 ;晶胞中
;晶胞中 位于
位于 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
名校
解题方法
6 . 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。
已知:
Ⅰ.N2(g)+3H2(g) 2NH3(g) ΔH1=-92kJ•mol-1
2NH3(g) ΔH1=-92kJ•mol-1
Ⅱ.C(s)+O2(g) CO2(g) ΔH2=-394kJ•mo1-1
CO2(g) ΔH2=-394kJ•mo1-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g) H2NCOONH4(s) ΔH3=-646kJ•mol-1
H2NCOONH4(s) ΔH3=-646kJ•mol-1
Ⅳ.H2NCOONH4(s) 2NH3(g)+CO2(g) ΔH4
2NH3(g)+CO2(g) ΔH4
回答下列问题:
(1)NH3的空间构型为________ ,NH3的键角大于PH3,分析原因为________ 。
(2)ΔH4=________ ;T℃下在某密闭容器中加入H2NCOONH4(s),假设只发生反应Ⅳ,达平衡时测得NH3的浓度为c1,保持温度不变,加压(缩小容器的体积),测得新的平衡条件下NH3的浓度为c2,则c1________ c2(填“>”“<”或“=”)。反应Ⅳ在________ (填“高温”“低温”或“任意温度”)条件下能够自发进行。
(3)某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa,10min末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=________ MPa/min,此时平衡常数Kp=________ 。对于该条件下的反应,下列说法错误的是________ 。
A.当H2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)在一定的条件下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3,在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:
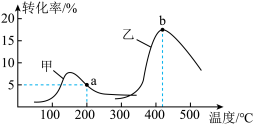
某学习小组的同学通过讨论得出结论:200℃时,a点对应的转化率(5%)不是使用催化剂甲、下H2的平衡转化率,判断依据是________ 。
已知:
Ⅰ.N2(g)+3H2(g)
 2NH3(g) ΔH1=-92kJ•mol-1
2NH3(g) ΔH1=-92kJ•mol-1Ⅱ.C(s)+O2(g)
 CO2(g) ΔH2=-394kJ•mo1-1
CO2(g) ΔH2=-394kJ•mo1-1Ⅲ.N2(g)+3H2(g)+C(s)+O2(g)
 H2NCOONH4(s) ΔH3=-646kJ•mol-1
H2NCOONH4(s) ΔH3=-646kJ•mol-1Ⅳ.H2NCOONH4(s)
 2NH3(g)+CO2(g) ΔH4
2NH3(g)+CO2(g) ΔH4回答下列问题:
(1)NH3的空间构型为
(2)ΔH4=
(3)某温度下在一刚性的密闭容器中,充入等物质的量N2和H2发生反应Ⅰ,起始压强为1MPa,10min末达平衡,测得平衡时压强为0.8MPa,则10min内v(N2)=
A.当H2的体积分数不变时,说明反应已经达到化学平衡状态
B.温度升高化学反应速率加快,化学平衡常数增大
C.其他条件不变时,若适当增加N2的用量,可以提高H2的平衡转化率
D.使用合适的催化剂可以加快化学反应速率,但ΔH1不变
(4)在一定的条件下,将AmolN2和BmolH2充入某体积固定的密闭容器中合成NH3,在不同的催化剂(甲或乙)下发生反应,反应相同时间后H2的转化率与温度的关系如图:

某学习小组的同学通过讨论得出结论:200℃时,a点对应的转化率(5%)不是使用催化剂甲、下H2的平衡转化率,判断依据是
您最近一年使用:0次
名校
解题方法
7 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。
①基态Fe原子的电子排布式为___________ 。
②实际生产中采用铁的氧化物 、
、 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
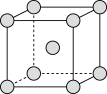
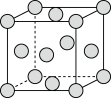
ⅰ.两种晶胞所含铁原子个数比为___________ 。
ⅱ.图1晶胞的棱长为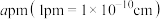 ,则其密度
,则其密度
___________  。
。
③我国科学家开发出 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因___________ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
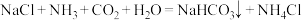
①1体积水可溶解1体积 ,1体积水可溶解约700体积
,1体积水可溶解约700体积 。
。 极易溶于水的原因是
极易溶于水的原因是___________ 。
②反应时,向饱和 溶液中先通入
溶液中先通入___________ 。
③ 分解得
分解得 。
。 空间结构为
空间结构为___________ 。
(3) 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ 。
② 存在配位键,写出其体现配位键的结构式
存在配位键,写出其体现配位键的结构式___________ 。
③比较熔点:
___________  (填“>”或“<”)。
(填“>”或“<”)。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用一直是科学研究的重要课题。
的合成及应用一直是科学研究的重要课题。
(1)以
 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。①基态Fe原子的电子排布式为
②实际生产中采用铁的氧化物
 、
、 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为
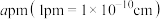 ,则其密度
,则其密度
 。
。③我国科学家开发出
 等双中心催化剂,在合成
等双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
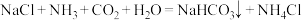
①1体积水可溶解1体积
 ,1体积水可溶解约700体积
,1体积水可溶解约700体积 。
。 极易溶于水的原因是
极易溶于水的原因是②反应时,向饱和
 溶液中先通入
溶液中先通入③
 分解得
分解得 。
。 空间结构为
空间结构为(3)
 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。| 元素 | H | B | N |
| 电负性 | 2.1 | 2.0 | 3.0 |
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,写出其体现配位键的结构式
存在配位键,写出其体现配位键的结构式③比较熔点:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
8 . 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(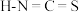 ),其原因是
),其原因是___________ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为___________ ; 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为___________ 。
(3)卤素互化物如 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为___________ 。
(4)请推测① 、②
、②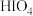 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为___________ (填序号)。
(5) 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为___________ 个;若该晶胞的边长为 ,则该晶体的密度为
,则该晶体的密度为___________  (写出表达式)。
(写出表达式)。

(1)拟卤素
 与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。
与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。 对应的酸有两种,测得硫氰酸
对应的酸有两种,测得硫氰酸 的沸点低于异硫氰酸(
的沸点低于异硫氰酸(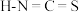 ),其原因是
),其原因是(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 属于多卤素阳离子,其空间构型为
属于多卤素阳离子,其空间构型为(3)卤素互化物如
 等与卤素单质结构和性质相似。
等与卤素单质结构和性质相似。 沸点由高到低的顺序为
沸点由高到低的顺序为(4)请推测①
 、②
、②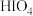 、③
、③ 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为(5)
 晶体的晶胞结构与
晶体的晶胞结构与 晶体的相似(如图所示),
晶体的相似(如图所示), 晶体中的哑铃形
晶体中的哑铃形 的存在,使晶胞沿一个方向拉长。此晶体中1个
的存在,使晶胞沿一个方向拉长。此晶体中1个 周围距离最近的
周围距离最近的 为
为 ,则该晶体的密度为
,则该晶体的密度为 (写出表达式)。
(写出表达式)。
您最近一年使用:0次
名校
解题方法
9 . 锗(Ge)、碲化镉(CdTe)等是优良的半导体材料。回答下列问题:
(1)Ge在元素周期表中的位置___________ ,Ge的逐级电离能I4≪I5的原因是___________ 。
(2)经X射线衍射实验证明在碲酸( )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为___________ 。
(3)锗可以形成无机化合物 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为___________ ,锗也可以形成类似于烷烃结构的 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为___________ , 该分子中含有的
该分子中含有的 键数目为
键数目为___________ 。
(4)锗的氯化物 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是___________ , 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有___________ 个。
(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为___________ 空隙(填几何构型名称),若CdTe的摩尔质量为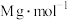 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离___________ nm。(用含M、 、
、 的代数式表示)
的代数式表示)

(1)Ge在元素周期表中的位置
(2)经X射线衍射实验证明在碲酸(
 )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为(3)锗可以形成无机化合物
 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为 该分子中含有的
该分子中含有的 键数目为
键数目为(4)锗的氯化物
 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为
 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)尿素( )中碳原子杂化轨道类型是
)中碳原子杂化轨道类型是_______ 。NH 离子的VSEPR模型是
离子的VSEPR模型是_______ ,空间构型是_______ 。
(2)Ti3+能形成配合物[TiCl(H2O)5]Cl2·H2O,其中内界是_______ ,配位数为_______ 。在0.5mol该配合物溶液中滴加足量的AgNO3溶液,产生沉淀的物质的量是_______ 。
(3)肼(N2H4)可用作火箭燃料等,它的沸点远高于乙烯的原因是_______ 。
(4)硒化锌的晶胞结构如图所示,硒化锌的化学式为_______ 。

(5)Cu2O和Cu2S都是离子晶体,熔点较高的是_______ ,原因是_______ 。
(1)尿素(
 )中碳原子杂化轨道类型是
)中碳原子杂化轨道类型是 离子的VSEPR模型是
离子的VSEPR模型是(2)Ti3+能形成配合物[TiCl(H2O)5]Cl2·H2O,其中内界是
(3)肼(N2H4)可用作火箭燃料等,它的沸点远高于乙烯的原因是
(4)硒化锌的晶胞结构如图所示,硒化锌的化学式为

(5)Cu2O和Cu2S都是离子晶体,熔点较高的是
您最近一年使用:0次



