内蒙古包头市第一中学2020-2021学年高二上学期第一次月考化学试题
内蒙古
高二
阶段练习
2020-10-23
297次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、化学实验基础
一、单选题 添加题型下试题
| A.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| B.易溶于水的电解质不一定是强电解质 |
| C.强电解质的水溶液的导电能力一定比弱电解质的水溶液导电能力强 |
| D.弱电解质在溶液中部分电离,存在电离平衡;强电解质在水溶液中完全电离,不存在电离平衡 |
【知识点】 电解质、非电解质概念解读 强电解质与弱电解质解读
| A.c(H+) | B.溶液的导电能力 | C. | D.n(H+) |
【知识点】 弱电解质在水溶液中的电离平衡解读 浓度对电离平衡的影响解读
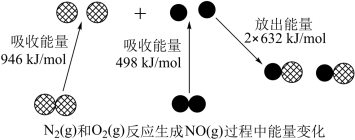
下列说法中正确的是( )
| A.2 mol O原子结合生成O2时需要放出的能量为498 kJ |
| B.28g N2(g)和32g O2(g)完全反应生成NO(g),放出的能量为180kJ |
| C.1 mol N2(g)和1 mol O2(g)具有的总能量大于2 mol NO(g)具有的总能量 |
| D.通常情况下,NO(g)比N2(g)稳定 |
| A.H+的物质的量 |
| B.醋酸的电离平衡常数 |
| C.中和时所需NaOH的量 |
| D.CH3COOH的物质的量 |
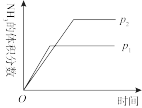
 ,下列研究目的和图示相符的是
,下列研究目的和图示相符的是 |  |  |  | |
| 研究 目的 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加 对反应的影响 对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
| A.A | B.B | C.C | D.D |
 的恒容密闭容器中充入
的恒容密闭容器中充入 和一定量的N,发生反应
和一定量的N,发生反应 ;当反应进行到
;当反应进行到 时达到平衡,测得M的浓度为
时达到平衡,测得M的浓度为 。下列说法正确的是( )
。下列说法正确的是( )A. 时,M的转化率为80% 时,M的转化率为80% |
B. ,用M表示的平均反应速率为 ,用M表示的平均反应速率为 |
C. 时,M的物质的量浓度为 时,M的物质的量浓度为 |
D.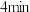 后,向容器中充入惰性气体,M的物质的量减小 后,向容器中充入惰性气体,M的物质的量减小 |
| A.反应2A(g)+B(g)=3C(s)+D(g)在一定条件下能自发进行,说明该反应的ΔH>0 |
| B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则ΔH<0 |
| C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)在一定条件下能自发进行,则该反应的ΔH>0 |
| D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的ΔH<0,ΔS>0 |
【知识点】 化学反应进行方向的判据 复合判据解读
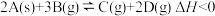 ,在一定条件下达到平衡状态,下列有关叙述正确的是( )
,在一定条件下达到平衡状态,下列有关叙述正确的是( )①增大物质A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,
 减小
减小③压强增大一倍,平衡不移动,
 、
、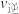 不变
不变④增大物质B的浓度,
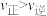
⑤加入催化剂,物质B的转化率提高
| A.①②⑤ | B.④ | C.②③④ | D.④⑤ |
 N2+3H2,达到平衡状态时,N2的物质的量分数为a%,维持容器的容积和温度不变,分别通入下列几组物质,达到平衡状态时,容器内N2的物质的量分数仍为a%的是
N2+3H2,达到平衡状态时,N2的物质的量分数为a%,维持容器的容积和温度不变,分别通入下列几组物质,达到平衡状态时,容器内N2的物质的量分数仍为a%的是| A.3 mol H2和1 mol NH3 |
| B.2 mol N2和3 mol H2 |
| C.1 mol N2和3 mol NH3 |
| D.0.1 mol NH3、0.95 mol N2、2.85 mol H2 |
| A.升高温度 | B.加少量烧碱溶液 | C.加CH3COONa固体 | D.加水. |
 CH3OCH3(g)+H2O(g) ΔH=-25kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中正确的是( )| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol·L-1 | 0.08 | 1.6 | 1.6 |
| A.此时刻反应未达到平衡状态 |
| B.容器内压强不变时,说明反应达平衡状态 |
| C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH体积分数减小 |
| D.平衡时,反应混合物的总能量降低40 kJ |
【知识点】 化学平衡状态的判断方法解读 化学平衡常数的有关计算解读
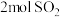 和
和 ,达到平衡后再向两容器中各充入
,达到平衡后再向两容器中各充入 。下列有关说法正确的是()
。下列有关说法正确的是()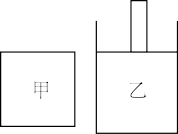
A.充入 前,甲、乙中 前,甲、乙中 含量相等 含量相等 |
B.充入 后,甲中平衡正向移动,乙中平衡逆向移动 后,甲中平衡正向移动,乙中平衡逆向移动 |
C.充入 后,甲中 后,甲中 含量不变,乙中 含量不变,乙中 含量减小 含量减小 |
D.充入 后,甲、乙两容器中平衡不移动 后,甲、乙两容器中平衡不移动 |
【知识点】 化学平衡的移动及其影响因素 压强对化学平衡移动的影响解读
 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是| A.若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1 |
| B.2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低 |
| C.若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol |
| D.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ |

| A.稍过量的氢氧化钠是确保盐酸完全反应 |
| B.仪器A的名称是玻璃棒 |
| C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
| D.用Ba(OH)2和硫酸代替盐酸和NaOH溶液进行反应,结果也是正确的 |
【知识点】 中和热概念解读 中和热的测定与误差分析解读
 CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。下列有关说法正确的是( )
| A.该反应的焓变和熵变:ΔH>0,ΔS<0 |
| B.温度降低,该反应的平衡常数K增大 |
| C.升高温度,n(CH3OH)/n(CO2)增大 |
| D.从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L·min) |
【知识点】 化学反应的速率 化学平衡常数 化学平衡题中基于图表数据的相关计算解读
| A.2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定 |
| C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O △H=-57.4kJ•mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2,则△H1<△H2 |
| 酸 | HX | HY | HZ |
| 电离常数K/(mol·L-1) | 9×10-7 | 9×10-6 | 1×10-2 |
| A.三种酸的强弱关系:HX>HY>HZ |
| B.反应HZ+Y-=HY+Z-能够发生 |
| C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸 |
| D.相同温度下,1mol·L-1 HX溶液的电离常数大于0.1mol·L-1 HX溶液的电离常数 |

| A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B.平衡状态由A变到B时,平衡常数K(A)<K(B) |
| C.上述反应在达到平衡后,增大压强,H2的转化率提高 |
| D.保持压强不变,通入惰性气体,平衡常数不变,平衡不移动 |
 CO2(g) + H2(g) ∆H = -41 kJ/mol。数据如下,下列说法
CO2(g) + H2(g) ∆H = -41 kJ/mol。数据如下,下列说法| 容器 | 甲 | 乙 | ||
| 反应物 | CO | H2O | CO | H2O |
| 起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
| 平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
| A.甲容器中,平衡时,反应放出的热量为16.4 kJ |
| B.T1时,反应的平衡常数K甲 = 1 |
| C.平衡时,乙中CO的浓度是甲中的2倍 |
| D.乙容器中,平衡时CO的转化率约为75% |
【知识点】 依据热化学方程式的计算解读 化学平衡常数 等效平衡理论的综合应用解读
| A.合成氨工业中选择高压条件,以提高氨的产率 |
| B.在硫酸工业中,SO2催化氧化成SO3的反应,往往加入过量的空气 |
C.将NO2球浸泡在冷水和热水中 |
D.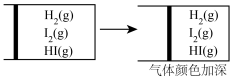 |
二、解答题 添加题型下试题
 O2(g)=CO2(g)+2H2O(g) △H=-a kJ/mol,则a
O2(g)=CO2(g)+2H2O(g) △H=-a kJ/mol,则a(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:
(3)mA(g)+nB(g)
 pC(g)+qD(g)在反应过程中的能量变化如图所示,回答下列问题。
pC(g)+qD(g)在反应过程中的能量变化如图所示,回答下列问题。
该反应△H=
(4)已知CO(g)+H2O(g)
 H2(g)+CO2(g)的平衡常数K随温度的变化如表:
H2(g)+CO2(g)的平衡常数K随温度的变化如表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
①该反应的△H
②已知在一定温度下,C(s)+CO2(g)
 2CO(g)的平衡常数为K1,C(s)+H2O(g)
2CO(g)的平衡常数为K1,C(s)+H2O(g) CO(g)+H2(g)的平衡常数为K2,则K、K1、K2之间的关系是
CO(g)+H2(g)的平衡常数为K2,则K、K1、K2之间的关系是③500℃时,若起始时c(CO)=2 mol•L-1,c(H2O)=2 mol•L-1,则平衡时CO的转化率为
三、填空题 添加题型下试题
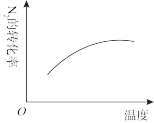
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。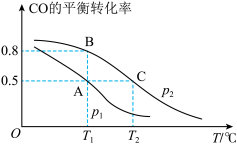
②A、B、C三点的平衡常数KA,KB,KC的大小关系是
③下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH消耗速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)
四、解答题 添加题型下试题
Ⅰ.NH3(g)+3Cl2(g)=NCl3(1)+3HCl(g) ΔH回答下列问题:
(1)已知:Ⅱ.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH1
Ⅲ.N2(g)+3Cl2(g)=2NCl3(1) ΔH2
则ΔH=
 用含ΔH1和ΔH2的代数式表示
用含ΔH1和ΔH2的代数式表示 。
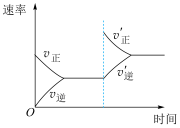
。(2)向容积均为2L的甲、乙两个恒温密闭容器中分别加入4molNH3和4molCl2,发生反应Ⅰ,测得两容器中n(Cl2)随反应时间的变化情况如表所示:
| 时间 | 0 | 40 | 80 | 120 | 160 |
| 容器甲(T1) | 4.0 | 3.0 | 2.0 | 1.6 | 1.6 |
| 容器乙(T2) | 4.0 | 2.9 | 2.0 | 2.0 | 2.0 |
①0—80min内,容器甲中v(NH3)=
②反应Ⅰ的ΔH
③关于反应Ⅰ,下列说法正确的是
 填选项字母
填选项字母 。
。A.容器内
 =
= ,说明反应达到平衡状态
,说明反应达到平衡状态B.容器内气体密度不变,说明反应达到平衡状态
C.达平衡后,加入一定量NCl3(l),平衡逆向移动
D.达平衡后,按原投料比再充入一定量反应物,平衡后NH3的转化率增大
④反应Ⅰ的平衡常数表达式K=
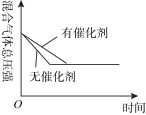
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为
(2)甲同学的实验目的是
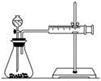
(3)乙同学在实验中应该测定的数据是
(4)乙同学完成该实验应选用的实验药品是
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水
试卷分析
试卷题型(共 24题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 电解质、非电解质概念 强电解质与弱电解质 | |
| 2 | 0.65 | 弱电解质在水溶液中的电离平衡 浓度对电离平衡的影响 | |
| 3 | 0.65 | 化学反应中能量变化的原因 化学键与化学反应中的能量关系 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 4 | 0.65 | 弱电解质的电离平衡 弱电解质在水溶液中的电离平衡 电离平衡常数及影响因素 浓度对电离平衡的影响 | |
| 5 | 0.85 | 外界条件对化学平衡影响的图像 与转化率变化有关图像的分析 与物质百分含量变化有关图像的分析 化学反应速率与化学平衡的综合应用 | |
| 6 | 0.85 | 化学反应速率计算 化学平衡的移动 转化率的相关计算及判断 化学平衡题中基于图表数据的相关计算 | |
| 7 | 0.65 | 化学反应进行方向的判据 复合判据 | |
| 8 | 0.65 | 化学平衡的移动 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 压强对化学平衡移动的影响 | |
| 9 | 0.65 | 等效平衡 等效平衡的建立 | |
| 10 | 0.85 | 浓度对电离平衡的影响 同离子效应对电离的影响 温度对电离平衡的影响 加入酸或碱对电离平衡的影响 | |
| 11 | 0.65 | 化学平衡状态的判断方法 化学平衡常数的有关计算 | |
| 12 | 0.65 | 化学平衡的移动及其影响因素 压强对化学平衡移动的影响 | |
| 13 | 0.65 | 化学平衡的移动及其影响因素 化学平衡的有关计算 等效平衡理论的综合应用 | |
| 14 | 0.65 | 中和热概念 中和热的测定与误差分析 | |
| 15 | 0.65 | 化学反应的速率 化学平衡常数 化学平衡题中基于图表数据的相关计算 | |
| 16 | 0.65 | 中和热概念 燃烧热概念 表示燃烧热的热化学方程式书写 反应热大小比较 | |
| 17 | 0.85 | 弱电解质的电离平衡 电离平衡常数及影响因素 弱电解质的电离平衡常数 | |
| 18 | 0.65 | 化学平衡的移动及其影响因素 可逆反应及反应限度 化学平衡常数的影响因素及应用 | |
| 19 | 0.65 | 依据热化学方程式的计算 化学平衡常数 等效平衡理论的综合应用 | |
| 20 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 勒夏特列原理的应用 合成氨条件的选择 | |
| 二、解答题 | |||
| 21 | 0.65 | 燃烧热 盖斯定律与热化学方程式 化学平衡常数的概念及表达方式 转化率的相关计算及判断 | 原理综合题 |
| 23 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | 原理综合题 |
| 24 | 0.65 | 影响化学反应速率的内因 浓度对化学反应速率的影响 催化剂对化学反应速率的影响 实验方案设计的基本要求 | 实验探究题 |
| 三、填空题 | |||
| 22 | 0.65 | 化学平衡状态的判断方法 浓度对化学平衡移动的影响 化学平衡常数的影响因素及应用 化学平衡常数的有关计算 | |