名校
解题方法
1 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下农是实验过程中的数据及相关信息:
(注:气体体积均在相同条件下测得)
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为_______ mL;实验②和③探究_______ 对反应速率的影响。
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,目的是_______ (用文字表达)。
(3)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是_______ ,后期速率慢慢减小的主要原因是_______ 。
Ⅱ.研究NOx、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(4)一定温度下,在恒容的密闭容器中充入lmolCO和2molH2,发生CO(g)+ 2H2(g) CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
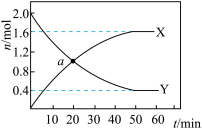
(5)利用反应2NO(g)+2CO(g) N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
①X代表的物质是_______ ;a点正反应速率_______ 逆反应速率(填“>”、“<”或“=”)。_______ 。
Ⅰ.某化学课外小组的同学通过铁和稀盐酸的反应探究外界条件对化学反应速率的影响,下农是实验过程中的数据及相关信息:
| 序号 | 反应温度/℃ | c(HCl)/(mol/L) | V(HCl)/mL | V(H2O)/mL | 10gFe的形状 | t/min |
| ① | 20 | 2 | 5 | V1 | 块状 | 1 |
| ② | 20 | 2 | 10 | 0 | 块状 | 1 |
| ③ | 20 | 2 | 10 | 0 | 粉末 | 1 |
| ④ | 40 | 2 | 10 | 0 | 块状 | 1 |
(1)实验①和②探究盐酸浓度对反应速率的影响,即V1为
(2)实验室在制氢气时,可在锌和盐酸反应的容器中加入少量硫酸铜固体,目的是
(3)分析其中一组实验,发现产生氢气的速率随时间的变化情况都是开始速率慢慢增大,后来慢慢减小。前期速率慢慢增大的主要原因是
Ⅱ.研究NOx、SO2、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(4)一定温度下,在恒容的密闭容器中充入lmolCO和2molH2,发生CO(g)+ 2H2(g)
 CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。
CH3OH(g),对于该反应,下列说法正确的是_______ (填序号)。| A.反应过程中n(CO)∶n(H2)不变 |
| B.(升高温度,正反应速率减小 |
| C.往容器中充入He,压强增大,反应速率加快 |
| D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡 |
(5)利用反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
N2(g)+2CO2(g)、可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。①X代表的物质是
您最近一年使用:0次
名校
解题方法
2 . 氮化铬(CrN)熔点高、硬度大,常用作耐磨材料。某小组在实验室用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬。已知:①CCl4的沸点是76.8℃;
②COCl2有毒,遇水生成HCl和CO2;③CrCl3易溶于水且易与水反应。
【实验一】制备无水氯化铬反应原理为: ,相关实验装置如下图(夹持装置略)。
,相关实验装置如下图(夹持装置略)。
a.水浴加热并维持A的温度在60~65℃
b.打开K,通入N2并保证锥形瓶中每分钟有250个左右的气泡逸出
c.点燃B处酒精喷灯,使瓷舟温度升至720℃左右,反应一定时间
d.一段时间后停止通入N2
e.先后停止加热A、B,冷却,并继续通入一段时间的N2
(1)上述操作步骤的先后顺序为:a→__________ 。
(2)A使用水浴加热的优点是_______ 。
(3)D中盛有过量NaOH溶液,用化学反应方程式说明D的作用:_______ 。
【实验二】制备氮化铬:其反应原理为 。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。
。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。_______ 。
(5)H中盛放碱石灰,其作用是_______ 。
(6)实验过程中需间歇性微热b处导管的目的是_______ 。(写出必要的化学方程式并解释)
②COCl2有毒,遇水生成HCl和CO2;③CrCl3易溶于水且易与水反应。
【实验一】制备无水氯化铬反应原理为:
 ,相关实验装置如下图(夹持装置略)。
,相关实验装置如下图(夹持装置略)。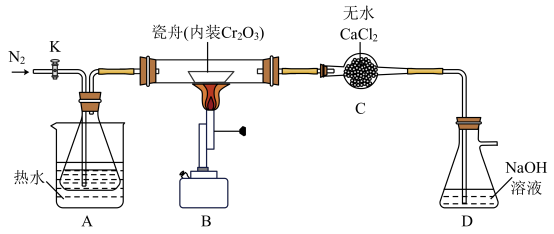
a.水浴加热并维持A的温度在60~65℃
b.打开K,通入N2并保证锥形瓶中每分钟有250个左右的气泡逸出
c.点燃B处酒精喷灯,使瓷舟温度升至720℃左右,反应一定时间
d.一段时间后停止通入N2
e.先后停止加热A、B,冷却,并继续通入一段时间的N2
(1)上述操作步骤的先后顺序为:a→
(2)A使用水浴加热的优点是
(3)D中盛有过量NaOH溶液,用化学反应方程式说明D的作用:
【实验二】制备氮化铬:其反应原理为
 。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。
。某校化学兴趣小组设计如下装置在实验室制备氮化铬(加热及夹持装置略)。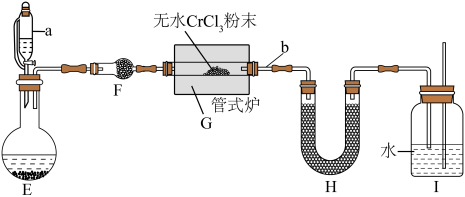
(5)H中盛放碱石灰,其作用是
(6)实验过程中需间歇性微热b处导管的目的是
您最近一年使用:0次
名校
解题方法
3 . 某探究活动小组根据侯德榜制碱原理,按下图所示实验装置设计方案制备少量碳酸氢钠。下列说法正确的是

| A.乙装置中盛放的是NaOH溶液 |
| B.丙装置中的溶液变浑浊,因为有碳酸氢钠的晶体析出 |
| C.丁转置是为了吸收丙装置可能逸出的CO2,防止污染空气 |
| D.实验结束后,分离碳酸氢钠的操作是蒸发结晶、过滤 |
您最近一年使用:0次
名校
解题方法
4 . 离子方程式是化学的专业用语,下列叙述对应的离子方程式书写正确的是
A.用强碱性溶液吸收二氧化氮;2NO2+2OH-=2 +H2O +H2O |
B.向硫化钠溶液通入足量二氧化硫:S2-+2SO2+2H2O=H2S+2 |
C.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合:Ba2++2OH-+2H++ =BaSO4↓+2H2O =BaSO4↓+2H2O |
D.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++ =3Fe3++2H2O+NO↑ =3Fe3++2H2O+NO↑ |
您最近一年使用:0次
名校
5 . 2018年第26届国际计最大会通过用阿伏加德罗常数来定义物质的量,NA为阿伏加德罗常数的值。下列说法正确的是
| A.6.4g铜与足量浓硝酸充分反应,生成的NO2在标况下体积约为4.48L |
| B.常温下,将2.7g铝片投入足量的浓硝酸中,铝失去的电子数为0.3NA |
| C.一定条件下,lmolN2与足量H2充分反应,生成的NH3分子数为2NA |
| D.常温下,将28g铁片投入足量的稀硝酸中,转移的电子数为1.5NA |
您最近一年使用:0次
名校
解题方法
6 . 十四届全国人大一次政府工作报告会议中提出:“推动发展方式绿色转型,持续打好蓝天、碧水、净土保卫战”。下列措施下不能实现绿色转型的是
| A.火力发电燃煤中加石灰石,减少温室气体排放 |
| B.大力开发地热能、氢能等新能源 |
| C.大力发展风力发电、水力发电、光伏发电、生物质能发电 |
| D.加大对林业、水电、特色生物等产业的扶持力度 |
您最近一年使用:0次
名校
解题方法
7 . 某高分子化合物M常用于制作眼镜镜片,可由N和P两种物质合成,M、N、P的结构如图所示,下列说法正确的是
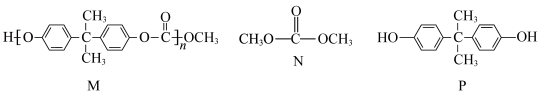
| A.N与P合成M的反应为加聚反应 | B.M的链节中在同一平面的碳原子最多有14个 |
| C.P在空气中很稳定,可以保存在广口瓶中 | D.常温下,M、N、P均易溶于水 |
您最近一年使用:0次
7日内更新
|
360次组卷
|
4卷引用:2024届山西省晋中市和诚高中高三下学期理综冲刺卷(二)-高中化学
名校
8 . 化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段反应速率最大___________ min(填“0~1”、“1~2”、“2~3”、“3~4”或“4~5”)。
②另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为___________ ,溶液中H+移向___________ (填“正”或“负”)极。
(2)某温度下在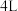 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:___________ mol/L,该反应的化学方程式是___________ 。
②5min时,Z的生成速率___________ (填“大于”、“小于”或“等于”)6min时Z的生成速率。
③若升高温度,则逆反应速率___________ (填“增大”、“减小”或“不变”)。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在
 稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 109 | 220 | 332 | 412 | 480 |
②另一位同学认为在盐酸中滴入少量的CuSO4溶液可以加快反应的速率,请从原电池的角度给予分析:构成的原电池中负极反应式为
(2)某温度下在
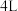 恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
恒容密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图所示:
②5min时,Z的生成速率
③若升高温度,则逆反应速率
您最近一年使用:0次
名校
9 . 下列说法正确的是
A. 既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物 既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物 |
B. 和NO都不是酸性氧化物 和NO都不是酸性氧化物 |
C. 是空气中的主要成分之一,雷雨时可直接转化为 是空气中的主要成分之一,雷雨时可直接转化为 |
| D.稀硝酸和锌反应产生的氢气可为工业制氨提供原料 |
您最近一年使用:0次
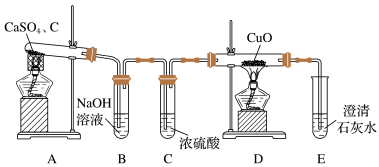
10 .  可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:
可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:
(1)甲同学设计如图所示的实验装置检验气体产物。___________ 。
②装置D中能证明产物中有 的实验现象为
的实验现象为___________ ,D中发生反应的化学方程式为___________ 。
(2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有 、
、 ,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。
,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。___________ (填字母)。
A、F、___________、___________、I、H、I、M
②能证明有 生成的实验现象是
生成的实验现象是___________ 。
③若 中混有
中混有 ,除上述试剂外,还可以将气体通入饱和
,除上述试剂外,还可以将气体通入饱和___________ (填化学式)溶液中,以除去 。
。
(3)经实验检验反应的气体产物有 、
、 、
、 且气体体积之比为
且气体体积之比为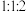 ,写出装置A中发生反应的化学方程式:
,写出装置A中发生反应的化学方程式:___________ 。
(4)利用重量法测定固体产物中各成分的质量之比。将少量固体产物溶于足量的饱和碳酸钠溶液中,再进行过滤、洗涤、干燥等操作,需要测定的物理量有固体产物的质量和生成___________ 沉淀的质量(填化学式)。[已知 与
与 反应生成
反应生成 和
和 ]
]
 可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:
可用于制备除虫剂、发光材料等。某课题小组拟用硫酸钙和焦炭在高温条件下反应制备硫化钙并检验气体产物。回答下列问题:(1)甲同学设计如图所示的实验装置检验气体产物。
②装置D中能证明产物中有
 的实验现象为
的实验现象为(2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有
 、
、 ,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。
,为了验证具体的气体产物,请结合上述装置并选择下列仪器设计实验方案(有些仪器可重复使用)。 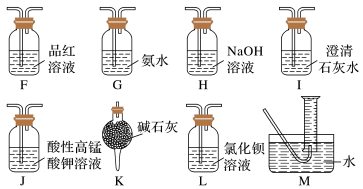
A、F、___________、___________、I、H、I、M
②能证明有
 生成的实验现象是
生成的实验现象是③若
 中混有
中混有 ,除上述试剂外,还可以将气体通入饱和
,除上述试剂外,还可以将气体通入饱和 。
。(3)经实验检验反应的气体产物有
 、
、 、
、 且气体体积之比为
且气体体积之比为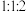 ,写出装置A中发生反应的化学方程式:
,写出装置A中发生反应的化学方程式:(4)利用重量法测定固体产物中各成分的质量之比。将少量固体产物溶于足量的饱和碳酸钠溶液中,再进行过滤、洗涤、干燥等操作,需要测定的物理量有固体产物的质量和生成
 与
与 反应生成
反应生成 和
和 ]
]
您最近一年使用:0次



