在催化剂作用下,逆水煤气变换体系中存在以下反应:
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1
CH3OH(g)+H2O(g);∆H1= ‒ 49.5 kJ∙mol-1;K1②CO2(g)+H2(g)
 CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2
CO(g)+H2O(g);∆H2= 41.2 kJ∙mol-1;K2③CO(g)+2H2(g)
 CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3
CH3OH(g);∆H3= ‒ 90.7 kJ∙mol-1;K3(1)K1=
Ⅱ.将6 mol CO2和8 mol H2充入容积为2L的密闭容器中,分别在T1、T2温度下发生反应①,H2的物质的量变化如表所示:
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5min | 10min | 15min | 20min | 25min | 30min | |
| H2 | 8.0 | 3.5 | 2.0 | 2.0 | 1.7 | 1.5 | 1.5 |
(2)T1温度下,5~10min内以CO2表示该反应速率v(CO2)=
A.> B.= C.<
(3)下列说法正确的是___________。
| A.T1 < T2 |
| B.混合气体的密度保持不变时,反应已达到平衡 |
| C.平衡后向容器中充入稀有气体,平衡不发生移动 |
| D.加入合适的催化剂可以降低反应的活化能,∆H减小 |
Ⅲ.一定条件下,将原料气n(CO2)∶n(H2)=1∶3进行投料,在恒容密闭容器中模拟上述三个反应,CO和CH3OH在含碳产物(CH3OH和CO)中物质的量分数及CO2的平衡转化率随温度变化的情况如图所示
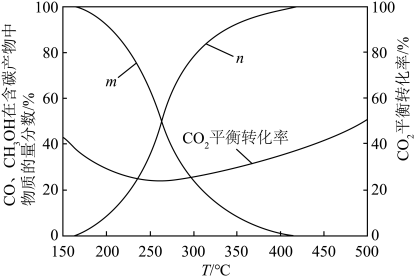
A.m B.n
(5)有利于提高CO2转化为CH3OH的平衡转化率的措施有___________。
| A.使用催化性能好的催化剂 | B.降低反应温度 |
| C.投料比不变,增加反应物的浓度 | D.增大CO2和H2的初始投料比 |
Ⅳ.光催化CO2也可以制备甲醇、甲烷等燃料,反应原理示意图如下图所示:
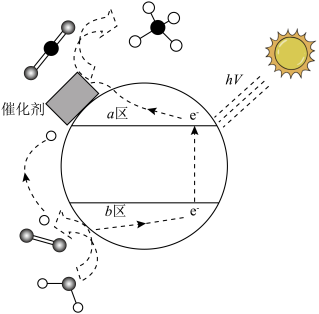
| A.H+由a区向b区移动 |
| B.b区电极反应为2H2O-4e-=O2↑+4H+ |
| C.CH4是氧化产物 |
| D.该装置实现了电能转化为化学能 |
(7)写出a区的电极反应式
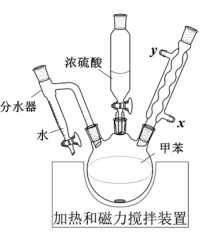
| A.当分水器中的水量不再增加时,停止加热 |
| B.分水器可将反应体系中的甲苯移除 |
| C.烧瓶中不需要添加沸石 |
| D.冷凝水从x口进入 |
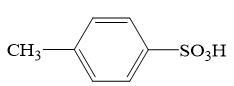
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式:
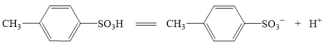 ,设计简单实验证明猜想。
,设计简单实验证明猜想。(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有
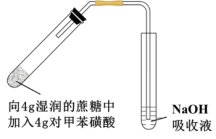
(5)向吸收液中滴加一定量
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率
 ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点
3 . Ⅰ.三蝶烯(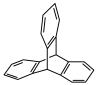 )及其衍生物是一类具有独特三维刚性结构的化合物,广泛应用在分子机器、材料化学以及超分子化学等领域。
)及其衍生物是一类具有独特三维刚性结构的化合物,广泛应用在分子机器、材料化学以及超分子化学等领域。
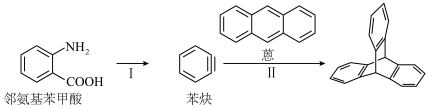
已知: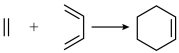
(2)预测三蝶烯的核磁共振氢谱中有___________组峰。
| A.1 | B.2 | C.3 | D.4 |
(3)下列关于邻氨基苯甲酸的说法正确的是___________。
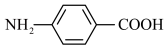
| A.红外光谱图显示分子中含有碳碳双键 |
| B.可形成分子内氢键 |
| C.沸点高于对氨基苯甲酸 |
| D.可发生加聚反应和缩聚反应 |
(4)步骤Ⅱ的反应类型为___________
| A.取代反应 | B.消去反应 | C.氧化反应 | D.加成反应 |
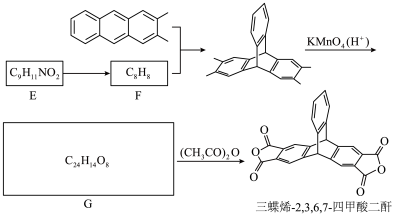
Ⅱ.三蝶烯-2,3,6,7-四甲酸二酐是三蝶烯的衍生物,其合成路线如下:
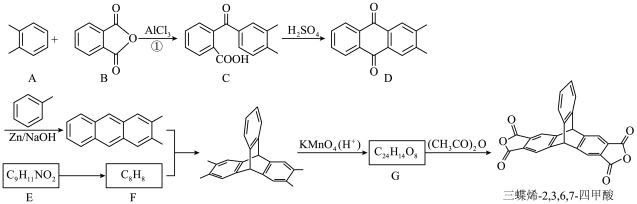
(5)A属于___________。
| A.脂肪烃 | B.芳香烃 | C.饱和烃 | D.苯的同系物 |
(6)C中含氧官能团的名称是
(7)写出C→D的化学方程式。
(8)化合物W是比化合物D少一个苯环的芳香族化合物,写出1种同时满足下列条件的W的同分异构体的结构简式。
① 仅含C、H、O元素,其中碳元素的质量分数为0.741,氢元素的质量分数为0.062;质谱图显示分子离子峰的m/z值为162。
② 能与FeCl3溶液发生显色反应,遇浓溴水不产生白色沉淀。
③ 核磁共振氢谱图中有4组峰,且峰面积之比为1∶1∶2∶6。
(9)将三蝶烯-2,3,6,7-四甲酸二酐的合成路线补充完整
(1)以下不能用元素周期律解释的是___________。
| A.键的极性:H−Se < H−Br | B.原子半径:Se > Br |
| C.稳定性:H2Se < HBr | D.酸性:H2SeO3 < HBrO4 |
(2)硒化铅可用作玻璃和陶瓷的着色剂,其晶胞结构如图所示:
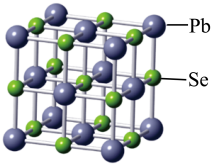
A.离子键 B.共价键
②晶体中每个Se周围与其最近的,且距离相等的Se有
Ⅱ.工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、Ag2Se等)回收Se。
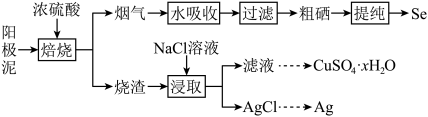
② 室温下Ksp(Ag2SO4)=10−5;Ksp(AgCl)=10−9.75。
(3)“焙烧”前,将阳极泥中大块颗粒粉碎的目的是
(4)“烟气”中含有SO2和SeO2,被水吸收发生反应,SO2与和SeO2的物质的量之比为
A.氧化性 B.还原性
(5)“提纯”步骤中用到真空蒸馏工艺,真空的作用是
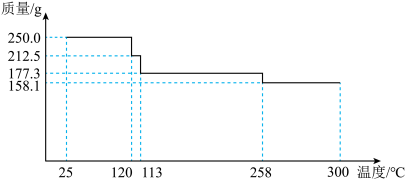
(6)小组同学测定某CuSO4∙xH2O晶体样品热分解的质量变化情况(如图所示),258℃失去全部结晶水,x=
Ⅲ.亚硒酸(H2SeO3)是主要的含硒化合物,是二元弱酸。常温下,H2SeO3溶液中某些微粒的物质的量分数与pH的关系如图所示:
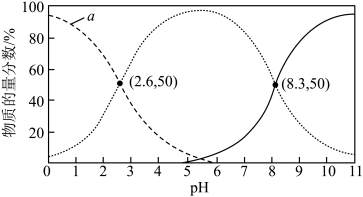
A.曲线a表示的是SeO 物质的量分数随pH变化 物质的量分数随pH变化 |
| B.Ka1=10−5.5 |
C.pH=3时, =100.4 =100.4 |
D.向H2SeO3溶液中逐滴加入NaOH溶液,pH=8.3时溶液中存在:2c(Na+)=3[c(HSeO )+ c(SeO )+ c(SeO )+ c(H2SeO3)] )+ c(H2SeO3)] |
(9)向滴有酚酞的H2SeO3溶液中加入氨水,当溶液由粉红色变为红色时,反应的离子方程式为
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
| A.范德华力 | B.氢键 | C.共价键 | D.离子键 |
①由N2H4+H2O
 N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是
②N2H4和N2O4作为火箭推进剂的主要原因是
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O当转移7.224×1024个电子数时,生成金属钴
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有
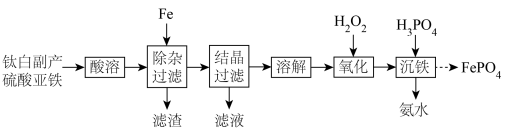
已知常温下:①“酸溶”后,溶液pH=2.3,有关微粒浓度如下表所示:
| 微粒 | TiO2+ | Mg2+ |
| 浓度/mol·L-1 | 0.0043 | 0.07 |
 H2TiO3+2H+,pH=4时,H2TiO3沉淀完全。
H2TiO3+2H+,pH=4时,H2TiO3沉淀完全。③Ksp[Mg(OH)2]=1.8×10-11。
(1)LiFePO4中,Li+的轨道表示式是
A.[Ar]3d6 B.[Ar]3d64s2 C.[Ar]3d5
(2)“除杂过滤”工序中,将TiO2+转化为H2TiO3除去。加入铁粉的作用是
(3)当H2TiO3沉淀完全时,滤渣中是否含有Mg(OH)2 ?结合计算说明原因
(4)“结晶过滤”获得FeSO4·7H2O的操作为
A.蒸发结晶、趁热过滤 B.蒸发浓缩、冷却结晶、过滤
(5)书写“氧化”时发生反应的离子方程式,并标出电子转移的方向和数目。
(6)工业上可以用电解磷铁渣(主要含FeP)的方法制备FePO4,电解原理如图所示:
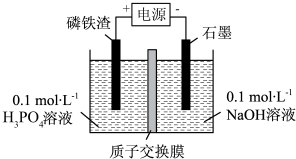
①溶液中的H+向
A.磷铁渣 B.石墨
②生成FePO4的电极反应式为
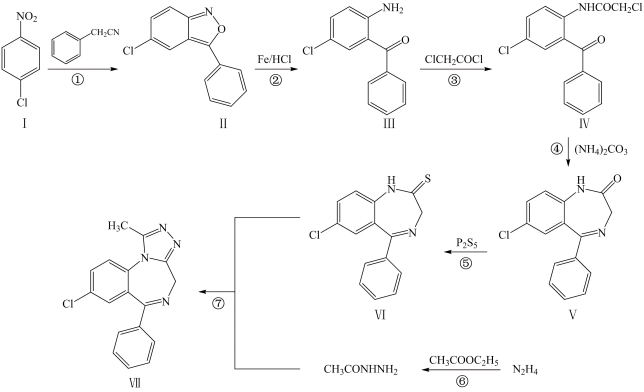
(1)由
 制取化合物I的反应条件是
制取化合物I的反应条件是(2)有关化合物Ⅱ的说法正确的是___________。
| A.分子中含有1个碳碳双键、1个碳氮双键 |
| B.碳原子均采取sp2杂化 |
| C.检验分子中存在氯原子的试剂是NaOH溶液、AgNO3溶液 |
| D.能发生加成反应、取代反应 |
(3)化合物Ⅲ与氢气完全加成,产物中的手性碳原子用“*”标出,其中正确的是___________。
A.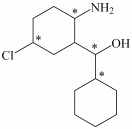 | B.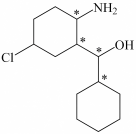 | C.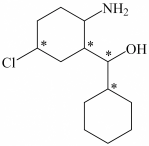 | D.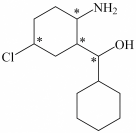 |
(4)化合物Ⅳ中含氧官能团的名称是
(5)步骤③的反应类型为___________。
| A.取代反应 | B.加成反应 | C.氧化反应 | D.消去反应 |
(6)写出步骤⑥的化学方程式
(7)化合物M是比化合物Ⅳ少一个苯环的芳香族化合物,写出1种同时满足下列条件的M同分异构体
a.含有
 结构
结构b.能发生银镜反应
c.苯环上的一溴代物有2种
d.核磁共振氢谱有5组峰,且峰面积之比为2:2:1:1:1
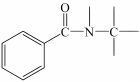
(8)将下列以苯胺
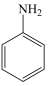 和肼(N2H4)为有机原料合成
和肼(N2H4)为有机原料合成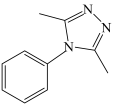 的合成路线补充完整(其他试剂任选)
的合成路线补充完整(其他试剂任选)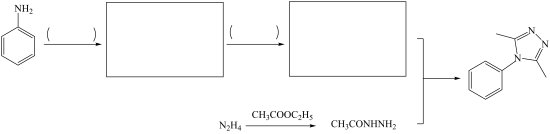

(1)砷元素在周期表中的位置是
(2)沸点:AsH3
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
| A.I中仅有σ键 | B.Ⅱ中部分元素的第一电离能: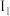 (O)> (O)> (S) (S) |
| C.Ⅲ中含有的元素中砷的电负性最大 | D.Ⅳ中含有的化学键为离子键、共价键 |
(4)已知H3AsO3为三元弱酸,则分子中As原子存在
 的空间构型为
的空间构型为A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4
 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。
该晶胞中含有
I.探究不同条件下84消毒液的漂白效果
(1)84消毒液的有效成分是次氯酸钠,次氯酸钠溶液呈
A.酸性 B.中性 C.碱性
(2)在3只编号分别为甲、乙、丙的烧杯中进行如下操作:
| 编号 | 84消毒液 | 蒸馏水 | 白醋 | 品红溶液 | 相同时间的现象 |
| 甲 | 2 mL | 20 mL | / | 5滴 | 无明显现象 |
| 乙 | 2 mL | 19 mL | 1 mL | 5滴 | 红色变浅 |
| 丙 | a mL | b mL | 2 mL | 5滴 | 红色迅速褪去 |
A.a=2,b=18 B.a=2,b=19 C.a=2,b=20
②由实验现象可得出的结论是
(3)将84消毒液按一定比例稀释,并将稀释液放置在空气中一段时间。在此过程中测定溶液的氧化还原电势变化如图所示。(已知:氧化还原电势越大,氧化性越强。)
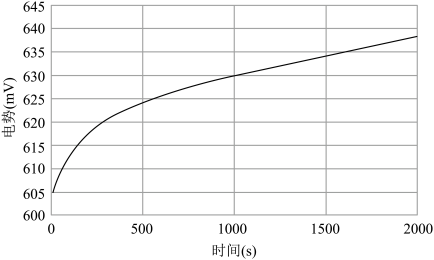
解释曲线变化的原因
II.某学习小组以Cl2O为原料制备HClO。
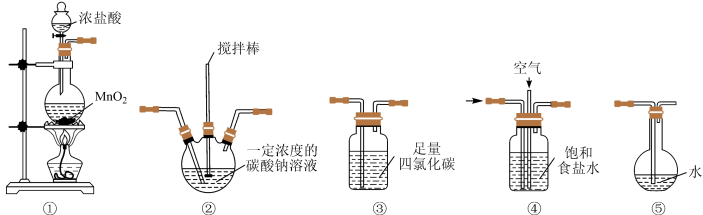
i.常温常压下Cl2O是一种黄绿色气体。
ii.将氯气和空气(不参与反应)通入足量的Na2CO3溶液,发生反应生成Cl2O。
iii.Cl2O易溶于水并与水立即反应生成HClO。
iv.已知:HClO+2I-+H+=I2+Cl-+H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。(4)各装置的连接顺序为①→
A.②④③⑤ B.④②③⑤ C.④③②⑤
(5)装置②中发生的化学反应中氧化产物与还原产物的物质的量之比为
A.1:1 B.2:1 C.1:2
(6)Cl2O不会被装置③吸收的原因是
(7)装置④的作用有:吸收Cl2中的HCl、___________。
| A.防倒吸 | B.吸收Cl2O |
| C.将空气、氯气混合均匀 | D.通过观察气泡调节气体流速 |
(8)测定HClO的物质的量浓度:量取10.00 mL样品稀释至100.00 mL,取出10.00 mL于锥形瓶中,加入足量KI溶液,滴加几滴淀粉溶液,用0.08 mol·L-1标准Na2S2O3溶液滴定,当
10 . 油气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。
I.已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ∆H1
②4H2S(g)+2SO2(g)=3S2(g)+4H2O(g) ∆H2
③2H2(g)+O2(g)=2H2O(g) ∆H3
④2H2S(g)=S2(g)+2H2(g) ∆H4
(1)∆H4=
(2)已知∆H4>0,
A.低温 B.高温
(3)处理H2S普遍采用的方法是克劳斯工艺,即利用反应①和②生成S2;另一种方法是利用反应④分解H2S。相比克劳斯工艺,分解法的优点是
II.在1373K、100 kPa下,分别将n(H2S):n(Ar)为4:1、1:1、1:4、1:9的H2S-Ar混合气体置于密闭容器中发生反应④,反应过程中H2S转化率随时间的变化如下图所示:
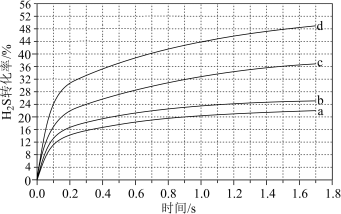
(4)n(H2S):n(Ar)=1:9对应图中曲线
A.a B.b C.c D.d
(5)n(H2S):n(Ar)=1:4的混合气体投料后,若将温度升高至1473K,达到平衡时混合气体中H2S与H2的分压相等,H2S平衡转化率为
III.在真空克劳斯法脱硫中,用K2CO3溶液吸收H2S。
电离平衡常数 | H2CO3 | H2S |
K1 | 4.2×10-7 | 5.6×10-8 |
K2 | 5.6×10-11 | 1.2×10-15 |
(6)下列关于K2CO3溶液中微粒关系正确的是___________。
A.c(OH-)>c(HCO ) ) | B.c(H+)>c(HCO ) ) |
C.c(OH-)=c(H+)+c(HCO )+2c(H2CO3) )+2c(H2CO3) | D.2c(K+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
(7)K2CO3溶液吸收少量H2S的离子方程式为



