名校
解题方法
1 . 下列关于实验装置的叙述正确的是
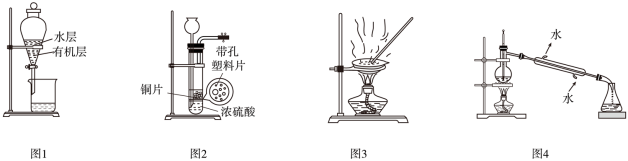

| A.图1:用CCl4萃取碘水中的碘,后分液 | B.图2:制取少量SO2 |
| C.图3:将干海带灼烧成灰 | D.图4:海水淡化 |
您最近一年使用:0次
2 . 化学与生产、生活息息相关。下列说法正确的是
| A.棉花、麻和蚕丝均为碳水化合物 |
| B.橡胶硫化的过程中发生了化学反应 |
| C.绿色化学的核心思想是“先污染后治理” |
| D.漂白粉与盐酸可混合使用以提高消毒效果 |
您最近一年使用:0次
名校
解题方法
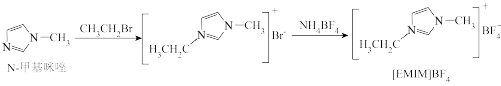
3 . 离子液体是在室温附近温度下呈液态的盐类物质,一般由有机阳离子和无机阴离子组成。直到1992年,威尔克斯(J.Wilkes)以无色液体N-甲基咪唑为原料,合成了稳定性强、抗水解的[ EMIM]BF4离子液体后,对离子液体的研究才真正广泛开展起来,[EMIM]BF4离子液体合成路线如下。
(1)已知:电负性B<H。组成[ EMIM]BF4的元素,电负性由小到大的顺序是_______ 。
(2)离子液体[ EMIM]BF4阴离子的空间构型为_______ ,基态F原子的核外电子空间运动状态有_______ 种。
(3)离子液体在室温下为液体的主要原因是_______ 。
(4)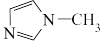 中,N原子和C原子全部位于同-平面,其中的大π键符号为
中,N原子和C原子全部位于同-平面,其中的大π键符号为_______ ,分子中的大π键可用符号π 表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π
表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π 。
。
(5) 是
是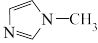 的同系物,室温为白色固体,为平面型分子。熔点比较:
的同系物,室温为白色固体,为平面型分子。熔点比较: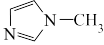
_______  (填>、<或=) ,原因是
(填>、<或=) ,原因是_______ 。
(6)下列说法正确的是_______( 填字母)
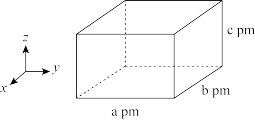
(7)[ EMIM]BF4晶胞结构如图所示,晶胞参数为a pm,b pm,c pm以及90°,90° ,90°。已知其晶胞中有8个N原子,以M表示[ EMIM]BF4的相对分子质量,NA表示阿伏加德罗常数的值,晶体的密度为_______ g/cm-3。

(1)已知:电负性B<H。组成[ EMIM]BF4的元素,电负性由小到大的顺序是
(2)离子液体[ EMIM]BF4阴离子的空间构型为
(3)离子液体在室温下为液体的主要原因是
(4)
 中,N原子和C原子全部位于同-平面,其中的大π键符号为
中,N原子和C原子全部位于同-平面,其中的大π键符号为 表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π
表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π 。
。(5)
 是
是 的同系物,室温为白色固体,为平面型分子。熔点比较:
的同系物,室温为白色固体,为平面型分子。熔点比较:
 (填>、<或=) ,原因是
(填>、<或=) ,原因是(6)下列说法正确的是_______( 填字母)
A.1mol 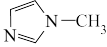 有12molσ键 有12molσ键 |
| B.[EMIM]BF4的的合成路线中所有反应物C原子的杂化形式保持不变,且均为sp3杂化 |
| C.[EMIM] BF4的合成路线中所有反应物N原子的杂化形式保持不变 |
| D.[EMIM] BF4晶体中存在共价键、离子键、范德华力和氢键等相互作用力 |

您最近一年使用:0次
2022-07-01更新
|
171次组卷
|
2卷引用:广西四市玉林市普通高中2022届高三下学期4月教学质量监测考试理科综合化学试题
4 . 下图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题:
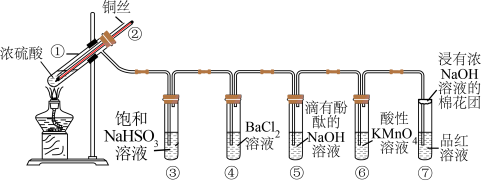
(1)试管①中发生反应的化学方程式为_______ ;其中硫酸发生了_______ (填“氧化”或“还原”)反应。
(2)一段时间后,④中溶液无明显现象,⑤、⑥、⑦中溶液均褪色,试管⑤、⑥、⑦中的现象分别说明 的水溶液具有
的水溶液具有_______ 、 具有
具有_______ 、 具有漂白性。
具有漂白性。
(3)下列说法正确的是_______ (填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,将温度计取出,插入导管,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认试管①中产物有 ,可立刻向试管①中加水,观察颜色
,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中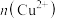 变大的是
变大的是_______ (填字母)。
a.HCl b. c.
c.
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为_______ 。

(1)试管①中发生反应的化学方程式为
(2)一段时间后,④中溶液无明显现象,⑤、⑥、⑦中溶液均褪色,试管⑤、⑥、⑦中的现象分别说明
 的水溶液具有
的水溶液具有 具有
具有 具有漂白性。
具有漂白性。(3)下列说法正确的是
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,将温度计取出,插入导管,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认试管①中产物有
 ,可立刻向试管①中加水,观察颜色
,可立刻向试管①中加水,观察颜色(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中
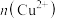 变大的是
变大的是a.HCl b.
 c.
c.
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为
您最近一年使用:0次
5 . 下列关于钠的叙述正确的是
| A.钠与水反应的现象说明钠的熔点低,且与水反应放出热量 |
| B.将4.6g钠投入95.4g水中,所得溶液中溶质的质量分数为8% |
C.钠放置在空气中表面变暗是由于钠的表面生成了 |
| D.钠与硫酸铜溶液反应生成硫酸钠和单质铜 |
您最近一年使用:0次
6 . 2022年4月16日,“神舟十三号”载人飞船成功返回地球。飞船中使用了大量合金,下列有关金属或合金的说法中错误的是
| A.一般合金的熔点比其成分金属的高 |
| B.硬铝是一种铝合金 |
| C.钢是用量最大,用途最广的合金 |
| D.合金的物理性质与其成分金属的物理性质不同 |
您最近一年使用:0次
解题方法
7 . 下列有关实验操作或说法正确的是
A.配制125mL 的氯化钠溶液需要用到130mL的容量瓶 的氯化钠溶液需要用到130mL的容量瓶 |
| B.探究碳酸钠和碳酸氢钠热稳定性实验中应把碳酸氢钠放在内部小试管中 |
| C.制备氢氧化铁胶体的实验中应将氯化铁溶液加入到温水中,继续煮沸至红褐色即可 |
| D.干燥的氯气使湿润的鲜花变色,干燥的氯气具有漂白性 |
您最近一年使用:0次
名校
解题方法
8 . 熔融的金属锡(熔点231℃)在300℃左右能直接与氯气作用生成无水四氯化锡:Sn+2Cl2 SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
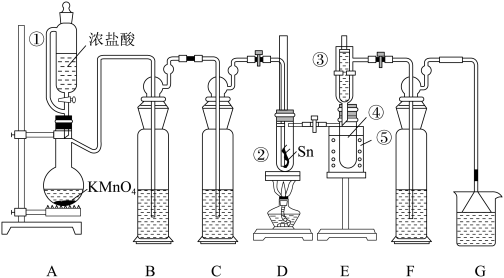
回答下列问题:
(1)装置A中烧瓶内反应的离子方程式为____ ;仪器①中导管的作用是___ 。
(2)B、C、F、G盛装的试剂应依次选用下列中的____ (填标号)。
a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是____ ;生成的SnCl4经冷凝后,收集于E装置的试管④中,该液体常常呈黄绿色,原因是___ 。
(4)用玻璃棒蘸取少量产物SnCl4,放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和____ (填化学式)。
(5)0.500gSn完全反应,制得SnCl41.03g,产率为____ 。
 SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
回答下列问题:
(1)装置A中烧瓶内反应的离子方程式为
(2)B、C、F、G盛装的试剂应依次选用下列中的
a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是
(4)用玻璃棒蘸取少量产物SnCl4,放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和
(5)0.500gSn完全反应,制得SnCl41.03g,产率为
您最近一年使用:0次
2022-06-25更新
|
278次组卷
|
4卷引用:广西钦州市第四中学2022-2023学年高二上学期11月考试化学试题
解题方法
9 . 固体化合物X由4种元素组成,某学习小组进行如下实验。

(1)组成X的金属元素为_______ (填元素符号)。
(2)溶液D呈碱性的原因_______ (用离子方程解释)。
(3)由X转化为A和B的化学反应方程式为_______ 。
(4)根据上述实验,判断上述溶液中出现的阴离子结合氢离子的能力由大到小的顺序是_______ 。

(1)组成X的金属元素为
(2)溶液D呈碱性的原因
(3)由X转化为A和B的化学反应方程式为
(4)根据上述实验,判断上述溶液中出现的阴离子结合氢离子的能力由大到小的顺序是
您最近一年使用:0次
2022-06-25更新
|
240次组卷
|
2卷引用:广西钦州市第四中学2022-2023学年高二上学期11月考试化学试题
10 . 下列说法正确的是
| A.工业制备高纯硅涉及的主要反应均为氧化还原反应 |
| B.用浓硫酸在纸上书写的字迹变黑表现了浓硫酸的强氧化性 |
| C.氨的催化氧化是工业制硝酸的基础,属于氮的固定 |
D. 与 与 反应生成 反应生成 和 和 可以证明 可以证明 是酸性氧化物 是酸性氧化物 |
您最近一年使用:0次
2022-06-25更新
|
131次组卷
|
2卷引用:广西钦州市第四中学2022-2023学年高一下学期2月考试化学试题



