名校
解题方法
1 . 脱除天然气中的 用于生产硫磺或氢气,不仅能够有效地减少
用于生产硫磺或氢气,不仅能够有效地减少 的危害,还可回收宝贵的物资。回答下列问题:
的危害,还可回收宝贵的物资。回答下列问题:
(1)一种脱除硫化氢的燃料电池工作原理如图(Ⅰ)所示,该电池工作时,负极的电极反应式为_______ 。

(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图(Ⅱ)所示。
并再生的原理如图(Ⅱ)所示。 溶液脱除
溶液脱除 的离子方程式为
的离子方程式为_______ ;吸收液过滤后,滤液需进行再生,较经济的再生方法是通入气体 ,则
,则 是
是_______ ;

(3) 在高温下分解生成硫蒸气和
在高温下分解生成硫蒸气和 :
:
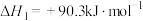 ,不同体系中的
,不同体系中的 (维持总压强均为
(维持总压强均为 )的平衡转化率如图(Ⅲ),四种反应体系的
)的平衡转化率如图(Ⅲ),四种反应体系的 平衡产率如图(Ⅳ)所示:
平衡产率如图(Ⅳ)所示:

①为提高反应 中
中 的平衡转化率可采用
的平衡转化率可采用_______ (填标号)。
A.高温低压 B.低温高压 C.高温高压
②“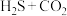 ”体系中
”体系中 的平衡转化率始终比单纯“
的平衡转化率始终比单纯“ ”的大,这是因为
”的大,这是因为_______ ;“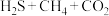 ”[如图(Ⅳ)]
”[如图(Ⅳ)] 的产率最大,其主要原因可能是
的产率最大,其主要原因可能是_______ ;(已知反应① ;反应②
;反应②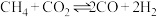 )。
)。
③在单独“ ”体系中,某温度时,
”体系中,某温度时, 的平衡分压为
的平衡分压为 ,则
,则 的平衡转化率为
的平衡转化率为_______ %(保留一位小数)。
 用于生产硫磺或氢气,不仅能够有效地减少
用于生产硫磺或氢气,不仅能够有效地减少 的危害,还可回收宝贵的物资。回答下列问题:
的危害,还可回收宝贵的物资。回答下列问题:(1)一种脱除硫化氢的燃料电池工作原理如图(Ⅰ)所示,该电池工作时,负极的电极反应式为

(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图(Ⅱ)所示。
并再生的原理如图(Ⅱ)所示。 溶液脱除
溶液脱除 的离子方程式为
的离子方程式为 ,则
,则 是
是
(3)
 在高温下分解生成硫蒸气和
在高温下分解生成硫蒸气和 :
:
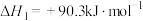 ,不同体系中的
,不同体系中的 (维持总压强均为
(维持总压强均为 )的平衡转化率如图(Ⅲ),四种反应体系的
)的平衡转化率如图(Ⅲ),四种反应体系的 平衡产率如图(Ⅳ)所示:
平衡产率如图(Ⅳ)所示:
①为提高反应
 中
中 的平衡转化率可采用
的平衡转化率可采用A.高温低压 B.低温高压 C.高温高压
②“
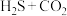 ”体系中
”体系中 的平衡转化率始终比单纯“
的平衡转化率始终比单纯“ ”的大,这是因为
”的大,这是因为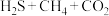 ”[如图(Ⅳ)]
”[如图(Ⅳ)] 的产率最大,其主要原因可能是
的产率最大,其主要原因可能是 ;反应②
;反应②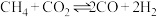 )。
)。③在单独“
 ”体系中,某温度时,
”体系中,某温度时, 的平衡分压为
的平衡分压为 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2 . 汽车尾气NO、CO的净化处理与达标排放是当前环保工作的研究热点之一。回答下列问题:
(1)汽车尾气的处理: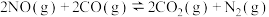 ,该反应的反应历程及反应物和生成物的相对能量如图所示:
,该反应的反应历程及反应物和生成物的相对能量如图所示:
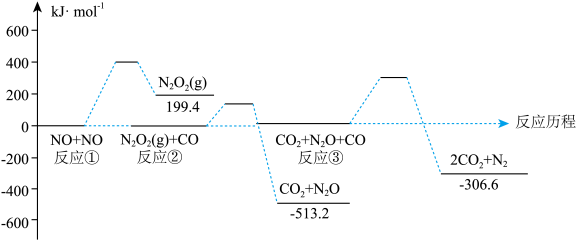
①反应______ (填“①”“②”或“③”)是该反应的决速步骤,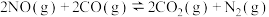

______ 。
②反应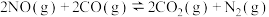 的净反应速率
的净反应速率
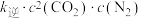 ,其中
,其中 、
、 分别为正、逆反应的速率常数(只与温度有关)。若改变温度后
分别为正、逆反应的速率常数(只与温度有关)。若改变温度后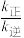 增大,则改变温度的方式是
增大,则改变温度的方式是_________ 。
(2)向某密闭容器中通入2 mol NO、2 mol CO,控制适当条件使其发生反应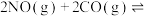
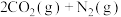 ,测得不同温度(℃)、不同压强(kPa)下NO的平衡转化率如图1所示;
,测得不同温度(℃)、不同压强(kPa)下NO的平衡转化率如图1所示;
相同压强时,不同催化剂(甲、乙)、不同温度下,相同时间内NO的转化率如图2所示。
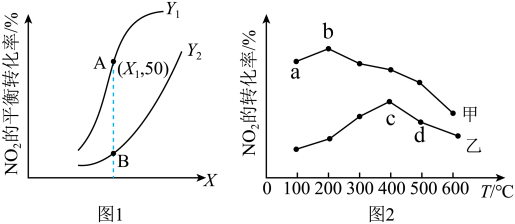
①图1中X表示______ (填“温度”或“压强”),
______ (填“>”或“<”) 。
。
②图2中a、b、c、d四点所对应的状态中一定未达平衡状态的有______ (填字母),曲线cd变化趋势的原因是____________ 。
③恒压时,工业生产中该反应合适的生产条件是____________ ,图1中A点温度下平衡常数
______  (用
(用 或
或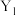 表示)。
表示)。
(1)汽车尾气的处理:
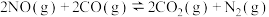 ,该反应的反应历程及反应物和生成物的相对能量如图所示:
,该反应的反应历程及反应物和生成物的相对能量如图所示:
①反应
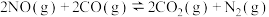

②反应
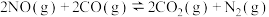 的净反应速率
的净反应速率
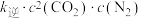 ,其中
,其中 、
、 分别为正、逆反应的速率常数(只与温度有关)。若改变温度后
分别为正、逆反应的速率常数(只与温度有关)。若改变温度后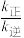 增大,则改变温度的方式是
增大,则改变温度的方式是(2)向某密闭容器中通入2 mol NO、2 mol CO,控制适当条件使其发生反应
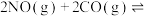
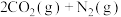 ,测得不同温度(℃)、不同压强(kPa)下NO的平衡转化率如图1所示;
,测得不同温度(℃)、不同压强(kPa)下NO的平衡转化率如图1所示;相同压强时,不同催化剂(甲、乙)、不同温度下,相同时间内NO的转化率如图2所示。

①图1中X表示

 。
。②图2中a、b、c、d四点所对应的状态中一定未达平衡状态的有
③恒压时,工业生产中该反应合适的生产条件是

 (用
(用 或
或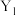 表示)。
表示)。
您最近一年使用:0次
解题方法
3 . 钴(Co)是生产电池材料、高温合金、磁性材料及催化剂的重要原料。以一种含钴废料(主要含有Co、Fe、Pb、CuO、 等)为原料制备
等)为原料制备 的工艺流程如图所示:
的工艺流程如图所示:

已知:常温下,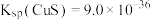 ,
, 。
。
回答下列问题:
(1)滤渣1的成分是______ (填化学式),该物质均匀涂到Pb和 上,分别与直流电源两极相连,以硫酸溶液作电解质溶液进行电解,可以制备铅酸电池的两极。其中制备阳极的电极反应式为
上,分别与直流电源两极相连,以硫酸溶液作电解质溶液进行电解,可以制备铅酸电池的两极。其中制备阳极的电极反应式为____________ 。
(2)在“浸取”过程中,使用稀硫酸,未加热和搅拌,也没有进一步研碎含钴废料,但反应速率仍然较快,原因可能是____________ 。
(3)“沉铁”过程中,NaOH的作用是____________ 。
(4)“除铜”过程中,发生反应的离子方程式为____________ ,常温下,该反应的平衡常数
______ 。
(5)操作③与操作④能否对调______ (填“能”或“否”),理由是____________ 。
 等)为原料制备
等)为原料制备 的工艺流程如图所示:
的工艺流程如图所示:
已知:常温下,
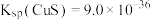 ,
, 。
。回答下列问题:
(1)滤渣1的成分是
 上,分别与直流电源两极相连,以硫酸溶液作电解质溶液进行电解,可以制备铅酸电池的两极。其中制备阳极的电极反应式为
上,分别与直流电源两极相连,以硫酸溶液作电解质溶液进行电解,可以制备铅酸电池的两极。其中制备阳极的电极反应式为(2)在“浸取”过程中,使用稀硫酸,未加热和搅拌,也没有进一步研碎含钴废料,但反应速率仍然较快,原因可能是
(3)“沉铁”过程中,NaOH的作用是
(4)“除铜”过程中,发生反应的离子方程式为

(5)操作③与操作④能否对调
您最近一年使用:0次
名校
4 . 甲烷和甲醇(CH3OH)既是重要的化工原料,又是未来重要的能源物质。
(1)该反应为 ,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量
,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量___________ (填“>”、“<”或“=”)1molCH3OH(g)的能量。

(2)在容积为1L的恒容密闭容器中投入等物质的量的CO2(g)和H2(g),进行反应: 。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:
。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:

图中,表示正反应速率与逆反应速率相等的点是___________ (填“a”、“b”、“c”或“d”)。用同一物质表示反应速率时,a、c两点的正反应速率:υa___________ υc (填“>”、“<”或“=”,下同),该反应达到平衡时,CO2的转化率___________ 50%。
(3)将2.0molCH4(g)和3.0molH2O(g)通入容积为2L的恒容密闭容器中,恒温条件下发生反应: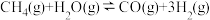 。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=
。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=___________ 。下列描述中能说明该反应已达平衡状态的是___________ (填标号)。
a. 断裂3mol H−H键时,生成2mol H−O键 b. 容器内混合气体的平均摩尔质量保持不变
c. 容器内混合气体的压强保持不变 d. 容器内CO与H2的体积之比保持不变
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如图所示:

①外电路电子移动方向:___________ (填“a→b”或“b→a”)。
②a电极的电极方程式为___________ 。
③标准状况下消耗5.6LO2,外电路中通过导线的电子的数目为___________ 。
(1)该反应为
 ,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量
,反应过程中能量变化如图所示。则1molCO(g)和2molH2(g)的总能量
(2)在容积为1L的恒容密闭容器中投入等物质的量的CO2(g)和H2(g),进行反应:
 。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:
。CO2(g)、CH3OH(g)的物质的量随时间变化关系如图所示:
图中,表示正反应速率与逆反应速率相等的点是
(3)将2.0molCH4(g)和3.0molH2O(g)通入容积为2L的恒容密闭容器中,恒温条件下发生反应:
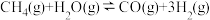 。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=
。测得在10min时反应达到平衡,此时CH4的物质的量为1.6mol,则0~10min内,用CO表示该反应的平均反应速率υ(CO)=a. 断裂3mol H−H键时,生成2mol H−O键 b. 容器内混合气体的平均摩尔质量保持不变
c. 容器内混合气体的压强保持不变 d. 容器内CO与H2的体积之比保持不变
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为电解质,其工作原理如图所示:

①外电路电子移动方向:
②a电极的电极方程式为
③标准状况下消耗5.6LO2,外电路中通过导线的电子的数目为
您最近一年使用:0次
名校
解题方法
5 . 海洋资源的利用具有广阔前景。
(1)从海水制得的粗盐含有Ca2+、Mg2+、 等杂质离子,正确的除杂操作顺序为___________
等杂质离子,正确的除杂操作顺序为___________
①加入稍过量的BaCl2溶液;②加入稍过量的Na2CO3溶液;③加入适量的稀盐酸;④加入稍过量的NaOH溶液;⑤过滤。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入Cl2,将Br-氧化,该反应的离子方程式是______ 。
(3)下图是从海水中提取镁的简单流程。
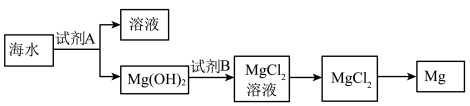
①工业上常用于沉淀Mg2+ 的试剂A是___________ 。
②由无水MgCl2制取Mg的化学方程式是___________ 。
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
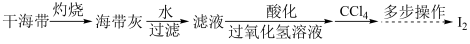
①灼烧海带时所用的主要仪器名称是___________ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:___________ 。
(1)从海水制得的粗盐含有Ca2+、Mg2+、
 等杂质离子,正确的除杂操作顺序为___________
等杂质离子,正确的除杂操作顺序为___________①加入稍过量的BaCl2溶液;②加入稍过量的Na2CO3溶液;③加入适量的稀盐酸;④加入稍过量的NaOH溶液;⑤过滤。
| A.④①②③⑤ | B.②①④⑤③ | C.①②⑤③④ | D.①④②⑤③ |
(3)下图是从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+ 的试剂A是
②由无水MgCl2制取Mg的化学方程式是
(4)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
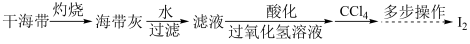
①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式:
您最近一年使用:0次
6 . CO一直是化学家研究的热点载体,也是一种重要的化工产品。回答下列问题:
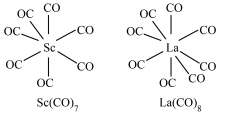
(1)我国科学家发现七配位金属羰基化合物 和八配位金属羰基化合物
和八配位金属羰基化合物 (TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是
(TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是___________ , 含
含___________  键。
键。
(2)工业上用CO合成 :
:
 。
。
①该反应在较低温度下能自发进行,推测该反应是___________ (填标号)
A.熵增、焓减反应 C.熵减、焓增反应
B.熵增、焓增反应 D.熵减、焓减反应
②一定温度下,向一恒容密闭容器中充入1molCO和 ,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是
,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是___________ (填标号)。
A.混合气体密度不随时间变化
B.混合气体中CO的体积分数不随时间变化
C.混合气体总压强不随时间变化
D. 的正反应速率等于
的正反应速率等于 的逆反应速率的3倍
的逆反应速率的3倍
(3)工业上常用天然气制备CO,原理如下:
①

②

则

___________ 。(用含 、
、 的代数式表示)
的代数式表示)
(4)光气 (COCl2)是一种有机中间体,常用于合成杀虫剂、黏合剂。CO合成光气的原理是
 。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和
。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和 ,在不同条件下发生上述反应,测得
,在不同条件下发生上述反应,测得 与时间关系如图所示。
与时间关系如图所示。
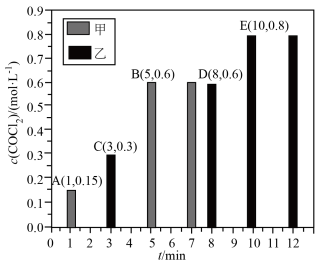
①相对甲,乙仅改变一个条件,可能是___________ (填标号)。
a.减小压强 b.加催化剂 c.降低温度
②若在恒容条件下反应,前10min内乙容器中CO的平均反应速率为___________  。甲容器中CO的平衡转化率为
。甲容器中CO的平衡转化率为___________ 。乙容器中平衡常数K为___________  。
。
(1)我国科学家发现七配位金属羰基化合物
 和八配位金属羰基化合物
和八配位金属羰基化合物 (TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是
(TM=Y、La),为设计具有独特性质的化合物提供了新思路。它们的结构如图所示,CO作配体,配位原子为C,而不是O,其原因是 含
含 键。
键。
(2)工业上用CO合成
 :
:
 。
。①该反应在较低温度下能自发进行,推测该反应是
A.熵增、焓减反应 C.熵减、焓增反应
B.熵增、焓增反应 D.熵减、焓减反应
②一定温度下,向一恒容密闭容器中充入1molCO和
 ,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是
,下列情况表明净反应速率(净反应速率等于正、逆反应速率之差)一定等于0的是A.混合气体密度不随时间变化
B.混合气体中CO的体积分数不随时间变化
C.混合气体总压强不随时间变化
D.
 的正反应速率等于
的正反应速率等于 的逆反应速率的3倍
的逆反应速率的3倍(3)工业上常用天然气制备CO,原理如下:
①


②


则


 、
、 的代数式表示)
的代数式表示)(4)光气 (COCl2)是一种有机中间体,常用于合成杀虫剂、黏合剂。CO合成光气的原理是

 。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和
。在甲、乙起始体积均为2L的密闭容器中均分别投入2molCO和 ,在不同条件下发生上述反应,测得
,在不同条件下发生上述反应,测得 与时间关系如图所示。
与时间关系如图所示。
①相对甲,乙仅改变一个条件,可能是
a.减小压强 b.加催化剂 c.降低温度
②若在恒容条件下反应,前10min内乙容器中CO的平均反应速率为
 。甲容器中CO的平衡转化率为
。甲容器中CO的平衡转化率为 。
。
您最近一年使用:0次
解题方法
7 . 硒被誉为“生命的火种”。亚硒酸钙(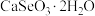 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:

已知部分信息如下:
①含硒废料的主要成分是 和
和 ,“焙烧”中固体产物为
,“焙烧”中固体产物为 、
、 和
和 ;
;
② 易溶于水,
易溶于水, 难溶于水。
难溶于水。
(1)“焙烧”时常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是___________ 。“焙烧”中被氧化的元素有___________ (填元素符号)。
(2)“浸渣”的主要成分是___________ (填化学式)。
(3)“沉硒”的化学方程式为___________ 。
(4)洗涤产品时,测定洗涤液pH,当pH为7时可认为产品已洗净,其原理是___________ 。
(5)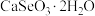 热失重时质量与温度的关系如图所示。
热失重时质量与温度的关系如图所示。

380℃时固体的成分是___________ (填化学式)。
(6)测定 产品纯度。
产品纯度。
称取wg产品溶于水,加入足量 溶液和适量稀硝酸,充分反应后,用
溶液和适量稀硝酸,充分反应后,用 溶液滴定至终点,消耗VmL滴定液。
溶液滴定至终点,消耗VmL滴定液。
发生反应:①
②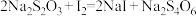
在下列试剂中,宜选择的指示剂为___________ (填标号)。
A. 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液
C. 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液
该产品中 的质量分数为
的质量分数为___________ %。
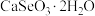 ,难溶于水)常作饲料添加剂,
,难溶于水)常作饲料添加剂, 常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
常作制备含硒营养物质的原料。一种含硒废料制备亚硒酸钙和二氧化硒的流程如图(部分条件和部分产物省略)。回答下列问题:
已知部分信息如下:
①含硒废料的主要成分是
 和
和 ,“焙烧”中固体产物为
,“焙烧”中固体产物为 、
、 和
和 ;
;②
 易溶于水,
易溶于水, 难溶于水。
难溶于水。(1)“焙烧”时常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是
(2)“浸渣”的主要成分是
(3)“沉硒”的化学方程式为
(4)洗涤产品时,测定洗涤液pH,当pH为7时可认为产品已洗净,其原理是
(5)
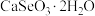 热失重时质量与温度的关系如图所示。
热失重时质量与温度的关系如图所示。
380℃时固体的成分是
(6)测定
 产品纯度。
产品纯度。称取wg产品溶于水,加入足量
 溶液和适量稀硝酸,充分反应后,用
溶液和适量稀硝酸,充分反应后,用 溶液滴定至终点,消耗VmL滴定液。
溶液滴定至终点,消耗VmL滴定液。发生反应:①

②
在下列试剂中,宜选择的指示剂为
A.
 溶液 B.
溶液 B. 淀粉溶液
淀粉溶液C.
 酚酞溶液 D.
酚酞溶液 D. 甲基橙溶液
甲基橙溶液该产品中
 的质量分数为
的质量分数为
您最近一年使用:0次
9-10高二下·江苏连云港·期末
8 . 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑。下列说法中,正确的是
| A.NaBH4既是氧化剂又是还原剂 | B.NaBH4是氧化剂,H2O是还原剂 |
| C.硼元素被氧化,氢元素被还原 | D.被氧化的与被还原的元素质量比为1∶1 |
您最近一年使用:0次
2023-09-12更新
|
340次组卷
|
81卷引用:山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题
山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷【全国百强校】山西省实验中学2018-2019学年高一上学期12月月考化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题河北省石家庄市新乐市第一中学2023-2024学年高三上学期开学测试化学试题甘肃省兰州市第五十五中学2023-2024学年高一下学期开学测试化学试卷云南省大理市下关第一中学2023-2024学年高一下学期开学化学试题(已下线)2010年江苏省灌南县第二高级中学高二下学期期末考试化学试题(已下线)2010年福建省福州三中高三上学期第一次月考化学试题(已下线)2010-2011学年浙江省宁波市高一下学期期末化学试卷(已下线)2012届山东省济南一中高三上学期期末检测化学试卷(已下线)2011-2012学年广东省中山市高一上学期期末统一考试化学试卷(已下线)2013届河北保定唐县一中高三下第二次摸底考试化学试卷(已下线)2014高考名师推荐化学氧化还原概念(已下线)2015届福建省四地六校高三上学期第一次月考化学试卷(已下线)2015届辽宁省沈阳铁路实验中学高一上学期期中考试化学试卷2014-2015学年江西省赣州中学高一上学期期中考试化学试卷2015-2016学年辽宁实验中学分校高一上12月月考化学卷2015-2016学年山东省济宁市高一上学期期末化学试卷2016-2017学年福建省厦门一中高一上期中化学卷2016-2017学年云南省云天化中学高一上学期期末考试化学试卷湖南省衡阳县第一中学2018届高三上学期第二次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期期中考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高一上学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】河北省保定市蠡县中学2018-2019学年高一上学期9月月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2016-2017学年高二下学期期末考试化学试题【全国百强校】江苏省南京市南京师范大学附属中学2017-2018学年高一上学期期中考试化学试题新疆维吾尔自治区喀什地区二中2019届高三上学期9月月考化学试题1新疆维吾尔自治区喀什地区二中2019届高三上学期9月月考化学试题2北京市首都师范大学附属中学2018-2019学年高一上学期期中考试化学试题湖南省醴陵市第一中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)【全国百强校】湖南省长沙市雅礼中学2018-2019学年高一第一学期12月月考化学试题内蒙古通辽实验中学2018-2019学年高一上学期12月月考化学试题(已下线)【新东方】高中化学5004华南师范大学附中2019-2020学年高一上学期期中考试化学试题河北省魏县第五中学2019-2020学年高一上学期第二次月考化学试题云南省昆明市第三中学2019-2020学年高一上学期期中考试化学试题江西省南昌市新建县第一中学2019-2020学年高一上学期期末考试(共建部)化学试题山东省济南市历城第二中学2019-2020学年高一上学期期末考试化学试题甘肃省天水市武山一中2019-2020学年高一12月月考化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(2)浙江省温州市2019-2020学年高一上学期期末考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训安徽省定远县民族中学2019-2020学年高二6月月考化学试题(已下线)第一章 总结与检测(测)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)人教版(2019)高一必修第一册第一章 物质及其变化 第三节 氧化还原反应 课时2 氧化剂和还原剂黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高一(英才、卓越)10月月考化学试题湖南省娄底市2020-2021学年高二上学期期中考试化学试题高一必修第一册(苏教2019) 模块综合测评吉林省白城市洮南一中2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题江西省上饶市2020-2021学年高一上学期期末教学质量测试化学试题重庆市铁路中学2020-2021学年高一上学期1月月考化学试题(已下线)【浙江新东方】高中化学20210304-021浙江省瑞安中学2020-2021学年高一上学期10月月考化学试题河南省宏力学校2020-2021学年高一上学期期末考试化学试题吉林省延边第二中学2020-2021学年高一上学期第一次考试月考化学试题湖北省武汉市蔡甸区汉阳一中2021-2022学年高一上学期9月月考化学试题辽宁省朝阳市凌源市2021-2022学年高一上学期第一次联考化学试题辽宁省庄河市高级中学2021-2022学年高一10月月考化学试题安徽省定远县炉桥中学2021-2022学年高二上学期10月教学质量检测化学试题四川省绵阳东辰国际学校2021-2022学年高一上学期第一次月考试化学试题江西省新余四中2021-2022学年高一上学期励志班阶段考试化学试题天津市河北区2021-2022学年高一上学期期末质量检测化学试题黑龙江省大庆市肇州县第二中学2021-2022学年高一下学期第一次月考化学试题河南省温县第一高级中学2022-2023学年高二上学期第二次月考化学试题天津市第二十五中学2022-2023学年高一上学期第一次阶段检测化学试题新疆阿克苏地区阿瓦提县第四中学2022-2023学年高一上学期第二次诊断性测试化学试题广东省佛山市三水中学2022-2023学年高一上学期第一次检测(10月份)化学试题宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题内蒙古自治区呼伦贝尔市鄂温克族自治旗第三中学2021-2022学年高一上学期第一次月考化学试题西藏林芝市第二高级中学2021-2022学年高三上学期第二次月考理综化学试题湖北省武汉市第四中学2021-2022学年高一上学期10月月考化学试题湖北省武汉中学2021-2022高一上学期10月月考化学试题上海市行知中学2022-2023学年高二下学期3月月考化学试题云南省峨山彝族自治县第一中学2022-2023学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高一上学期期中考试化学试题 北京市昌平区第一中学 2023-2024学年高一上学期期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高一上学期11月期中化学试题
名校
9 . 碳骨架的构建是有机合成的重要任务之一,某同学从基础化工原料乙烯出发,针对二酮H设计了如下合成路线:
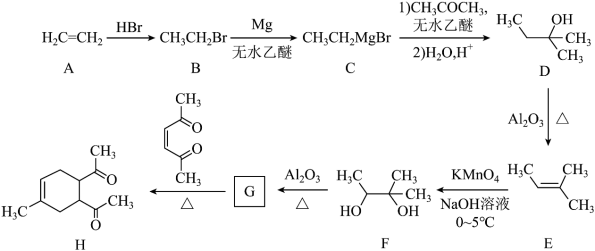
回答下列问题:
(1)由A-B反应中,乙烯的碳碳___________ 键断裂(填“ ”或“
”或“ ”),G→H的反应类型为
”),G→H的反应类型为___________ 。
(2)D的同分异构体中,与其具有相同官能团的有___________ 种(不考虑立体异构),其中核磁共振氢谱有三组峰,峰面积之比为9∶2∶1的有机物名称为___________ 。
(3)E与足量酸性 溶液反应生成的有机物的结构简式为
溶液反应生成的有机物的结构简式为___________ 、___________ 。
(4)写出F到G的化学方程式___________ 。
(5)以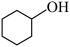 和
和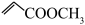 为原料,合成
为原料,合成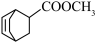 ,写出合成路线。
,写出合成路线。_______

回答下列问题:
(1)由A-B反应中,乙烯的碳碳
 ”或“
”或“ ”),G→H的反应类型为
”),G→H的反应类型为(2)D的同分异构体中,与其具有相同官能团的有
(3)E与足量酸性
 溶液反应生成的有机物的结构简式为
溶液反应生成的有机物的结构简式为(4)写出F到G的化学方程式
(5)以
 和
和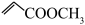 为原料,合成
为原料,合成 ,写出合成路线。
,写出合成路线。
您最近一年使用:0次
2023-09-09更新
|
70次组卷
|
2卷引用:山西省运城市2023-2024学年高三上学期开学考试化学试题
10 .  的转化和利用是实现碳中和的有效途径。其中
的转化和利用是实现碳中和的有效途径。其中 转换为
转换为 被认为是最可能利用的路径,该路径涉及反应如下:
被认为是最可能利用的路径,该路径涉及反应如下:
反应Ⅰ:

反应Ⅱ:

请回答下列问题:
(1)若已知 和CO的燃烧热,计算反应Ⅱ的
和CO的燃烧热,计算反应Ⅱ的 ,还需要的一个数据为
,还需要的一个数据为___________ 。
(2)在催化剂条件下,反应Ⅰ的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
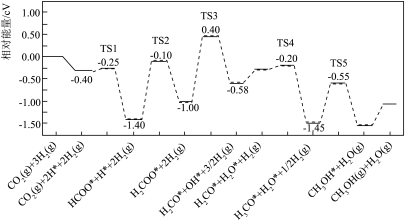
完善该反应机理中相关的化学反应方程式:
___________ ;以TS2为过渡态的反应,其正反应活化能为___________ eV。
(3)在恒温恒压下, 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
已知:
①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
② 的选择性
的选择性 。
。
①在普通反应器(A)中,下列能作为反应(反应Ⅰ和反应Ⅱ)达到平衡状态的判据是___________ (填标号)。
A.气体压强不再变化 B.气体的密度不再改变
C. D.各物质浓度比不再改变
D.各物质浓度比不再改变
②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是___________ 。
③在反应器(B)中, 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是___________ 。
④若反应器(A)中初始时 ,反应Ⅱ的化学平衡常数
,反应Ⅱ的化学平衡常数 (Ⅱ)=
(Ⅱ)=___________ (用最简的分数表示)。
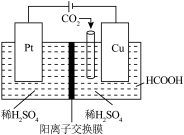
(4)近年来,有研究人员用 通过电催化生成HCOOH,实现
通过电催化生成HCOOH,实现 的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:
的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:___________ 。
 的转化和利用是实现碳中和的有效途径。其中
的转化和利用是实现碳中和的有效途径。其中 转换为
转换为 被认为是最可能利用的路径,该路径涉及反应如下:
被认为是最可能利用的路径,该路径涉及反应如下:反应Ⅰ:


反应Ⅱ:


请回答下列问题:
(1)若已知
 和CO的燃烧热,计算反应Ⅱ的
和CO的燃烧热,计算反应Ⅱ的 ,还需要的一个数据为
,还需要的一个数据为(2)在催化剂条件下,反应Ⅰ的反应机理和相对能量变化如图(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。

完善该反应机理中相关的化学反应方程式:

(3)在恒温恒压下,
 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。| 1.8MPa、260℃ | |||
 平衡转化率 平衡转化率 | 甲醇的选择性 | 达到平衡时间是(s) | |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
①分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
②
 的选择性
的选择性 。
。①在普通反应器(A)中,下列能作为反应(反应Ⅰ和反应Ⅱ)达到平衡状态的判据是
A.气体压强不再变化 B.气体的密度不再改变
C.
 D.各物质浓度比不再改变
D.各物质浓度比不再改变②平衡状态下,反应器(A)中,甲醇的选择性随温度升高而降低,可能的原因是
③在反应器(B)中,
 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是④若反应器(A)中初始时
 ,反应Ⅱ的化学平衡常数
,反应Ⅱ的化学平衡常数 (Ⅱ)=
(Ⅱ)=(4)近年来,有研究人员用
 通过电催化生成HCOOH,实现
通过电催化生成HCOOH,实现 的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:
的回收利用,其工作原理如图所示。请写出Cu电极上的电极反应式:
您最近一年使用:0次



