1 . 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
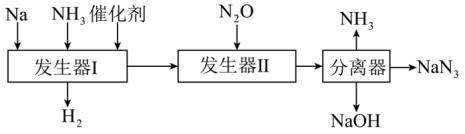
Ⅰ.NaN3是气体发生剂,一种生产叠氮化钠的工艺流程如下:
(2)上述流程中可以循环利用的物质是___________。
(3)发生器I中的反应与“钠和水”反应相似,该反应的化学方程式为___________ 。
(4)发生器Ⅱ中的反应如下:2NaNH2+N2O=NaN3+NaOH+NH3。写出实验室检验NH3气体的方法___________ 。
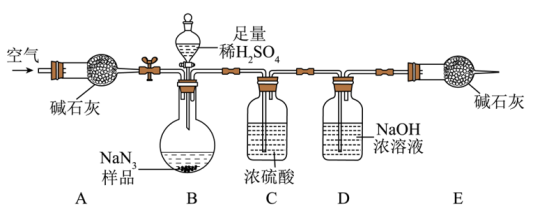
Ⅱ.上述工艺流程生产的NaN3中可能会含有少量的Na2CO3杂质,某兴趣小组设计了如下图实验装置(部分夹持装置省略),测定产品NaN3中Na2CO3的含量。
a.取下装置D,称量。
b.称量样品质量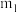 ,检查装置气密性。
,检查装置气密性。
c.打开弹簧夹,鼓入空气,一段时间后关闭。
d.打开分液漏斗的活塞和玻璃塞,注入足量稀硫酸充分反应,关闭活塞和玻璃塞。
(5)请写出正确的操作顺序:__________ ;
b→___________→___________→___________→___________→a(用步骤序号回答,可重复)。
(6)仪器E的名称为___________ 。该装置中的碱石灰的作用是___________ 。
Ⅲ.KClO4是助氧化剂,以NaCl等为原料制备KClO4得到的产品中会含有少量的KCl杂质,某兴趣小组为测定产品纯度进行了如下实验:准确称取11.378g样品溶于水中,配成500mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,(反应为3KClO4+C6H12O6=6H2O+6CO2↑+3KCl)。加入少量K2CrO4溶液作指示剂,用0.40mol·L-1AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积10.50mL(滴定达到终点时,产生砖红色Ag2CrO4沉淀)。
(7)已知: ,若
,若 ,则此时
,则此时
_________ mol/L,可认为沉淀反应已达完全。
(8)计算样品中KClO4的质量分数(写出计算过程)_______ 。
Ⅰ.NaN3是气体发生剂,一种生产叠氮化钠的工艺流程如下:
| A.NaN3中只含离子键 |
B.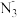 含有22个电子 含有22个电子 |
| C.常温下,0.01mol·L-1HN3溶液的pH>2 |
D.0.01mol·L-1NaN3溶液中:c(H+)+c(Na+)=c(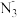 )+c(HN3) )+c(HN3) |
| A.N2O | B.NaOH | C.Na | D.NH3 |
(4)发生器Ⅱ中的反应如下:2NaNH2+N2O=NaN3+NaOH+NH3。写出实验室检验NH3气体的方法
Ⅱ.上述工艺流程生产的NaN3中可能会含有少量的Na2CO3杂质,某兴趣小组设计了如下图实验装置(部分夹持装置省略),测定产品NaN3中Na2CO3的含量。
a.取下装置D,称量。
b.称量样品质量
 ,检查装置气密性。
,检查装置气密性。c.打开弹簧夹,鼓入空气,一段时间后关闭。
d.打开分液漏斗的活塞和玻璃塞,注入足量稀硫酸充分反应,关闭活塞和玻璃塞。
(5)请写出正确的操作顺序:
b→___________→___________→___________→___________→a(用步骤序号回答,可重复)。
(6)仪器E的名称为
Ⅲ.KClO4是助氧化剂,以NaCl等为原料制备KClO4得到的产品中会含有少量的KCl杂质,某兴趣小组为测定产品纯度进行了如下实验:准确称取11.378g样品溶于水中,配成500mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,(反应为3KClO4+C6H12O6=6H2O+6CO2↑+3KCl)。加入少量K2CrO4溶液作指示剂,用0.40mol·L-1AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积10.50mL(滴定达到终点时,产生砖红色Ag2CrO4沉淀)。
(7)已知:
 ,若
,若 ,则此时
,则此时
(8)计算样品中KClO4的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
2 . Ⅰ.对甲苯磺酸是一种白色晶体,熔点107℃,易溶于醇、醚和水,是用途广泛的化工原料。
(2)写出反应的化学方程式。___________
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式: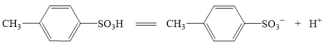 ,设计简单实验证明猜想。
,设计简单实验证明猜想。___________
(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有___________ 。
(5)向吸收液中滴加一定量___________ 溶液,仍未观察到明显现象,说明对甲苯磺酸不具有强氧化性。
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率____ 。(产率= ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)
(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点___________ 。
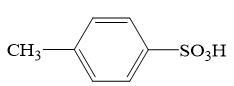
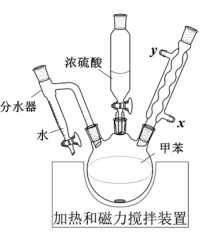
| A.当分水器中的水量不再增加时,停止加热 |
| B.分水器可将反应体系中的甲苯移除 |
| C.烧瓶中不需要添加沸石 |
| D.冷凝水从x口进入 |
Ⅱ.根据对甲苯磺酸的结构,有同学推测对甲苯磺酸的性质和硫酸相似,进行了如下探究:
(3)对甲苯磺酸可能是强酸,电离方程式:
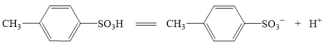 ,设计简单实验证明猜想。
,设计简单实验证明猜想。(4)采用如图所示装置进行实验,观察到蔗糖迅速变黑。上述实验现象说明对甲苯磺酸具有
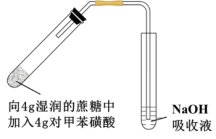
(5)向吸收液中滴加一定量
A.Ba(OH)2 B.NaCl C.CaCl2
Ⅲ.对甲苯磺酸可做酯化反应的催化剂,催化合成丙酸乙酯。
将0.2 mol丙酸(M=74 g∙mol−1)、1 g对甲苯磺酸和0.24 mol乙醇(M=46 g∙mol−1)加入三口瓶中,加热进行反应。反应结束后将反应液过滤,分别经水、碳酸钠溶液、饱和食盐水洗涤,干燥后进行蒸馏,蒸出17.4 g馏分。
(6)计算该反应的产率
 ,写出计算过程,结果保留1位小数)
,写出计算过程,结果保留1位小数)(7)请评价用对甲苯磺酸代替浓硫酸做酯化反应催化剂的优点
您最近一年使用:0次
3 . 碳骨架的构建是有机合成的重要任务之一,乙烯是基础化工原料,通过碳骨架的构建合成了二酮H。其具体的合成路线如下:___________ 。
(2)D→E的反应类型是___________。
(3)A→B的反应中,乙烯的碳碳双键中的___________ 键断裂。
A.π B.σ
(4)写出符合下列条件的D的同分异构体的结构简式___________ 。
①具有D相同的官能团 ②核磁共振氢谱有三组峰,峰面积之比为
(5)E与足量酸性 溶液反应生成的有机物的名称为
溶液反应生成的有机物的名称为___________ 、___________ 。
(6)G的结构简式为___________ 。
(7)在图中用“*”标出F中的不对称碳原子_______ 。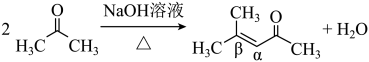 ,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I(
,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I( )和另一种α,β-不饱和酮J。
)和另一种α,β-不饱和酮J。
①J的结构简式为___________ 。
②若经此路线由H合成I,存在的问题有___________ 。
A.原子利用率低 B.产物难以分离
C.反应条件苛刻 D.严重污染环境
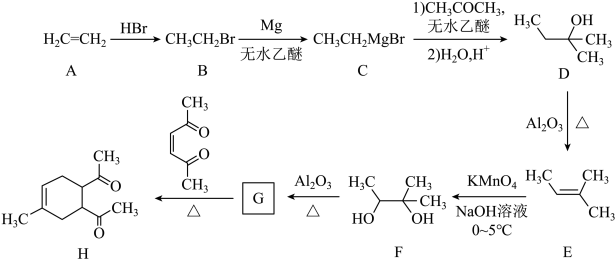
已知:ⅰ.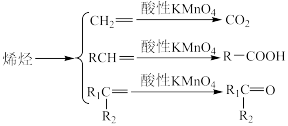
ii.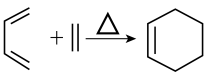
(2)D→E的反应类型是___________。
| A.取代反应 | B.加成反应 | C.消去反应 | D.加聚反应 |
(3)A→B的反应中,乙烯的碳碳双键中的
A.π B.σ
(4)写出符合下列条件的D的同分异构体的结构简式
①具有D相同的官能团 ②核磁共振氢谱有三组峰,峰面积之比为

(5)E与足量酸性
 溶液反应生成的有机物的名称为
溶液反应生成的有机物的名称为(6)G的结构简式为
(7)在图中用“*”标出F中的不对称碳原子
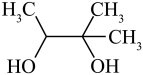
 ,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I(
,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I( )和另一种α,β-不饱和酮J。
)和另一种α,β-不饱和酮J。①J的结构简式为
②若经此路线由H合成I,存在的问题有
A.原子利用率低 B.产物难以分离
C.反应条件苛刻 D.严重污染环境
您最近一年使用:0次
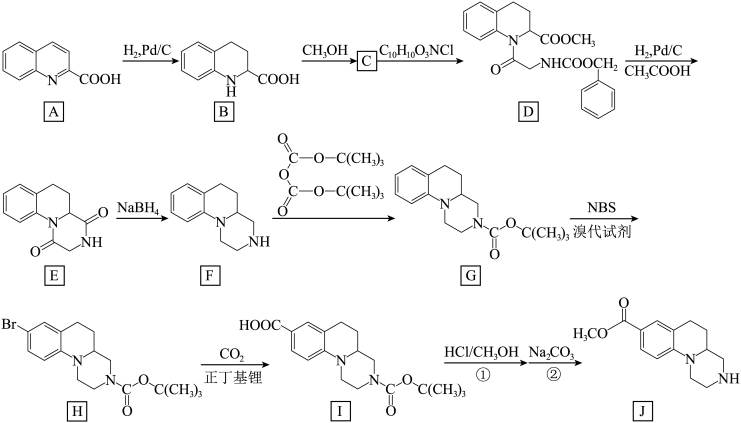
4 . 物质J是合成BCL-2和BCL-XL家族蛋白抑制剂的重要中间体。物质J的某种路线如下所示(部分条件未标出):___________ ,___________ 。
(2)C中含有的官能团为___________ 。
(3)写出C→D转化中反应物 的结构简式
的结构简式___________ 。
(4)写出物质E在碱性(NaOH溶液)、加热条件下水解的化学方程式___________ 。
(5)有关蛋白质说法错误的是___________。
(6)关于物质J说法正确的是___________。
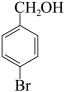
(7)写出一种符合下列条件的B的同分异构体的结构简式___________ 。
ⅰ)属于α-氨基酸类
ⅱ)能使 的
的 溶液褪色
溶液褪色
ⅲ)苯环上仅有两个取代基,且苯环上一溴代物有两种
(8)合成路线中设计F→G,I→J步骤①的目的是___________ 。
(9)结合以上合成信息,在括号内补全 的合成路线。
的合成路线。___________
(2)C中含有的官能团为
(3)写出C→D转化中反应物
 的结构简式
的结构简式(4)写出物质E在碱性(NaOH溶液)、加热条件下水解的化学方程式
(5)有关蛋白质说法错误的是___________。
| A.蛋白质溶液能形成丁达尔现象 |
B.蛋白质中加入 溶液产生盐析现象 溶液产生盐析现象 |
| C.蛋白质水解的最终产物能形成两性离子 |
| D.蛋白质水解的最终产物与茚三酮水溶液在加热条件下发生显色反应 |
(6)关于物质J说法正确的是___________。
| A.分子中含1个不对称碳原子 |
| B.发生水解反应得到3种产物 |
| C.苯环上的一溴代物有3种 |
D.分子中碳原子的杂化类型有 、 、 、sp 、sp |
(7)写出一种符合下列条件的B的同分异构体的结构简式
ⅰ)属于α-氨基酸类
ⅱ)能使
 的
的 溶液褪色
溶液褪色ⅲ)苯环上仅有两个取代基,且苯环上一溴代物有两种
(8)合成路线中设计F→G,I→J步骤①的目的是
(9)结合以上合成信息,在括号内补全
 的合成路线。
的合成路线。
 ( )
( ) ( )
( )
 ( )
( )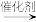
您最近一年使用:0次
解题方法
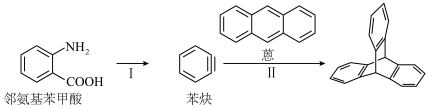
5 . Ⅰ.三蝶烯(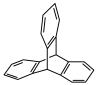 )及其衍生物是一类具有独特三维刚性结构的化合物,广泛应用在分子机器、材料化学以及超分子化学等领域。
)及其衍生物是一类具有独特三维刚性结构的化合物,广泛应用在分子机器、材料化学以及超分子化学等领域。
已知: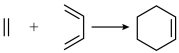
(2)预测三蝶烯的核磁共振氢谱中有___________组峰。
| A.1 | B.2 | C.3 | D.4 |
(3)下列关于邻氨基苯甲酸的说法正确的是___________。
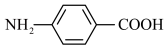
| A.红外光谱图显示分子中含有碳碳双键 |
| B.可形成分子内氢键 |
| C.沸点高于对氨基苯甲酸 |
| D.可发生加聚反应和缩聚反应 |
(4)步骤Ⅱ的反应类型为___________
| A.取代反应 | B.消去反应 | C.氧化反应 | D.加成反应 |
Ⅱ.三蝶烯-2,3,6,7-四甲酸二酐是三蝶烯的衍生物,其合成路线如下:
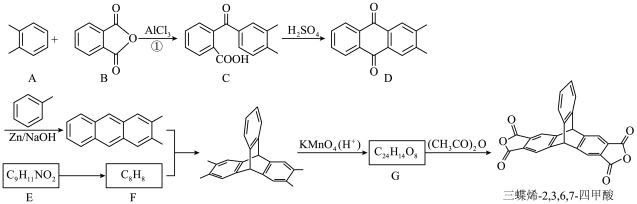
(5)A属于___________。
| A.脂肪烃 | B.芳香烃 | C.饱和烃 | D.苯的同系物 |
(6)C中含氧官能团的名称是
(7)写出C→D的化学方程式。
(8)化合物W是比化合物D少一个苯环的芳香族化合物,写出1种同时满足下列条件的W的同分异构体的结构简式。
① 仅含C、H、O元素,其中碳元素的质量分数为0.741,氢元素的质量分数为0.062;质谱图显示分子离子峰的m/z值为162。
② 能与FeCl3溶液发生显色反应,遇浓溴水不产生白色沉淀。
③ 核磁共振氢谱图中有4组峰,且峰面积之比为1∶1∶2∶6。
(9)将三蝶烯-2,3,6,7-四甲酸二酐的合成路线补充完整
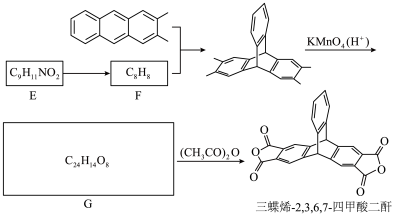
您最近一年使用:0次
6 . 黄铁矿(FeS2)在工业上有着重要的用途,黄铁矿在空气中煅烧的反应为:4FeS2+11O2 2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
 2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是
2Fe2O3+8SO2,生成的SO2可用于生产Na2SO3和H2SO4。FeS2立方晶胞如图,其晶胞边长为a nm。下列有关说法不正确的是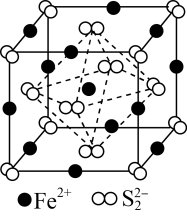
| A.FeS2中存在非极性共价键 |
B. 的空间构型为三角锥形 的空间构型为三角锥形 |
| C.SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性 |
D.晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为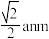 |
您最近一年使用:0次
7 . 柠檬酸铁铵和铁氰化钾在紫外线照射下产生普鲁士蓝(PB),可用于染色和能源行业。
(1)制备柠檬酸铁铵的原料有铁盐、氨水和柠檬酸。
①基态 的价层电子轨道表示式是
的价层电子轨道表示式是___________ 。
② 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
(2)避光条件下,柠檬酸铁铵与铁氰化钾反应得到普鲁士黄(PY),其晶胞形状为立方体,结构如图所示。 均与
均与 形成配位键。结合电子式,解释
形成配位键。结合电子式,解释 在PY中作配体的原因:
在PY中作配体的原因:___________ 。
②已知PY中相邻 之间的距离为a nm,
之间的距离为a nm, 表示阿伏加德罗常数的值,PY的密度为
表示阿伏加德罗常数的值,PY的密度为___________
 (用代数式表示,
(用代数式表示,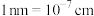 )。
)。
(3)在紫外线照射下,PY中部分 转化为
转化为 ,同时
,同时 嵌入,PY转变为PB.PB晶胞结构如图所示,其中
嵌入,PY转变为PB.PB晶胞结构如图所示,其中 周围最近且等距的
周围最近且等距的 有12个。图中“
有12个。图中“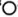 ”位置被
”位置被 或
或 占据,用“
占据,用“ ”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
___________ 。[PB晶胞( 未画出)]
未画出)] 能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是___________ 。
(1)制备柠檬酸铁铵的原料有铁盐、氨水和柠檬酸。
①基态
 的价层电子轨道表示式是
的价层电子轨道表示式是②
 的VSEPR模型名称是
的VSEPR模型名称是(2)避光条件下,柠檬酸铁铵与铁氰化钾反应得到普鲁士黄(PY),其晶胞形状为立方体,结构如图所示。
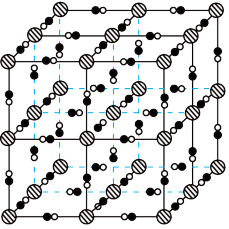
 均与
均与 形成配位键。结合电子式,解释
形成配位键。结合电子式,解释 在PY中作配体的原因:
在PY中作配体的原因:②已知PY中相邻
 之间的距离为a nm,
之间的距离为a nm, 表示阿伏加德罗常数的值,PY的密度为
表示阿伏加德罗常数的值,PY的密度为 (用代数式表示,
(用代数式表示, )。
)。(3)在紫外线照射下,PY中部分
 转化为
转化为 ,同时
,同时 嵌入,PY转变为PB.PB晶胞结构如图所示,其中
嵌入,PY转变为PB.PB晶胞结构如图所示,其中 周围最近且等距的
周围最近且等距的 有12个。图中“
有12个。图中“ ”位置被
”位置被 或
或 占据,用“
占据,用“ ”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
 未画出)]
未画出)]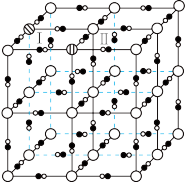
 能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是
您最近一年使用:0次
2024·上海·模拟预测
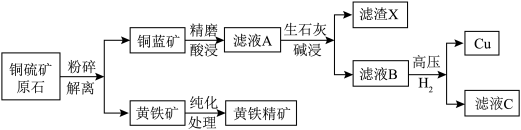
8 . 某铜硫矿富含黄铁矿和磁黄铁矿等硫铁矿物,占原矿矿物总量38%,实验室以此为原料模拟工业制备纯铜并利用黄铁精矿进行含铬废水处理,工艺流程转化如下:
2.铜蓝矿的主要成分为CuS,黄铁矿的主要成分为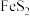 。
。
3.可能用到的数据如下:
(1)基态铜原子的空间运动状态为___________ 种。
(2)精磨酸浸过程中,精磨的作用是___________ ;酸浸一般选用硫酸溶液在纯氧环境中进行,酸浸的化学方程式为___________ 。
(3)已知增大氧气的浓度可以提高 的浸取率,请结合化学用语解释其原因
的浸取率,请结合化学用语解释其原因___________ 。
(4)生石灰碱浸时调节pH的范围为___________。
(5)滤渣X的主要成分是___________ 。
(6)向滤液B中通入高压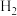 ,可成功制得单质铜的原因是
,可成功制得单质铜的原因是___________ 。
(7)黄铁精矿处理含铬废水的机理如图所示: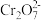 )发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
)发生氧化还原反应,请结合信息写出此过程的离子反应方程式:___________ 。
2.铜蓝矿的主要成分为CuS,黄铁矿的主要成分为
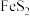 。
。3.可能用到的数据如下:
 |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(2)精磨酸浸过程中,精磨的作用是
(3)已知增大氧气的浓度可以提高
 的浸取率,请结合化学用语解释其原因
的浸取率,请结合化学用语解释其原因(4)生石灰碱浸时调节pH的范围为___________。
| A.3.2≤pH<4.7 | B.3.2≤pH<6.1 | C.4.2≤pH<6.7 | D.3.2≤pH<4.2 |
(6)向滤液B中通入高压
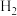 ,可成功制得单质铜的原因是
,可成功制得单质铜的原因是(7)黄铁精矿处理含铬废水的机理如图所示:
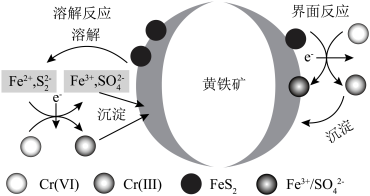
 )发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
)发生氧化还原反应,请结合信息写出此过程的离子反应方程式:
您最近一年使用:0次
2024·上海·模拟预测
解题方法
9 . 多丁纳德(化合物I)是一种治疗痛风的药物,以下为其合成路线之一(部分条件已略去)。___________ 。
(2)A→B的反应类型是___________。
(3)C的结构简式是___________ 。
(4)D→E的反应试剂和条件是___________ 。
(5)在D的同分异构体中,同时满足下列条件的结构简式是___________ 。
①含有苯环
②遇 溶液显紫色
溶液显紫色
③与 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为C7H7NS,F+K→G的方程式是___________ 。
(7)设计反应①和反应②的目的是___________ 。
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式___________ 。

已知:
(2)A→B的反应类型是___________。
| A.加成反应 | B.取代反应 | C.消去反应 | D.氧化反应 |
(4)D→E的反应试剂和条件是
(5)在D的同分异构体中,同时满足下列条件的结构简式是
①含有苯环
②遇
 溶液显紫色
溶液显紫色③与
 溶液反应放出
溶液反应放出
④核磁共振氢谱显示为五组峰,且峰面积比为2:2:2:1:1
(6)已知K的分子式为C7H7NS,F+K→G的方程式是
(7)设计反应①和反应②的目的是
(8)J→K的反应还可能生成高分子M,写出M的一种结构简式
您最近一年使用:0次
10 . 在煤炭中加入碳酸钙可减少酸雨的形成。在研究碳酸盐分解时发现MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg),ΔH表达式为___________ ;已知CaCO3(s)=CaO(s)+CO2(g)ΔH>0,则该反应能自发进行的条件是___________ 。___________ 。
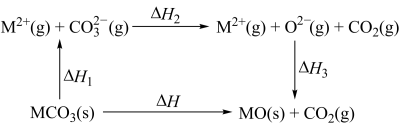
您最近一年使用:0次



