名校
解题方法
1 . 元素周期表在学习、研究和生产实践中有很重要的作用。下表显示了元素周期表中的短周期,①~⑤代表5种元素。
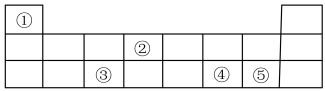
(1)②在元素周期表中的位置是______ 。
(2)⑤的最高价氧化物对应的水化物的化学式是______ 。
(3)①和⑤可形成共价化合物,用电子式表示其形成过程______ 。
(4)①分别与④、⑤形成的化合物中,稳定性强的是______ (用化学式表示)。
(5)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是______ 。
(6)元素 的原子结构示意图为
的原子结构示意图为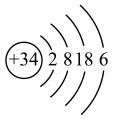 。下列推断错误的是______(填序号)。
。下列推断错误的是______(填序号)。
(7) 在一定条件下可与
在一定条件下可与 溶液反应,生成一种正盐和水,该正盐化学式为
溶液反应,生成一种正盐和水,该正盐化学式为______ 。

(1)②在元素周期表中的位置是
(2)⑤的最高价氧化物对应的水化物的化学式是
(3)①和⑤可形成共价化合物,用电子式表示其形成过程
(4)①分别与④、⑤形成的化合物中,稳定性强的是
(5)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是
(6)元素
 的原子结构示意图为
的原子结构示意图为 。下列推断错误的是______(填序号)。
。下列推断错误的是______(填序号)。A. 位于第四周期、与④同主族 位于第四周期、与④同主族 | B. 的最低负化合价为-2价 的最低负化合价为-2价 |
C. 具有还原性 具有还原性 | D.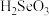 的酸性强于 的酸性强于 |
(7)
 在一定条件下可与
在一定条件下可与 溶液反应,生成一种正盐和水,该正盐化学式为
溶液反应,生成一种正盐和水,该正盐化学式为
您最近一年使用:0次
名校
2 . 高铁酸钾  是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为
是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为  胶体,制备高铁酸钾流程如图所示。
胶体,制备高铁酸钾流程如图所示。

下列叙述
A.反应 的化学方程式是 的化学方程式是 |
B.用  溶液吸收反应 溶液吸收反应  中尾气所得产物可再利用 中尾气所得产物可再利用 |
C.反应  中氧化剂与还原剂的个数比为 中氧化剂与还原剂的个数比为  |
D.用  对饮用水杀菌消毒的同时,生成的 对饮用水杀菌消毒的同时,生成的  胶体吸附杂质净化水 胶体吸附杂质净化水 |
您最近一年使用:0次
2024-03-18更新
|
186次组卷
|
2卷引用:安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
3 . 废SCR催化剂(含TiO2、V2O5、WO3等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回可收其中的钛、钒、钨等。

已知:①TiO2、V2O5和WO3都能与NaOH溶液反应,生成可溶性的NaVO3、Na2WO4和不溶性的Na2TiO3;
② 。
。
(1)元素钒位于元素周期表中的位置___________ 。
(2)“球磨”的目的是___________ 。
(3)“碱浸”后进行钛化合物与钒、钨化合物分离,需要用到下列仪器中___________。(填序号)
(4)“碱浸”后通过___________ (填操作名称)可实现钛与钒、钨分离。
(5)“酸浸”后钛主要以TiO2+形式存在,“热水解”反应的离子方程式___________ 。
(6)“煅烧”NH4VO3的化学方程式___________ 。
(7)“沉钨”中析出CaWO4时,需要加入过量CaCl2,其目的是___________ 。
(8)向20mL0.2mol·L-1Na2WO4的滤液中加入等体积的CaCl2溶液(忽略混合过程中的体积变化),欲使WO 浓度小于
浓度小于 ,则CaCl2溶液的最小浓度为
,则CaCl2溶液的最小浓度为___________ mol·L-1。

已知:①TiO2、V2O5和WO3都能与NaOH溶液反应,生成可溶性的NaVO3、Na2WO4和不溶性的Na2TiO3;
②
 。
。(1)元素钒位于元素周期表中的位置
(2)“球磨”的目的是
(3)“碱浸”后进行钛化合物与钒、钨化合物分离,需要用到下列仪器中___________。(填序号)
A. | B. | C.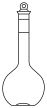 | D.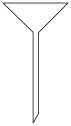 |
(4)“碱浸”后通过
(5)“酸浸”后钛主要以TiO2+形式存在,“热水解”反应的离子方程式
(6)“煅烧”NH4VO3的化学方程式
(7)“沉钨”中析出CaWO4时,需要加入过量CaCl2,其目的是
(8)向20mL0.2mol·L-1Na2WO4的滤液中加入等体积的CaCl2溶液(忽略混合过程中的体积变化),欲使WO
 浓度小于
浓度小于 ,则CaCl2溶液的最小浓度为
,则CaCl2溶液的最小浓度为
您最近一年使用:0次
名校
解题方法
4 . 下列反应的离子方程式正确的是
A.向漂白粉溶液中通入少量SO2,生成CaSO4: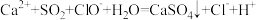 |
B.向BaCO3中加入适量稀盐酸: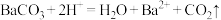 |
C.向适量水中加入少量Na2O2: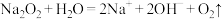 |
D.足量Ba(OH)2溶液与稀硫酸反应: |
您最近一年使用:0次
名校
解题方法
5 . 金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题:
(1)FeCl3溶液用于腐蚀铜箔印刷线路板,该反应的离子方程式为___________ 。
(2)经检测某酸性废水中所含离子及其浓度如表所示:
则(Al3+)=___________ mol/L。
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作I”所需要的玻璃仪器除烧杯外,还需要的是___________ 、___________ 。
②FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为___________ 。
③1.0kg含铁95%的废铁屑,操作I损失率为2%,操作Ⅱ损失率为1%,最后获得Fe2O3的质量为___________ kg。
(4)用托盘天平(1g以下用游码)称量绿矾(FeSO4∙7H2O)晶体配制450mL0.1mol/L溶液,需要绿矾的质量为___________ ;配制过程以下实验操作会导致所配溶液浓度偏低的是___________ 。
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻度线,未补加水
d.定容时,俯视刻度线
(1)FeCl3溶液用于腐蚀铜箔印刷线路板,该反应的离子方程式为
(2)经检测某酸性废水中所含离子及其浓度如表所示:
| 离子 |  |  |  |  |  |
| 浓度/(mol/L) | 2×10-2 | 1×10-1 | 2×10-2 | 1×10-1 |
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如图:

①完成“操作I”所需要的玻璃仪器除烧杯外,还需要的是
②FeCO3在空气中加热反应生成Fe2O3时,氧化剂和还原剂的物质的量之比为
③1.0kg含铁95%的废铁屑,操作I损失率为2%,操作Ⅱ损失率为1%,最后获得Fe2O3的质量为
(4)用托盘天平(1g以下用游码)称量绿矾(FeSO4∙7H2O)晶体配制450mL0.1mol/L溶液,需要绿矾的质量为
a.用托盘天平称量绿矾晶体时,将砝码放在左盘,药品放在右盘
b.洗涤烧杯和玻璃棒后,将洗涤液倒入废液缸中
c.摇匀后发现液面低于刻度线,未补加水
d.定容时,俯视刻度线
您最近一年使用:0次
2024-03-04更新
|
88次组卷
|
2卷引用:安徽省宿州市十三校联考2023-2024学年高一上学期1月期末考试化学试题
6 . 已知反应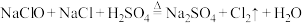 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
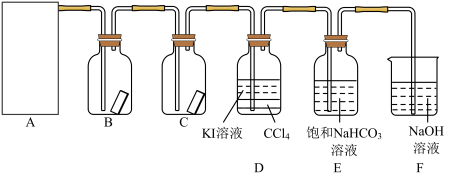
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是_______ (填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是_______ ,请提出合理的改进方法:_______ 。
(3)写出氯气与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ,该反应中氧化剂与还原剂的物质的量之比为_______ 。为验证尾气吸收后的溶液中存在 ,正确的操作是
,正确的操作是_______ 。
(4)氯气通入饱和 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有_______ (填化学式)。
 ,为探究氯气的性质,某同学设计了如图所示的实验装置。
,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取氯气的装置是

(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是
(3)写出氯气与
 溶液反应的离子方程式:
溶液反应的离子方程式: ,正确的操作是
,正确的操作是(4)氯气通入饱和
 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明
溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明 与
与 反应的产物中含有
反应的产物中含有
您最近一年使用:0次
2024-03-04更新
|
46次组卷
|
7卷引用:安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题
安徽省宿州市泗县第一中学2023-2024学年高一下学期开学考试化学试题(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)(已下线)第二章单元检测 (测)--2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)重庆市巫山县官渡中学2020-2021学年高一下学期第一次月考化学试题四川省天府新区太平中学2022-2023学年高一上学期期末考试化学试题四川省宜宾市叙州区第二中学校2022-2023学年高一下学期开学考试化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题
7 . 2021年诺贝尔化学奖授予两位“不对称有机催化”领域的先驱,催化剂经常用在有机化学中,例如铁的配合物离子(用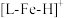 表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:
表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:

下列说法正确的是
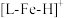 表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:
表示)催化甲酸分解的反应机理和相对能量的变化情况如图所示:
下列说法正确的是
| A.该过程的总反应为吸热反应 |
| B.该过程的总反应速率由Ⅱ→Ⅲ步骤决定 |
C.该过程中,溶液 值的大小会影响化学反应的快慢 值的大小会影响化学反应的快慢 |
D.在整个过程中,每生成标况下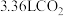 转移电子数为 转移电子数为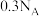 |
您最近一年使用:0次
名校
8 . 高铁酸钾 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:

回答下列问题:
(1)配制 溶液。
溶液。
①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和_______ ,需要用托盘天平称量 固体
固体_______ g。
②下列操作可能导致上述 溶液浓度偏大的是
溶液浓度偏大的是_______ (填字母)。
A.摇匀后发现液面低于刻度线,再加水至刻度线
B. 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤
C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为_______ (从物质性质角度)。
(2)“氧化”过程中溶液保持强碱性,写出 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:_______ 。
(3)“除杂”后滤液的主要成分为 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是_______ 。
(4) 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是_______ 。
 是一种高效多功能的新型非氯绿色消毒剂。已知
是一种高效多功能的新型非氯绿色消毒剂。已知 可溶于水、微溶于浓
可溶于水、微溶于浓 溶液,在
溶液,在 、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
、强碱性溶液中比较稳定。实验室模拟湿法制备高铁酸钾的流程如下:
回答下列问题:
(1)配制
 溶液。
溶液。①配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒和
 固体
固体②下列操作可能导致上述
 溶液浓度偏大的是
溶液浓度偏大的是A.摇匀后发现液面低于刻度线,再加水至刻度线
B.
 在烧杯中溶解后,烧杯未洗涤
在烧杯中溶解后,烧杯未洗涤C.使用前,容量瓶中有少量蒸馏水
D.定容时俯视刻度线
③上述配制的
 溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为
溶液的浓度并不精确,其因素除可能的不当操作外,还主要因为(2)“氧化”过程中溶液保持强碱性,写出
 溶液氧化
溶液氧化 生成
生成 的离子方程式:
的离子方程式:(3)“除杂”后滤液的主要成分为
 和
和 ,“转化”反应能发生的原因是
,“转化”反应能发生的原因是(4)
 在净水过程中会产生
在净水过程中会产生 胶体,检验该过程中产生胶体的方法是
胶体,检验该过程中产生胶体的方法是
您最近一年使用:0次
2024-03-02更新
|
64次组卷
|
2卷引用:安徽省灵璧中学名校联考2023-2024学年高一上学期1月阶段性考试化学试题
9 . 下列关于电解质溶液的判断正确的是
A.能使蓝色石蕊试纸变红色的溶液中, 可以大量共存 可以大量共存 |
B.能使碘化钾淀粉试纸变蓝的溶液中: 可以大量共存 可以大量共存 |
C.水电离出的 的溶液中: 的溶液中: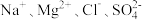 一定不能大量共存 一定不能大量共存 |
D.常温下,在 的溶液中, 的溶液中, 不能大量共存 不能大量共存 |
您最近一年使用:0次
名校
解题方法
10 . 按要求填空。
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是___________ ;该变化属于___________ (填:“物理变化”或“化学变化”)。
(2) 在食品行业中应用广泛,溶于水后电离方程式
在食品行业中应用广泛,溶于水后电离方程式___________ 。
(3)已知某主族元素的原子结构示意图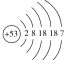 ,请写出它在周期表中的位置
,请写出它在周期表中的位置___________ ;该元素属于___________ 元素(填“金属”、“非金属”或“稀有气体”)。
(4)少量的淀粉 溶液中滴加几滴
溶液中滴加几滴 溶液,溶液变成蓝色,反应的离子方程式为:
溶液,溶液变成蓝色,反应的离子方程式为:___________ 。
(5)下列各组物质之间关系互为同位素的是___________。
(1)当食盐不慎洒落在天然气的火焰上,观察到的现象是
(2)
 在食品行业中应用广泛,溶于水后电离方程式
在食品行业中应用广泛,溶于水后电离方程式(3)已知某主族元素的原子结构示意图
 ,请写出它在周期表中的位置
,请写出它在周期表中的位置(4)少量的淀粉
 溶液中滴加几滴
溶液中滴加几滴 溶液,溶液变成蓝色,反应的离子方程式为:
溶液,溶液变成蓝色,反应的离子方程式为:(5)下列各组物质之间关系互为同位素的是___________。
| A.D和T | B.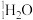 与 与 | C.金刚石与石墨 | D. 与 与 |
您最近一年使用:0次



