1 . 下列化学用语或图示表达正确的是
A. 的电子式为 的电子式为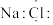 | B. 的VSEPR模型为 的VSEPR模型为 |
C.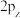 电子云图为 电子云图为 | D.基态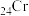 原子的价层电子轨道表示式为 原子的价层电子轨道表示式为 |
您最近一年使用:0次
2023-06-28更新
|
7545次组卷
|
16卷引用:江西省吉安市宁冈中学2023-2024学年高三上学期开学考试化学试题
江西省吉安市宁冈中学2023-2024学年高三上学期开学考试化学试题2023年高考北京卷化学真题(已下线)2023年北京卷高考真题变式题(选择题1-5)(已下线)第21讲分子结构与性质(已下线)专题02 化学用语及其应用-2023年高考化学真题题源解密(新高考专用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题北京市第一七一中学2023-2024学年高三上学期10月考化学试题北京师范大学第二附属中学2023-2024学年高二上学期12月月考化学试题 北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)题型01 物质的组成与分类 传统文化 化学用语-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京师范大学附属中学2023-2024学年高二上学期期末考试化学试卷广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷北京市第五十五中学2023-2024学年高二下学期(等级考)3月调研化学试卷海南省文昌中学2023-2024学年高二下学期第一次月考化学试题上海市华东师范大学第二附属中学(紫竹校区)2023-2024学年高三下学期三模考试 化学试题福建省福建师范大学附属中学2023-2024学年高三上学期开学考化学试题
2 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄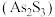 褪色的主要原因是发生了以下两种化学反应:
褪色的主要原因是发生了以下两种化学反应:
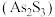 褪色的主要原因是发生了以下两种化学反应:
褪色的主要原因是发生了以下两种化学反应: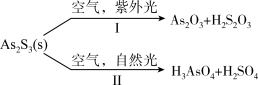
A. 和 和 的空间结构都是正四面体形 的空间结构都是正四面体形 |
B.反应Ⅰ和Ⅱ中,元素 和S都被氧化 和S都被氧化 |
C.反应Ⅰ和Ⅱ中,参加反应的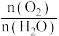 :Ⅰ<Ⅱ :Ⅰ<Ⅱ |
D.反应Ⅰ和Ⅱ中,氧化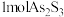 转移的电子数之比为3∶7 转移的电子数之比为3∶7 |
您最近一年使用:0次
2023-06-16更新
|
7314次组卷
|
24卷引用:江西省吉安市双校联盟2022-2023学年高二下学期期中考试化学试题
江西省吉安市双校联盟2022-2023学年高二下学期期中考试化学试题2023年高考湖南卷化学真题(已下线)专题06 物质结构与性质(已下线)专题09 氧化还原反应(已下线)第3讲 氧化还原反应(已下线)2023年湖南卷高考真题变式题(选择题6-10)浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)河南省商丘市第一高级中学2022-2023学年高二下学期期末考试化学试题浙江省义乌五校2023-2024学年高三上学期10月联考化学试题北京大学附属中学预科部2023-2024学年高三上学期10月阶段练习化学试题浙江省三校2023-2024学年高三上学期联考选考模拟化学试题(已下线)题型04 氧化还原反应-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江西省宜春市丰城市第九中学2023-2024学年高一上学期1月期末化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)河南省济源市高级中学2023-2024学年高三上学期9月高考模拟检测理科综合试题-高中化学山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)浙江省杭州学军中学2023-2024学年高二下学期期中考试化学试卷福建省泉州第五中学2024届高三下学期适应性检测化学试题
名校
3 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.100 mL 18 mol/L浓硫酸与足量Cu粉加热反应,产生 分子数为 分子数为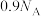 |
B.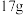 羟基含有的电子数目为 羟基含有的电子数目为 |
C.一定条件下,1 mol  与足量 与足量 反应,产 反应,产 的分子数为 的分子数为 |
D. 质量分数为 质量分数为 的乙醇溶液中,含 的乙醇溶液中,含 键的数目为 键的数目为 |
您最近一年使用:0次
2023-06-15更新
|
931次组卷
|
2卷引用:江西省吉安市第三中学2023-2024学年高二上学期开学考试化学试题
22-23高三上·广东深圳·阶段练习
名校
解题方法
4 . 氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如图:

已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如表:
③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_______ 。分析图,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。分析选择反应温度不高于500℃的原因是_______ 。

(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为_______ ;再调节溶液的pH将Al3+、Fe3+变为沉淀除去,溶液pH的范围为_______ ;然后加入NH4F除去______ 。
(3)碳化结晶时,反应的离子方程式为_______ 。
(4)MnCO3(相对分子质量115)在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃~770℃范围内,发生反应的化学方程式为______ 。


已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(Mn+)=0.1mol/L]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为

(2)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为
(3)碳化结晶时,反应的离子方程式为
(4)MnCO3(相对分子质量115)在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示,300℃~770℃范围内,发生反应的化学方程式为

您最近一年使用:0次
2023-06-08更新
|
172次组卷
|
4卷引用:江西省吉安市泰和中学2023-2024学年高二上学期10月月考化学试题
江西省吉安市泰和中学2023-2024学年高二上学期10月月考化学试题(已下线)广东省深圳中学2023届高三上学期第一次阶段测试化学试题(已下线)T26-工业流程题江西省丰城中学2023-2024学年高三上学期开学考试化学试题
名校
5 . 设 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,23 g乙醇分子中含有的化学键总数为4 |
B.2 mol  与2 mol 与2 mol  充分反应后,容器内气体分子数为3 充分反应后,容器内气体分子数为3 |
C.1 mol/L的碳酸钠溶液中含 的数目为2 的数目为2 |
D.一定条件下,56 g铁与足量氯气反应转移的电子数为2 |
您最近一年使用:0次
2023-06-08更新
|
186次组卷
|
3卷引用:江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
6 . 将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,加入10mL时开始产生沉淀,加入60mL时沉淀最多,继续加入至70mL时沉淀量不再变化。据此判断下列说法错误的是
| A.沉淀最大质量为4.08g | B.原溶液中 |
C.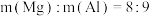 | D.氢氧化钠溶液浓度为2.5mol/L |
您最近一年使用:0次
2023-06-05更新
|
576次组卷
|
2卷引用:江西省井冈山大学附属中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . 以含铅废料(Pb、PbO、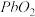 、
、 及炭黑等)制备高纯PbO。其流程如下:
及炭黑等)制备高纯PbO。其流程如下:
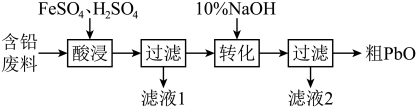
(1)酸浸时,在 催化下Pb和
催化下Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是___________ 。
(2) 催化过程可表示为:
催化过程可表示为:
ⅰ: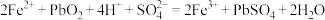 ⅱ:……
ⅱ:……
写出ⅱ的离子方程式:___________ 。
(3)PbO溶解在NaOH溶液中,存在平衡:
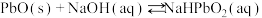 ,其溶解度曲线如图所示。
,其溶解度曲线如图所示。
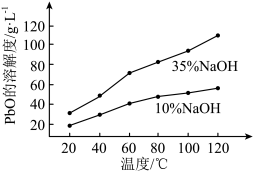
①转化过程中,选用10%NaOH溶液的原因是___________ 。
②滤液2中含有的阴离子有 、
、___________ 。
(4)结合上述溶解度曲线,设计利用粗PbO制备高纯PbO的方案:___________ 。(实验中可选用的试剂:___________ ;10%NaOH溶液、35%NaOH溶液、蒸馏水)
(5)六方氧化铅晶体的结构如图所示。用碳原子代替氧原子和铅原子,即为六方金刚石。请在该图内用粗线框出六方金刚石的一个晶胞,要求框线必须包含图中已有的一段粗线,且框出的晶胞体积最小___________ 。

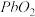 、
、 及炭黑等)制备高纯PbO。其流程如下:
及炭黑等)制备高纯PbO。其流程如下:
(1)酸浸时,在
 催化下Pb和
催化下Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是(2)
 催化过程可表示为:
催化过程可表示为:ⅰ:
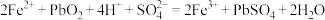 ⅱ:……
ⅱ:……写出ⅱ的离子方程式:
(3)PbO溶解在NaOH溶液中,存在平衡:
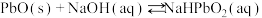 ,其溶解度曲线如图所示。
,其溶解度曲线如图所示。
①转化过程中,选用10%NaOH溶液的原因是
②滤液2中含有的阴离子有
 、
、(4)结合上述溶解度曲线,设计利用粗PbO制备高纯PbO的方案:
(5)六方氧化铅晶体的结构如图所示。用碳原子代替氧原子和铅原子,即为六方金刚石。请在该图内用粗线框出六方金刚石的一个晶胞,要求框线必须包含图中已有的一段粗线,且框出的晶胞体积最小

您最近一年使用:0次
2023-06-03更新
|
397次组卷
|
3卷引用:江西省吉安市吉州区部分学校联考2022-2023学年高二下学期期末考试化学试题
名校
8 . 将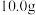 铜镁合金完全溶解于
铜镁合金完全溶解于 某浓度的硝酸中,得到
某浓度的硝酸中,得到 和NO的混合气体
和NO的混合气体 (标准状况),当向反应后的溶液中加入
(标准状况),当向反应后的溶液中加入 NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为
NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为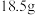 ,则下列说法不正确的是
,则下列说法不正确的是
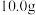 铜镁合金完全溶解于
铜镁合金完全溶解于 某浓度的硝酸中,得到
某浓度的硝酸中,得到 和NO的混合气体
和NO的混合气体 (标准状况),当向反应后的溶液中加入
(标准状况),当向反应后的溶液中加入 NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为
NaOH溶液时,金属离子全部转化为沉淀,测得沉淀的质量为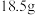 ,则下列说法不正确的是
,则下列说法不正确的是| A.该合金中铜与镁的物质的量之比2∶3 |
B.该硝酸中 的物质的量浓度是 的物质的量浓度是 |
C. 和NO的混合气体中, 和NO的混合气体中, 的体积分数是25% 的体积分数是25% |
| D.若将混合气体与水混合完全转化为硝酸,则需要通入的氧气(标准状况)的体积2.8L |
您最近一年使用:0次
2023-06-01更新
|
488次组卷
|
3卷引用:江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
9 . 工业上1,2-二氯乙烷( )是重要的有机生产原料,不溶于水,易溶于有机溶剂。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置图如下:
)是重要的有机生产原料,不溶于水,易溶于有机溶剂。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置图如下:

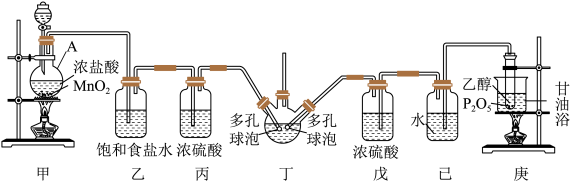
回答下列问题:
(1)仪器A的名称是___________ ,其中发生反应的离子方程式为___________ 。
(2)制乙烯采用甘油浴加热,该加热方式的优点是___________ 。
(3)写出丁装置中发生反应的化学方程式___________ 。
(4)己装置中水的作用是___________ 。
(5)实验时应先在丁装置中预先加入少量1,2二氯乙烷液体,作用是___________ 。
a.溶解 和乙烯 b.作催化剂 c.促进气体反应物间的接触
和乙烯 b.作催化剂 c.促进气体反应物间的接触
(6)制得的1,2-二氯乙烷中溶解有 、乙烯,为逐出其中的
、乙烯,为逐出其中的 、乙烯可采用的方法是
、乙烯可采用的方法是___________ 。
(7)有同学提出该装置存在缺陷,你认为是___________ 。
 )是重要的有机生产原料,不溶于水,易溶于有机溶剂。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置图如下:
)是重要的有机生产原料,不溶于水,易溶于有机溶剂。实验室采用“乙烯液相直接氯化法”制备1,2-二氯乙烷,相关反应原理和实验装置图如下:

回答下列问题:
(1)仪器A的名称是
(2)制乙烯采用甘油浴加热,该加热方式的优点是
(3)写出丁装置中发生反应的化学方程式
(4)己装置中水的作用是
(5)实验时应先在丁装置中预先加入少量1,2二氯乙烷液体,作用是
a.溶解
 和乙烯 b.作催化剂 c.促进气体反应物间的接触
和乙烯 b.作催化剂 c.促进气体反应物间的接触(6)制得的1,2-二氯乙烷中溶解有
 、乙烯,为逐出其中的
、乙烯,为逐出其中的 、乙烯可采用的方法是
、乙烯可采用的方法是(7)有同学提出该装置存在缺陷,你认为是
您最近一年使用:0次
2023-05-31更新
|
274次组卷
|
2卷引用:江西省吉安市吉州区部分学校联考2022-2023学年高一下学期7月期末考试化学试题
名校
解题方法
10 . 用纳米Fe/Ni复合材料能去除污染水体的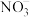 ,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(
,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢( 无法占据活性位点)。反应过程如图所示:
无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO 分两步,将步骤ii补充完整:
分两步,将步骤ii补充完整:_______ 。
i.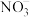 +Fe+2H+=
+Fe+2H+= +Fe2++H2O
+Fe2++H2O
ii. ______+
______+ ______+
______+ H+=
H+= Fe2++
Fe2++ ______+
______+ ______
______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因______ 。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中 随时间的变化如图所示。(注:
随时间的变化如图所示。(注: 为初始时NO
为初始时NO 的浓度。)
的浓度。)

①为达到最高去除率,应调水体的初始pH=______ 。
②t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是______ 。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,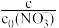 随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是
随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是______ 。

(5)利用电解无害化处理水体中的NO ,最终生成N2逸出。其装置及转化图如图所示:
,最终生成N2逸出。其装置及转化图如图所示:


①阴极的电极反应式为______ 。
②生成N2的离子方程式为______ 。
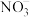 ,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(
,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢( 无法占据活性位点)。反应过程如图所示:
无法占据活性位点)。反应过程如图所示:(1)酸性环境中,纳米Fe/Ni去除NO
 分两步,将步骤ii补充完整:
分两步,将步骤ii补充完整:i.
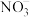 +Fe+2H+=
+Fe+2H+= +Fe2++H2O
+Fe2++H2Oii.
 ______+
______+ ______+
______+ H+=
H+= Fe2++
Fe2++ ______+
______+ ______
______(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中
 随时间的变化如图所示。(注:
随时间的变化如图所示。(注: 为初始时NO
为初始时NO 的浓度。)
的浓度。)
①为达到最高去除率,应调水体的初始pH=
②t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,
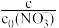 随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是
随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是
(5)利用电解无害化处理水体中的NO
 ,最终生成N2逸出。其装置及转化图如图所示:
,最终生成N2逸出。其装置及转化图如图所示:

①阴极的电极反应式为
②生成N2的离子方程式为
您最近一年使用:0次
2023-05-30更新
|
251次组卷
|
5卷引用:江西省泰和中学2022-2023学年高二上学期2月期末考试化学试题



