名校
解题方法
1 . 锌电解阳极泥(主要成分为 和
和 ,还有少量锰铅氧化物
,还有少量锰铅氧化物 和
和 )是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题:
)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题: 易溶于水,不溶于乙醇
易溶于水,不溶于乙醇
②在较高温度及酸性催化条件下,葡萄糖能发生如图反应: 时
时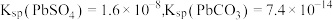
(1)已知 中
中 为
为 价,
价, 为
为 价和
价和 价,该氧化物中
价,该氧化物中 价和
价和 价
价 的物质的量之比为
的物质的量之比为_______ 。
(2)“还原酸浸”过程中主要反应的离子方程式为_______ ,该过程中实际葡萄糖加入量远大于理论需要量,其原因是_______ 。
(3)整个流程中可循环利用的物质是_______ (填名称)。获得 晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是
晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是_______ 。
(4)书写相关反应的离子方程式,并通过计算说明 时,可用
时,可用 溶液将“滤渣1”中的
溶液将“滤渣1”中的 完全转化为
完全转化为 的原因
的原因_______ 。
(5)通过氢电极增压法可制得单质锌,装置如图1所示。电解池工作时总反应的离子方程式为_______ 。 和
和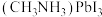 作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
① 和
和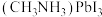 中
中 与
与 之间、
之间、 与
与 之间的离子键成分的百分数大小比较及解释
之间的离子键成分的百分数大小比较及解释_______ 。
②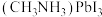 晶胞结构如图2所示,其中
晶胞结构如图2所示,其中 代表
代表 。当
。当 位于晶胞的体心时,
位于晶胞的体心时, 于晶胞的
于晶胞的_______ 位置(填“顶点”“面心”“棱心”或“晶胞内”)。
 和
和 ,还有少量锰铅氧化物
,还有少量锰铅氧化物 和
和 )是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题:
)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锰、铅和银的工艺流程如图所示。回答下列问题: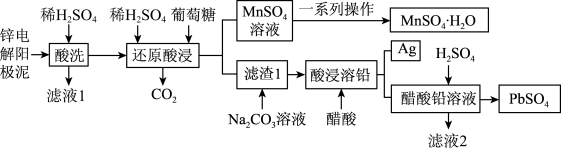
 易溶于水,不溶于乙醇
易溶于水,不溶于乙醇②在较高温度及酸性催化条件下,葡萄糖能发生如图反应:
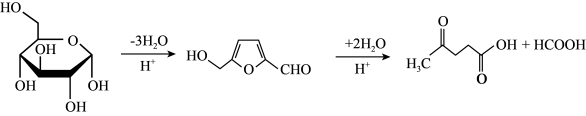
 时
时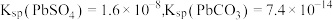
(1)已知
 中
中 为
为 价,
价, 为
为 价和
价和 价,该氧化物中
价,该氧化物中 价和
价和 价
价 的物质的量之比为
的物质的量之比为(2)“还原酸浸”过程中主要反应的离子方程式为
(3)整个流程中可循环利用的物质是
 晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是
晶体的一系列操作是蒸发结晶、趁热过滤、洗涤、低温干燥,其中“洗涤”的具体操作是(4)书写相关反应的离子方程式,并通过计算说明
 时,可用
时,可用 溶液将“滤渣1”中的
溶液将“滤渣1”中的 完全转化为
完全转化为 的原因
的原因(5)通过氢电极增压法可制得单质锌,装置如图1所示。电解池工作时总反应的离子方程式为
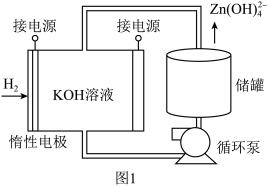
 和
和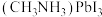 作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。
作为敏化剂的太阳能电池,能量转换效率已经超过其他类型太阳能电池。①
 和
和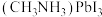 中
中 与
与 之间、
之间、 与
与 之间的离子键成分的百分数大小比较及解释
之间的离子键成分的百分数大小比较及解释②
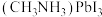 晶胞结构如图2所示,其中
晶胞结构如图2所示,其中 代表
代表 。当
。当 位于晶胞的体心时,
位于晶胞的体心时, 于晶胞的
于晶胞的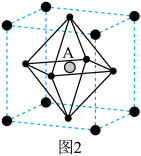
您最近一年使用:0次
7日内更新
|
94次组卷
|
2卷引用:新疆乌鲁木齐地区2024年高三下学期第三次质量监测化学试题
名校
2 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
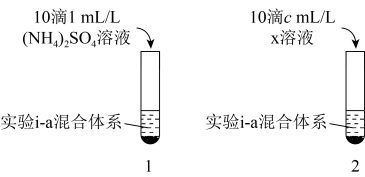
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是___________ ,c=___________ 。___________ 。
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:___________ ;反应的离子方程式为:___________ 。
| 实验序号 | 操作 | 现象 | |
| 实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
| 实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:
您最近一年使用:0次
3 . 2023年诺贝尔化学奖授予对合成量子点有突出贡献的科研工作者。碲化镉(CdTe)量子点具有优异的光电性能,常用作太阳能薄膜电池材料。我国科研人员设计以电解精炼铜获得的富碲渣(含铜、碲、银等)为原料合成碲化镉量子点的流程如下:
(1)碲的原子序数为52,基态碲原子的价层电子排布式为______ 。
(2)“硫酸酸浸时,取含单质 的富碲渣
的富碲渣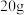 ,为将
,为将 全部溶出转化为
全部溶出转化为 ,需加质量分数为
,需加质量分数为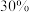 的
的 (密度:
(密度: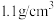 )
)______  (保留到小数点后两位)。但实际操作中,
(保留到小数点后两位)。但实际操作中, 用量远高于该计算值,原因之一是
用量远高于该计算值,原因之一是 同时也被
同时也被 浸出,请写出
浸出,请写出 被浸出时发生反应的离子方程式:
被浸出时发生反应的离子方程式:______ 。
(3)化学中用标准电极电势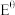 (氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为
(氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为 、
、 ,则SO2“还原”酸浸液时,主要发生反应的化学方程式是
,则SO2“还原”酸浸液时,主要发生反应的化学方程式是______ 。
(4)在研究“还原”步骤实验条件时,发现Te、Cu单位时间内沉淀率随NaCl溶液浓度的变化如图所示,则该步骤应选择的NaCl溶液适宜浓度为______ 。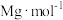 ,该晶体的密度为
,该晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离______  。(用含M、
。(用含M、 、
、 的代数式表示)
的代数式表示)______ (填字母)。
A.属于化学变化 B.由光化学反应产生 C.由电子跃迁形成

(1)碲的原子序数为52,基态碲原子的价层电子排布式为
(2)“硫酸酸浸时,取含单质
 的富碲渣
的富碲渣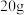 ,为将
,为将 全部溶出转化为
全部溶出转化为 ,需加质量分数为
,需加质量分数为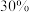 的
的 (密度:
(密度: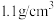 )
) (保留到小数点后两位)。但实际操作中,
(保留到小数点后两位)。但实际操作中, 用量远高于该计算值,原因之一是
用量远高于该计算值,原因之一是 同时也被
同时也被 浸出,请写出
浸出,请写出 被浸出时发生反应的离子方程式:
被浸出时发生反应的离子方程式:(3)化学中用标准电极电势
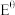 (氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为
(氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为 、
、 ,则SO2“还原”酸浸液时,主要发生反应的化学方程式是
,则SO2“还原”酸浸液时,主要发生反应的化学方程式是(4)在研究“还原”步骤实验条件时,发现Te、Cu单位时间内沉淀率随NaCl溶液浓度的变化如图所示,则该步骤应选择的NaCl溶液适宜浓度为

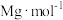 ,该晶体的密度为
,该晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 。(用含M、
。(用含M、 、
、 的代数式表示)
的代数式表示)
A.属于化学变化 B.由光化学反应产生 C.由电子跃迁形成
您最近一年使用:0次
4 . 某小组同学探究三种价态(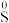 、
、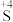 、
、 )硫元素间的相互转化。可以选用的试剂有:①
)硫元素间的相互转化。可以选用的试剂有:① 水溶液、②浓硫酸、③稀硫酸、④
水溶液、②浓硫酸、③稀硫酸、④ 溶液、⑤
溶液、⑤ 溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨
溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨ 溶液。
溶液。
(1)补全实验表格ⅰ:______ 、ⅱ:_____ 、ⅲ:_______ 。
(2)实验5的化学方程式为________ 。
(3)为了进一步验证实验1中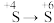 的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量
的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。
①实验a的目的是通过检验________ ,证明转化得以实现。
②加稀盐酸的作用是_______ 。
乙同学认为还需要补充实验b:取等量的 溶液,向其中先加过量稀盐酸,再加足量
溶液,向其中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。
③补充实验b的原因是______ 。
④综合实验a和b,实验1中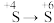 转化得以实现的证据是
转化得以实现的证据是_______ 。
(4)分析实验3和实验4现象不同的可能原因________ 。
(5)上述实验中能体现 氧化性的是
氧化性的是_______ (填实验序号)。
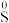 、
、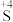 、
、 )硫元素间的相互转化。可以选用的试剂有:①
)硫元素间的相互转化。可以选用的试剂有:① 水溶液、②浓硫酸、③稀硫酸、④
水溶液、②浓硫酸、③稀硫酸、④ 溶液、⑤
溶液、⑤ 溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨
溶液、⑥氯水(浅黄绿色)、⑦铜片、⑧稀盐酸、⑨ 溶液。
溶液。| 实验序号 | 预期的价态转化 | 选择的试剂(填入试剂编号) | 实验现象 |
| 1 | 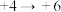 | ④⑥ | |
| 2 | ⅰ | ⅱ | |
| 3 |  | ①⑤ | 出现浑浊 |
| 4 | ④⑤ | 无明显现象 | |
| 5 | 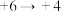 | ⅲ |
(2)实验5的化学方程式为
(3)为了进一步验证实验1中
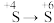 的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量
的转化,甲同学设计实验a:向反应后的溶液中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。①实验a的目的是通过检验
②加稀盐酸的作用是
乙同学认为还需要补充实验b:取等量的
 溶液,向其中先加过量稀盐酸,再加足量
溶液,向其中先加过量稀盐酸,再加足量 溶液,观察现象。
溶液,观察现象。③补充实验b的原因是
④综合实验a和b,实验1中
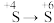 转化得以实现的证据是
转化得以实现的证据是(4)分析实验3和实验4现象不同的可能原因
(5)上述实验中能体现
 氧化性的是
氧化性的是
您最近一年使用:0次
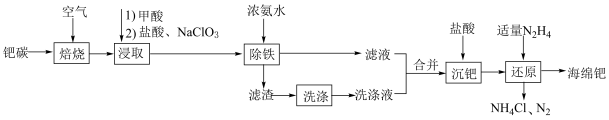
5 . 钯(Pd)是一种不活泼的金属,在新型合金、有机催化剂方面应用广泛。以废钯催化剂(简称钯碳,含有5%~6%钯、93%~94%积碳、1%~2%铁等)为原料回收钯的工艺流程如图所示。
(1)“焙烧”的主要目的是_______ ;在实验室进行“焙烧”时,下列仪器中需要用到的是_______ (填仪器名称)。 ,有
,有 (二元强酸)生成,写出生成
(二元强酸)生成,写出生成 反应的离子方程式:
反应的离子方程式:_______ 。
(3)常温下“除铁”时,铁元素恰好沉淀完全时的pH为_______ {结果保留两位小数,已知:常温下,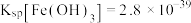 ,该条件下认为溶液中
,该条件下认为溶液中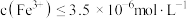 时沉淀完全,lg2=0.3}。
时沉淀完全,lg2=0.3}。
(4)滤渣需要洗涤,并将洗涤液和滤液合并,其目的是_______ 。
(5)“沉钯”时 转化为难溶于冷水的
转化为难溶于冷水的 ,其化学方程式为
,其化学方程式为_______ 。
(6)“还原”过程中还有其他副产物生成,该副产物可循环至_______ 工序利用。
(1)“焙烧”的主要目的是
 ,有
,有 (二元强酸)生成,写出生成
(二元强酸)生成,写出生成 反应的离子方程式:
反应的离子方程式:(3)常温下“除铁”时,铁元素恰好沉淀完全时的pH为
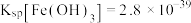 ,该条件下认为溶液中
,该条件下认为溶液中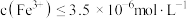 时沉淀完全,lg2=0.3}。
时沉淀完全,lg2=0.3}。(4)滤渣需要洗涤,并将洗涤液和滤液合并,其目的是
(5)“沉钯”时
 转化为难溶于冷水的
转化为难溶于冷水的 ,其化学方程式为
,其化学方程式为(6)“还原”过程中还有其他副产物生成,该副产物可循环至
您最近一年使用:0次
7日内更新
|
69次组卷
|
3卷引用:2024届河南省名校联盟高三考前模拟大联考(三模)理综试题-高中化学
6 . 用废铁屑(含少量杂质FeS)为原料制备摩尔盐 。实验装置如下(加热装置已略去):
。实验装置如下(加热装置已略去):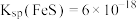 ,
,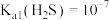 ,
,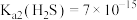 。
。
(1)A装置中的反应控制在50~60℃间进行的原因是_______ ;三颈烧瓶中液体试剂添加顺序为_______ 。(选填序号)
a.先滴加氨水,然后滴加稀硫酸,再水浴加热,反应一段时间后冷却
b.先滴加稀硫酸,然后水浴加热,再滴加氨水,反应一段时间后冷却
c.先滴加稀硫酸,然后水浴加热,反应一段时间后冷却,再滴加氨水
(2)反应一段时间后,C瓶中酸性 溶液颜色变浅,底部有淡黄色固体生成,发生反应的离子方程式为
溶液颜色变浅,底部有淡黄色固体生成,发生反应的离子方程式为_______ 。
(3)A中反应完成后过滤采用如下图b装置,相对于图a装置而言其优点有_______ (写两点)。 溶液测定制得的
溶液测定制得的 中的n值。请补充完整实验方案:准确称取
中的n值。请补充完整实验方案:准确称取 样品,加入足量稀硫酸溶解后配成250.00mL溶液。使用移液管准确移取25.00mL于锥形瓶中,
样品,加入足量稀硫酸溶解后配成250.00mL溶液。使用移液管准确移取25.00mL于锥形瓶中,_______ 。[已知:二苯胺磺酸钠指示液在还原性氛围下为无色,氧化性氛围下为紫红色。](可使用的试剂和仪器: 溶液,二苯胺磺酸钠指示液,酸式滴定管,碱式滴定管)
溶液,二苯胺磺酸钠指示液,酸式滴定管,碱式滴定管)
将测定的n值与实际值进对比,测定值偏大。下列说法正确的是_______ 。(选填序号)
a.测定值偏大可能由于晶体干燥时失去了部分结晶水
b.测定值偏大可能由于晶体中含有部分 杂质
杂质
c.测定值偏大可能由于滴入指示剂过量
d.若通过 溶液测定n值,应滴定至向上层清液中继续滴加数滴
溶液测定n值,应滴定至向上层清液中继续滴加数滴 溶液后无明显现象,记录
溶液后无明显现象,记录 溶液的用量,测定n值
溶液的用量,测定n值
e.若通过 溶液测定n值,应向其中加入过量
溶液测定n值,应向其中加入过量 溶液,将所得固体过滤洗涤烘干至恒重,记录沉淀的质量,测定n值
溶液,将所得固体过滤洗涤烘干至恒重,记录沉淀的质量,测定n值
 。实验装置如下(加热装置已略去):
。实验装置如下(加热装置已略去):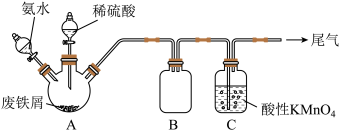
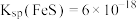 ,
,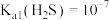 ,
,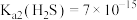 。
。(1)A装置中的反应控制在50~60℃间进行的原因是
a.先滴加氨水,然后滴加稀硫酸,再水浴加热,反应一段时间后冷却
b.先滴加稀硫酸,然后水浴加热,再滴加氨水,反应一段时间后冷却
c.先滴加稀硫酸,然后水浴加热,反应一段时间后冷却,再滴加氨水
(2)反应一段时间后,C瓶中酸性
 溶液颜色变浅,底部有淡黄色固体生成,发生反应的离子方程式为
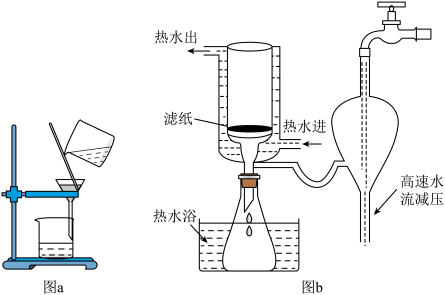
溶液颜色变浅,底部有淡黄色固体生成,发生反应的离子方程式为(3)A中反应完成后过滤采用如下图b装置,相对于图a装置而言其优点有
 溶液测定制得的
溶液测定制得的 中的n值。请补充完整实验方案:准确称取
中的n值。请补充完整实验方案:准确称取 样品,加入足量稀硫酸溶解后配成250.00mL溶液。使用移液管准确移取25.00mL于锥形瓶中,
样品,加入足量稀硫酸溶解后配成250.00mL溶液。使用移液管准确移取25.00mL于锥形瓶中, 溶液,二苯胺磺酸钠指示液,酸式滴定管,碱式滴定管)
溶液,二苯胺磺酸钠指示液,酸式滴定管,碱式滴定管)将测定的n值与实际值进对比,测定值偏大。下列说法正确的是
a.测定值偏大可能由于晶体干燥时失去了部分结晶水
b.测定值偏大可能由于晶体中含有部分
 杂质
杂质c.测定值偏大可能由于滴入指示剂过量
d.若通过
 溶液测定n值,应滴定至向上层清液中继续滴加数滴
溶液测定n值,应滴定至向上层清液中继续滴加数滴 溶液后无明显现象,记录
溶液后无明显现象,记录 溶液的用量,测定n值
溶液的用量,测定n值e.若通过
 溶液测定n值,应向其中加入过量
溶液测定n值,应向其中加入过量 溶液,将所得固体过滤洗涤烘干至恒重,记录沉淀的质量,测定n值
溶液,将所得固体过滤洗涤烘干至恒重,记录沉淀的质量,测定n值
您最近一年使用:0次
7 . “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分 ,还有
,还有 、
、 等杂质)为原料生产白磷(
等杂质)为原料生产白磷( )同时制得刀片电池正极材料
)同时制得刀片电池正极材料 的工艺流程:
的工艺流程:
① 难溶于水,可溶于pH<2的酸性溶液。
难溶于水,可溶于pH<2的酸性溶液。
② 在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。
在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。
回答下列问题:
(1)白磷( )分子呈正四面体形,难溶于水。白磷是
)分子呈正四面体形,难溶于水。白磷是___________ (填“极性分子”或“非极性分子”)。
(2)“炉渣Ⅰ”主要含有铁单质及铁的磷化物,写出一种分离出铁单质的简单方法___________ 。FeP溶于稀硝酸的离子方程式为___________ 。
(3)“炉渣Ⅱ”的主要成分是一种难溶硅酸盐,其化学式为___________ 。
(4)向“溶液Ⅱ”中通入 控制pH在2.0的原因是
控制pH在2.0的原因是___________ 。
(5)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有___________ 个。 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=___________ 。 中铁元素有+2和+3价。
中铁元素有+2和+3价。 价层电子排布式为
价层电子排布式为___________ 。
 ,还有
,还有 、
、 等杂质)为原料生产白磷(
等杂质)为原料生产白磷( )同时制得刀片电池正极材料
)同时制得刀片电池正极材料 的工艺流程:
的工艺流程: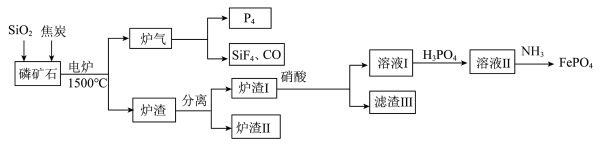
①
 难溶于水,可溶于pH<2的酸性溶液。
难溶于水,可溶于pH<2的酸性溶液。②
 在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。
在pH大于2.0时开始产生氢氧化物沉淀,pH为4.0时沉淀完全。回答下列问题:
(1)白磷(
 )分子呈正四面体形,难溶于水。白磷是
)分子呈正四面体形,难溶于水。白磷是(2)“炉渣Ⅰ”主要含有铁单质及铁的磷化物,写出一种分离出铁单质的简单方法
(3)“炉渣Ⅱ”的主要成分是一种难溶硅酸盐,其化学式为
(4)向“溶液Ⅱ”中通入
 控制pH在2.0的原因是
控制pH在2.0的原因是(5)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。
 的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有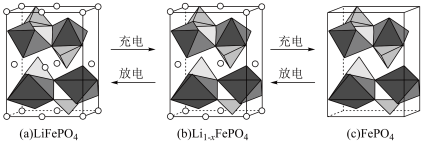
 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x= 中铁元素有+2和+3价。
中铁元素有+2和+3价。 价层电子排布式为
价层电子排布式为
您最近一年使用:0次
8 . 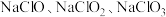 等含氯化合物在生活中有着重要应用。
等含氯化合物在生活中有着重要应用。
(1) 的制备。将
的制备。将 通入
通入 溶液中反应生成
溶液中反应生成 ,该反应为放热反应,温度过高会有副产物
,该反应为放热反应,温度过高会有副产物 生成。
生成。
①提高单位时间内 的产率,可以采取的可行措施为
的产率,可以采取的可行措施为______ 序号)。
A.适当减缓通入 速率 B.充分搅拌浆料 C.加水稀释
速率 B.充分搅拌浆料 C.加水稀释 溶液
溶液
②反应结束后,测得溶液中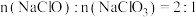 ,则该反应的化学方程式为
,则该反应的化学方程式为______ ;
③用 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。 溶液的初始
溶液的初始 越小,
越小, 转化率越高的原因是
转化率越高的原因是______ ; 的制备。
的制备。 是一种高效的消毒剂,其生产工艺流程如下。
是一种高效的消毒剂,其生产工艺流程如下。 和
和 中
中 的化合价分别为
的化合价分别为______ 、______ ;
②“吸收”时, 不能用
不能用 代替的理由是
代替的理由是______ ;
③实验室可以利用 与
与 反应可以制得
反应可以制得 。若生成
。若生成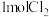 ,反应中转移的电子数为
,反应中转移的电子数为______ 。
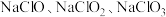 等含氯化合物在生活中有着重要应用。
等含氯化合物在生活中有着重要应用。(1)
 的制备。将
的制备。将 通入
通入 溶液中反应生成
溶液中反应生成 ,该反应为放热反应,温度过高会有副产物
,该反应为放热反应,温度过高会有副产物 生成。
生成。①提高单位时间内
 的产率,可以采取的可行措施为
的产率,可以采取的可行措施为A.适当减缓通入
 速率 B.充分搅拌浆料 C.加水稀释
速率 B.充分搅拌浆料 C.加水稀释 溶液
溶液②反应结束后,测得溶液中
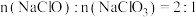 ,则该反应的化学方程式为
,则该反应的化学方程式为③用
 溶液吸收硝酸尾气,可提高尾气中
溶液吸收硝酸尾气,可提高尾气中 的去除率。其他条件相同,
的去除率。其他条件相同, 转化为
转化为 的转化率随
的转化率随 溶液初始
溶液初始 (用稀盐酸调节)的变化如图所示。
(用稀盐酸调节)的变化如图所示。 溶液的初始
溶液的初始 越小,
越小, 转化率越高的原因是
转化率越高的原因是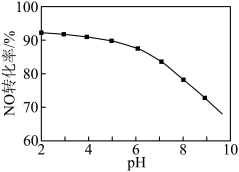
 的制备。
的制备。 是一种高效的消毒剂,其生产工艺流程如下。
是一种高效的消毒剂,其生产工艺流程如下。
 和
和 中
中 的化合价分别为
的化合价分别为②“吸收”时,
 不能用
不能用 代替的理由是
代替的理由是③实验室可以利用
 与
与 反应可以制得
反应可以制得 。若生成
。若生成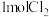 ,反应中转移的电子数为
,反应中转移的电子数为
您最近一年使用:0次
名校
9 . 常温下,二甲基亚砜( )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“ 氧化法”制备二甲基亚砜的装置如图所示(加热装置及夹持装置已省略)。
氧化法”制备二甲基亚砜的装置如图所示(加热装置及夹持装置已省略)。

①制备二甲基亚砜的反应原理为
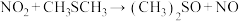 。
。②二甲基硫醚和二甲基亚砜的密度分别为
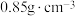 和
和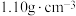 。
。③
 微热易分解为NO、
微热易分解为NO、 和
和 。
。实验过程:将仪器A中制得的气体通入15.00mL二甲基硫醚中,控制温度为60∼80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到11.10mL二甲基亚砜纯品。回答下列问题:
(1)通入
 的目的是
的目的是a.碱石灰 b.
 c.硅胶
c.硅胶(2)冷凝管进出水的方向
(3)二甲基亚砜能与水混溶的原因可能为
(4)NaOH溶液吸收尾气中NO和
 生成亚硝酸盐的化学方程式为
生成亚硝酸盐的化学方程式为(5)本实验的产率是
您最近一年使用:0次
7日内更新
|
196次组卷
|
6卷引用:2024届河北省保定市唐县第一中学高三下学期二模化学试题
解题方法
10 . 将钛铁矿( )、磷灰石矿
)、磷灰石矿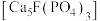 与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。
与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。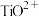 ;
;
②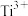 溶液为紫色;常温时,有关电对的电极电势
溶液为紫色;常温时,有关电对的电极电势
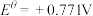 ;
;
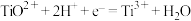
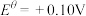 。一般标准电极电势越高,氧化剂的氧化性越强。
。一般标准电极电势越高,氧化剂的氧化性越强。
③25℃时,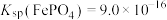 。
。
回答下列问题:
(1)Ti在元素周期表中的位置为______ 。“试剂X”为______ (填化学式)。
(2)“酸解”反应的化学方程式为______ 。
(3)“水解”过程中通过观察溶液保持紫色,判断无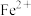 被氧化,该方法的依据是
被氧化,该方法的依据是______ 。
(4)循环利用“滤液2”的操作单元名称为______ 。“气体1”为______ (填化学式)。
(5)“沉淀”反应的化学方程式为______ 。若将铁离子恰好沉淀完全(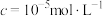 )时,
)时,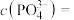
______  。
。
 )、磷灰石矿
)、磷灰石矿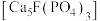 与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。
与锂灰石矿三矿耦合,按“原子经济”的绿色工艺技术路线生产磷酸铁锂,同时充分利用伴生元素。工艺流程如图。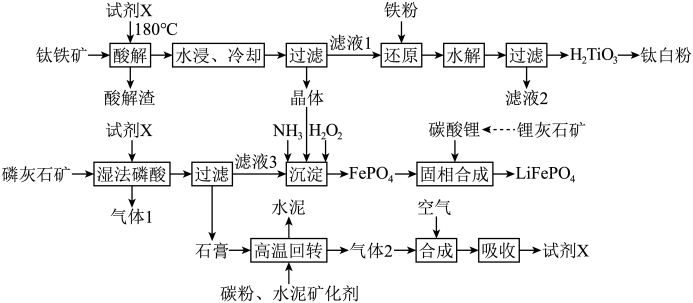
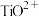 ;
;②
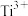 溶液为紫色;常温时,有关电对的电极电势
溶液为紫色;常温时,有关电对的电极电势
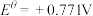 ;
;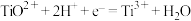
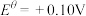 。一般标准电极电势越高,氧化剂的氧化性越强。
。一般标准电极电势越高,氧化剂的氧化性越强。③25℃时,
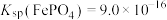 。
。回答下列问题:
(1)Ti在元素周期表中的位置为
(2)“酸解”反应的化学方程式为
(3)“水解”过程中通过观察溶液保持紫色,判断无
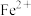 被氧化,该方法的依据是
被氧化,该方法的依据是(4)循环利用“滤液2”的操作单元名称为
(5)“沉淀”反应的化学方程式为
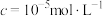 )时,
)时,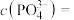
 。
。
您最近一年使用:0次



