1 . 硫酸是一种化学试剂。某实验小组的同学利用浓硫酸制取二氧化硫并探究其性质,装置如图所示。回答下列问题:___________ 。
(2)将产生的 通入品红溶液中,可以观察到的现象是
通入品红溶液中,可以观察到的现象是___________ 。
(3)上述实验产生的 尾气可以用
尾气可以用___________ (填“NaOH”或“ ”)溶液吸收。
”)溶液吸收。
(4)为探究 的还原性,需将
的还原性,需将 通入
通入___________ (填“溴水”或“酚酞”)溶液中。
(5)用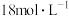 的浓硫酸进行实验,若标准状况下生成
的浓硫酸进行实验,若标准状况下生成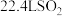 ,则理论上消耗
,则理论上消耗 的物质的量为
的物质的量为___________ mol。

(2)将产生的
 通入品红溶液中,可以观察到的现象是
通入品红溶液中,可以观察到的现象是(3)上述实验产生的
 尾气可以用
尾气可以用 ”)溶液吸收。
”)溶液吸收。(4)为探究
 的还原性,需将
的还原性,需将 通入
通入(5)用
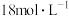 的浓硫酸进行实验,若标准状况下生成
的浓硫酸进行实验,若标准状况下生成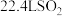 ,则理论上消耗
,则理论上消耗 的物质的量为
的物质的量为
您最近一年使用:0次
2 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为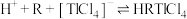 .
.
请回答下列问题:
(1)基态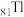 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的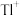 和
和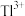 .
.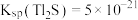 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中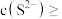
________  (假设污水中铊全部以
(假设污水中铊全部以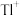 形式存在).
形式存在).
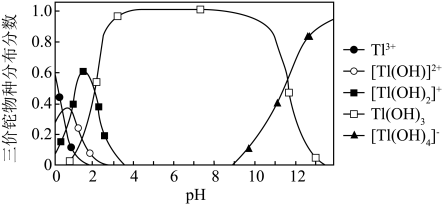
②向含铊废水中加入溴水,使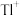 充分氧化成
充分氧化成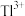 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: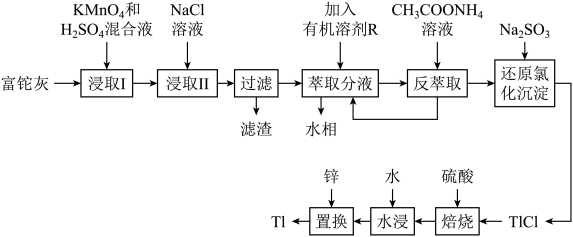
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
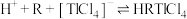 .
.请回答下列问题:
(1)基态
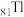 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
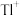 和
和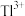 .
.
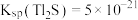 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中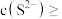
 (假设污水中铊全部以
(假设污水中铊全部以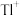 形式存在).
形式存在).②向含铊废水中加入溴水,使
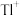 充分氧化成
充分氧化成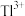 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
解题方法
3 . 钛酸钡(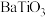 )具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微
)具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微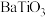 粉末的制备方法如下。
粉末的制备方法如下。 的电离方程式为
的电离方程式为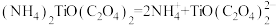 请回答:
请回答:
(1)下列说法正确的是___________。
(2)用溶液2提取的一种副产物可作肥料,该物质是___________ (写电子式);得到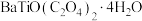 沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全
沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全___________ 。
(3)请写出煅烧过程发生反应的化学方程式___________ 。
(4)如何设计实验方案检验气体A经干燥处理后的剩余气体成分________ 。
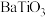 )具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微
)具有高介电常数和低介电损耗,是压电陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”。一种超细微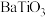 粉末的制备方法如下。
粉末的制备方法如下。
 的电离方程式为
的电离方程式为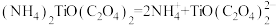 请回答:
请回答:(1)下列说法正确的是___________。
| A.压电陶瓷属于新型无机非金属材料,能实现机械能与电能的相互转化 |
B.溶液1中加入 溶液的离子方程式为 溶液的离子方程式为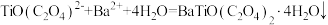 |
| C.实验室中煅烧用到的主要仪器有酒精喷灯、三脚架、泥三角和蒸发皿 |
| D.流程中的三步反应均为非氧化还原反应 |
(2)用溶液2提取的一种副产物可作肥料,该物质是
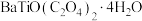 沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全
沉淀后需要洗涤,请写出实验操作以检验洗涤是否完全(3)请写出煅烧过程发生反应的化学方程式
(4)如何设计实验方案检验气体A经干燥处理后的剩余气体成分
您最近一年使用:0次
名校
解题方法
4 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。
【实验i】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 的
的 溶液
溶液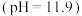 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)试剂a是_______ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是_______ 。
(3) 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为_______ 。
(4)同学甲在 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由_______ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质_______ 。
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为_______ 。
【实验ⅳ】探究的应用
(7)将 溶于乳酸
溶于乳酸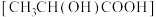 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是_______ 。
 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。【实验i】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)
 的
的 溶液
溶液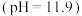 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)试剂a是
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)
 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在
 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为
【实验ⅳ】探究的应用
(7)将
 溶于乳酸
溶于乳酸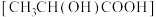 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是
您最近一年使用:0次
解题方法
5 . 用软锰矿( ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: ,
,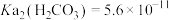 ,
,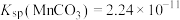
有关离子沉淀时的pH:
回答下列问题:
(1)“滤渣1”除了S、 外,还有
外,还有___________ (填化学式)。
(2)“试剂a”可以选用___________ (填标号),“除杂”应调pH范围是___________ 。
A.NaClO B. C.
C. D.NaOH
D.NaOH
(3)“沉锰”时发生反应的离子方程式为___________ 。
(4)“沉锰”后上层清液中
___________ 。
(5)“焙烧”时发生反应的化学方程式为___________ 。
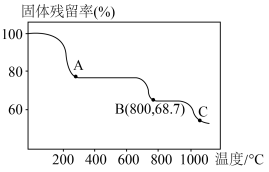
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为___________ 。
 ,含
,含 、
、 杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料
杂质)和方铅矿(PbS含少量FeS)为原料制备电极材料 的工艺流程如下:
的工艺流程如下: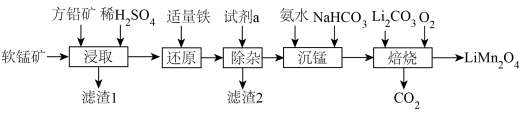
 ,
,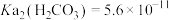 ,
,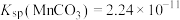
有关离子沉淀时的pH:
 |  |  |  | |
| 开始沉淀时 | 8.3 | 7.6 | 2.7 | 3.0 |
| 沉淀完全时 | 9.8 | 9.6 | 3.7 | 4.7 |
(1)“滤渣1”除了S、
 外,还有
外,还有(2)“试剂a”可以选用
A.NaClO B.
 C.
C. D.NaOH
D.NaOH(3)“沉锰”时发生反应的离子方程式为
(4)“沉锰”后上层清液中

(5)“焙烧”时发生反应的化学方程式为
(6)碳酸锰在空气中加热,固体残留率随温度变化如图。碳酸锰在300℃时已完全脱碳,则B点对应的物质的化学式为
您最近一年使用:0次
名校
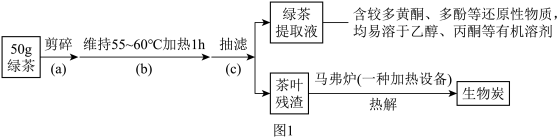
6 . 以绿茶为主要原料合成生物炭负载纳米铁(CT-FeNPs/BC)
步骤1:绿茶提取液及生物炭的制备。按如图1流程实验:
 溶液和生物炭。
溶液和生物炭。
②通一段时间 后,将绿茶提取液以2mL·
后,将绿茶提取液以2mL·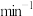 的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。
的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。
③离心分离,依次用乙醇和蒸馏水洗涤,真空干燥,产品密封备用。
回答下列问题:
(1)操作(b)中,应采用___________ 进行加热。
(2)图2中,盛装绿茶提取液的仪器名称为___________ ,加入绿茶提取液的目的是___________ 。
(3)离心分离后,用乙醇洗涤的作用是___________ 。
(4)判断产品洗涤干净的实验操作为___________ 。
(5)GT-FeNPs/BC可高效去除含铬强酸性废水中的六价铬(以 表示),反应过程如图3。
表示),反应过程如图3。 和
和 共同生成沉淀
共同生成沉淀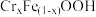 的离子方程式:
的离子方程式:___________ 。
②研究表明,GT-FeNPs/BC和 均可用于降解含
均可用于降解含 的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:
的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:
结合图3分析,实验3降解 效率显著增大的原因是
效率显著增大的原因是___________ 。
步骤1:绿茶提取液及生物炭的制备。按如图1流程实验:


 溶液和生物炭。
溶液和生物炭。②通一段时间
 后,将绿茶提取液以2mL·
后,将绿茶提取液以2mL· 的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。
的速度全部滴入三颈烧瓶中,持续磁力搅拌1h,得黑色悬浊液。③离心分离,依次用乙醇和蒸馏水洗涤,真空干燥,产品密封备用。
回答下列问题:
(1)操作(b)中,应采用
(2)图2中,盛装绿茶提取液的仪器名称为
(3)离心分离后,用乙醇洗涤的作用是
(4)判断产品洗涤干净的实验操作为
(5)GT-FeNPs/BC可高效去除含铬强酸性废水中的六价铬(以
 表示),反应过程如图3。
表示),反应过程如图3。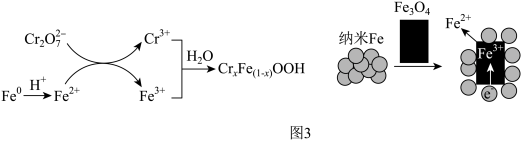
 和
和 共同生成沉淀
共同生成沉淀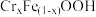 的离子方程式:
的离子方程式:②研究表明,GT-FeNPs/BC和
 均可用于降解含
均可用于降解含 的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:
的废水。为探究两者降解效果,进行了如下实验,相同时间内得到如下实验结果:| 实验编号 | GT-FeNPs/BC(g/L) |  (g/L) (g/L) |  实际降解率 实际降解率 |
| 1 | 0.05 | 0 | 51.4% |
| 2 | 0 | 2 | 7.12% |
| 3 | 0.05 | 2 | 86.67% |
 效率显著增大的原因是
效率显著增大的原因是
您最近一年使用:0次
名校
解题方法
7 . 工业上采用酸性高浓度含砷废水主要以亚砷酸(H3AsO3)形式存在,提取As2O3的工艺流程如下:
Ⅰ.As2S3与过量的 存在以下反应:
存在以下反应: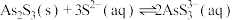 ;
;
Ⅱ.亚砷酸盐的溶解性大于相应砷酸盐。
回答下列问题:
(1)沉砷中FeSO4的作用是___________ :
(2)H2O2的作用是___________ ;滤渣I中含有FeAsO4、 、
、 和
和___________ (填化学式)。
(3)加生石灰和过氧化氢过程中,也可将砷元素转化为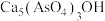 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:
A.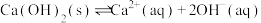

B.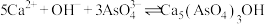
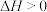
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是___________ 。
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为___________ 。
(5)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:___________ 。
(6)已知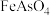 的
的 ,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以
,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以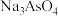 形式存在)中Fe3+的浓度为
形式存在)中Fe3+的浓度为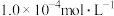 ,则低浓度含砷废水中
,则低浓度含砷废水中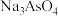 的浓度为
的浓度为___________ mg⋅L-1,___________ (填“符合”或“不符合”)排放标准。

Ⅰ.As2S3与过量的
 存在以下反应:
存在以下反应: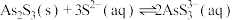 ;
;Ⅱ.亚砷酸盐的溶解性大于相应砷酸盐。
回答下列问题:
(1)沉砷中FeSO4的作用是
(2)H2O2的作用是
 、
、 和
和(3)加生石灰和过氧化氢过程中,也可将砷元素转化为
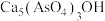 沉淀,发生的主要反应有:
沉淀,发生的主要反应有:A.
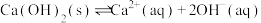

B.
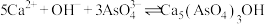
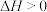
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为
(5)常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化曲线如图所示:

(6)已知
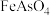 的
的 ,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以
,含砷污染物允许排放标准为不大于0.5mg⋅L-1。若低浓度含砷废水(假设砷均以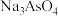 形式存在)中Fe3+的浓度为
形式存在)中Fe3+的浓度为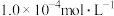 ,则低浓度含砷废水中
,则低浓度含砷废水中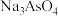 的浓度为
的浓度为
您最近一年使用:0次
名校
解题方法
8 . 研究人员拟设计黄铜矿(主要含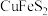 )制备硝酸铜和绿矾晶体的流程如下:
)制备硝酸铜和绿矾晶体的流程如下:
(1)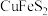 中铁元素的化合价为
中铁元素的化合价为_______ 价,已知“焙烧”生成 、CuO和
、CuO和 则其化学反应方程式为
则其化学反应方程式为_______ 。
(2)“置换”步骤中发生的所有反应的离子方程式有
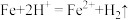 、
、_______ 。
(3)流程中“操作A”所需的玻璃仪器有烧杯、玻璃棒、_______ 。
(4)“浸洗”步骤中加入用于分离Cu、Fe的溶液A是_______ (填“稀 ”或“稀
”或“稀 ”)。
”)。
(5)“反应”步骤中,10% 为氧化剂,20%
为氧化剂,20% 提供
提供 ,可以避免污染性气体的产生,写出该“反应”的离子方程式:
,可以避免污染性气体的产生,写出该“反应”的离子方程式:_______ 。
(6)绿矾晶体( )在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
)在空气中极易变质;验证绿矾晶体已变质可选择的试剂为_______ 。
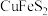 )制备硝酸铜和绿矾晶体的流程如下:
)制备硝酸铜和绿矾晶体的流程如下: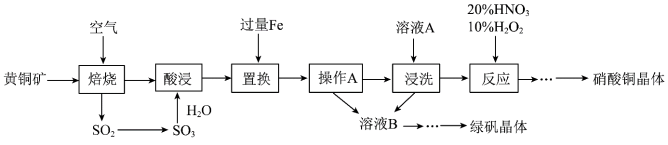
(1)
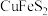 中铁元素的化合价为
中铁元素的化合价为 、CuO和
、CuO和 则其化学反应方程式为
则其化学反应方程式为(2)“置换”步骤中发生的所有反应的离子方程式有

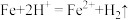 、
、(3)流程中“操作A”所需的玻璃仪器有烧杯、玻璃棒、
(4)“浸洗”步骤中加入用于分离Cu、Fe的溶液A是
 ”或“稀
”或“稀 ”)。
”)。(5)“反应”步骤中,10%
 为氧化剂,20%
为氧化剂,20% 提供
提供 ,可以避免污染性气体的产生,写出该“反应”的离子方程式:
,可以避免污染性气体的产生,写出该“反应”的离子方程式:(6)绿矾晶体(
 )在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
)在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
您最近一年使用:0次
名校
解题方法
9 . 重铬酸钾是一种重要的化工原料,可由铬铁矿(主要成分为 ,还含有硅、铝的氧化物等杂质)制备,流程如图所示:
,还含有硅、铝的氧化物等杂质)制备,流程如图所示: 主要以
主要以 形式存在,加入酸会转为
形式存在,加入酸会转为 。
。
Ⅱ.有关物质的溶解度如图所示:______ (任写一条)。
(2)步骤①中主要反应为: ,上述反应配平后
,上述反应配平后 与
与 的系数比为
的系数比为______ 。
(3)滤渣1中含量最多的金属元素是______ ,滤渣2的主要成分是Y及含硅杂质。向滤液1通入过量 得到Y的离子方程式为
得到Y的离子方程式为______ 。
(4)步骤④将滤液2的pH调小的原因是______ (结合离子方程式和文字表述说明)。
(5)向“滤液3”中加入适量KCl,经过操作X后得到 固体。操作X为:
固体。操作X为:______ ,过滤、洗涤、干燥。
(6)某工厂用448kg铬铁矿粉( 的含量为80%)制备
的含量为80%)制备 ,最终得到产品182.4kg,则
,最终得到产品182.4kg,则 的产率为
的产率为______ %。
 ,还含有硅、铝的氧化物等杂质)制备,流程如图所示:
,还含有硅、铝的氧化物等杂质)制备,流程如图所示:
 主要以
主要以 形式存在,加入酸会转为
形式存在,加入酸会转为 。
。Ⅱ.有关物质的溶解度如图所示:

(2)步骤①中主要反应为:
 ,上述反应配平后
,上述反应配平后 与
与 的系数比为
的系数比为(3)滤渣1中含量最多的金属元素是
 得到Y的离子方程式为
得到Y的离子方程式为(4)步骤④将滤液2的pH调小的原因是
(5)向“滤液3”中加入适量KCl,经过操作X后得到
 固体。操作X为:
固体。操作X为:(6)某工厂用448kg铬铁矿粉(
 的含量为80%)制备
的含量为80%)制备 ,最终得到产品182.4kg,则
,最终得到产品182.4kg,则 的产率为
的产率为
您最近一年使用:0次
名校
10 . 砷的化合物可用于半导体领域。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
I. ;
;
II.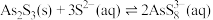 ;
;
III.砷酸(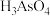 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;
IV.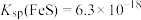 ,
,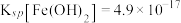 。
。
回答下列问题:
(1)“沉砷”时,亚砷酸转化为 的化学方程式为
的化学方程式为_______ 。
(2)“沉砷”时产生的废气可用_______ 溶液吸收处理(填化学式)。
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是_______ (填化学式),“滤渣”中_______  (填“含有”或“不含有”)。
(填“含有”或“不含有”)。
(4)向滤液II中通入氧气进行“氧化脱硫”,反应的离子方程式为_______ 。
(5)“沉砷”过程中FeS不可用过量的 替换,原因是
替换,原因是_______ (从平衡移动的角度解释)。
(6)该流程最后一步用 还原”砷酸,发生反应的化学方程式为
还原”砷酸,发生反应的化学方程式为_______ 。
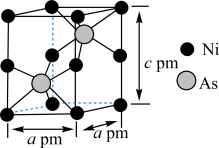
(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为apm、apm、cpm,则该晶体的密度为_______ 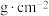 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为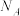 )。
)。
 )形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下:
)形式存在,废水中还含有一定量的硫酸]中回收砷的工艺流程如下: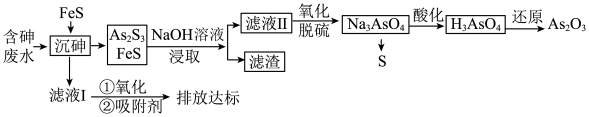
I.
 ;
;II.
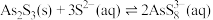 ;
;III.砷酸(
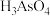 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 等还原;
等还原;IV.
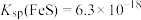 ,
,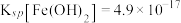 。
。回答下列问题:
(1)“沉砷”时,亚砷酸转化为
 的化学方程式为
的化学方程式为(2)“沉砷”时产生的废气可用
(3)“NaOH溶液浸取”后,所得“滤渣”的主要成分是
 (填“含有”或“不含有”)。
(填“含有”或“不含有”)。(4)向滤液II中通入氧气进行“氧化脱硫”,反应的离子方程式为
(5)“沉砷”过程中FeS不可用过量的
 替换,原因是
替换,原因是(6)该流程最后一步用
 还原”砷酸,发生反应的化学方程式为
还原”砷酸,发生反应的化学方程式为(7)某含砷化合物晶体的晶胞如图所示,As原子位于紧邻Ni原子构成的正三棱柱的体心。晶胞参数为apm、apm、cpm,则该晶体的密度为
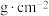 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为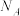 )。
)。
您最近一年使用:0次



