解题方法
1 . 在“价-类”二维图中融入“杠杆模型”,可直观辨析部分物质转化及其定量关系。图中的字母分别代表硫及其常见化合物,f、g均为含钠元素的正盐,请回答:
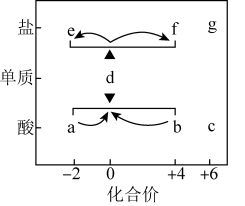
(1)当a与b混合时,可观察到的现象是___________ ;
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为___________ ;
(3)某同学利用下列装置测定空气中 的含量。
的含量。
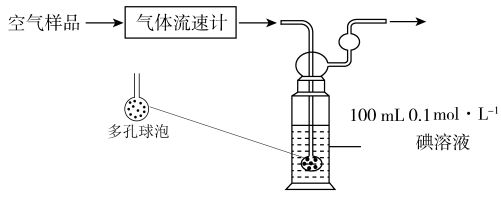
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是___________ ,该装置中 与碘
与碘 溶液发生反应的化学方程式为:
溶液发生反应的化学方程式为:___________ 。若空气流速为 ,当
,当 与碘
与碘 溶液恰好完全反应时,耗时10min,则该空气样品中
溶液恰好完全反应时,耗时10min,则该空气样品中 的含量是
的含量是___________  。(用含V的最简表达式表示)
。(用含V的最简表达式表示)

(1)当a与b混合时,可观察到的现象是
(2)固体f露置在空气中易变质转化为g,该转化的化学方程式为
(3)某同学利用下列装置测定空气中
 的含量。
的含量。
通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是
 与碘
与碘 溶液发生反应的化学方程式为:
溶液发生反应的化学方程式为: ,当
,当 与碘
与碘 溶液恰好完全反应时,耗时10min,则该空气样品中
溶液恰好完全反应时,耗时10min,则该空气样品中 的含量是
的含量是 。(用含V的最简表达式表示)
。(用含V的最简表达式表示)
您最近一年使用:0次
2023-04-21更新
|
178次组卷
|
2卷引用:浙江省杭州市六县九校联考2022-2023学年高一下学期4月期中考试化学试题
解题方法
2 . 硫代硫酸钠(Na2S2O3)是中学阶段常见的化学试剂。
Ⅰ.它在酸性条件下不稳定,可与稀硫酸发生反应: 。现利用该反应探究外界条件对反应速率的影响。
。现利用该反应探究外界条件对反应速率的影响。
(1)完成此实验设计,其中:V1=_______ ,V2=_______ 。
(2)对比实验1、2可探究_______ 对反应速率的影响。
Ⅱ.硫代硫酸钠易与空气中的CO2、O2等反应而变质,现有研究性学习小组同学,测定实验室储存的Na2S2O3样品的纯度。方法如下:准确称取10.00g样品,用蒸馏水溶解并定容至250mL,准确移取该溶液25.00mL于锥形瓶中,加入2滴淀粉溶液,用0.1000 mol/L I2的标准溶液滴定。反应原理为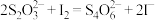 。
。
(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→_______ →开始滴定。
a.烘干 b.装入滴定液至零刻度以上 c.调整滴定液液面至零刻度或零刻度以下 d.记录起始读数 e.排除气泡 f.用滴定液润洗滴定管2至3次
(4)在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,_______ ,继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(5)滴定终点的判断方法:_______ 。
(6)本实验消耗I2的标准溶液20.00mL,则该样品的纯度为_______ 。
(7)下列操作会使测得的样品纯度偏高的是_______(填字母)。
Ⅰ.它在酸性条件下不稳定,可与稀硫酸发生反应:
 。现利用该反应探究外界条件对反应速率的影响。
。现利用该反应探究外界条件对反应速率的影响。| 实验编号 | 0.1mol/L Na2S2O3溶液体积/mL | 0.1 mol/L H2SO4溶液体积/mL | 水的体积/mL | 温度/℃ | 出现浑浊所用时间/s |
| 1 | 4.0 | 3.0 | 1.0 | 20 | t1 |
| 2 | 2.0 | 3.0 | V1 | 20 | t2 |
| 3 | V2 | 3.0 | 3.0 | 30 | t3 |
(2)对比实验1、2可探究
Ⅱ.硫代硫酸钠易与空气中的CO2、O2等反应而变质,现有研究性学习小组同学,测定实验室储存的Na2S2O3样品的纯度。方法如下:准确称取10.00g样品,用蒸馏水溶解并定容至250mL,准确移取该溶液25.00mL于锥形瓶中,加入2滴淀粉溶液,用0.1000 mol/L I2的标准溶液滴定。反应原理为
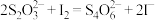 。
。(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→
a.烘干 b.装入滴定液至零刻度以上 c.调整滴定液液面至零刻度或零刻度以下 d.记录起始读数 e.排除气泡 f.用滴定液润洗滴定管2至3次
(4)在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(5)滴定终点的判断方法:
(6)本实验消耗I2的标准溶液20.00mL,则该样品的纯度为
(7)下列操作会使测得的样品纯度偏高的是_______(填字母)。
| A.滴定前有气泡,滴定结束时气泡消失 | B.滴定管未用标准溶液润洗 |
| C.滴定前仰视读数,结束时俯视读数 | D.锥形瓶未润洗 |
您最近一年使用:0次
3 . 硫代硫酸钠(Na2S2O3)是中学阶段常见的化学试剂。
I.它在酸性条件下不稳定,可与稀硫酸发生反应: 。现利用该反应探究外界条件对反应速率的影响。
。现利用该反应探究外界条件对反应速率的影响。
(1)完成此实验设计,其中:V1=_______ ,V2=_______
(2)对比实验1、2可探究_______ 对反应速率的影响。
II.硫代硫酸钠易与空气中的CO2、O2等反应而变质,现有研究性学习小组同学,测定实验室储存的Na2S2O3样品的纯度。方法如下:准确称取10.00g样品,用蒸馏水溶解并定容至250mL,准确移取该溶液25.00mL于锥形瓶中,加入2滴淀粉溶液,用0.1000mol/L碘的标准溶液滴定。反应原理为 。
。
(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→_______ →开始滴定。
a.烘干 b.装入滴定液至零刻度以上 c.调整滴定液液面至零刻度或零刻度以下 d.用洗耳球吹出润洗液 e.排除气泡 f.用滴定液润洗滴定管2至3次 g.记录起始读数
(4)本实验滴定过程中操作滴定管的图示正确的是_______(填字母)
(5)在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,_______ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(6)滴定终点的判断方法:_______ 。
(7)本实验消耗碘的标准溶液20.00mL,则该样品的纯度为_______ (保留四位有效数字)。
(8)下列操作会使测得的样品纯度偏高的是_______(填字母)。
I.它在酸性条件下不稳定,可与稀硫酸发生反应:
 。现利用该反应探究外界条件对反应速率的影响。
。现利用该反应探究外界条件对反应速率的影响。| 实验编号 | 0.1mol/L Na2S2O3溶液体积/mL | 0.1mol/L H2SO4溶液体积/mL | 水的体积/mL | 温度/℃ | 出现浑浊所用时间/s |
| 1 | 4.0 | 3.0 | 1.0 | 20 |  |
| 2 | 2.0 | 3.0 | V1 | 20 |  |
| 3 | V2 | 3.0 | 3.0 | 30 |  |
(2)对比实验1、2可探究
II.硫代硫酸钠易与空气中的CO2、O2等反应而变质,现有研究性学习小组同学,测定实验室储存的Na2S2O3样品的纯度。方法如下:准确称取10.00g样品,用蒸馏水溶解并定容至250mL,准确移取该溶液25.00mL于锥形瓶中,加入2滴淀粉溶液,用0.1000mol/L碘的标准溶液滴定。反应原理为
 。
。(3)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→
a.烘干 b.装入滴定液至零刻度以上 c.调整滴定液液面至零刻度或零刻度以下 d.用洗耳球吹出润洗液 e.排除气泡 f.用滴定液润洗滴定管2至3次 g.记录起始读数
(4)本实验滴定过程中操作滴定管的图示正确的是_______(填字母)
A.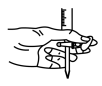 | B.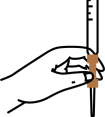 |
C.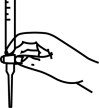 | D.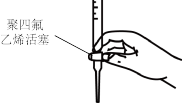 |
(6)滴定终点的判断方法:
(7)本实验消耗碘的标准溶液20.00mL,则该样品的纯度为
(8)下列操作会使测得的样品纯度偏高的是_______(填字母)。
| A.滴定前有气泡,滴定结束时气泡消失 |
| B.滴定管未用标准溶液润洗 |
| C.滴定前仰视读数,结束时俯视读数 |
| D.锥形瓶未润洗 |
您最近一年使用:0次
解题方法
4 . 下列实验操作能达到实验目的的是
| 选项 | 操作 | 目的 |
| A | 取一张pH试纸放在表面皿上,用洁净的玻璃棒蘸取NaClO溶液滴于试纸的中部,与标准比色卡对比 | 测定NaClO溶液的pH |
| B | 向含有酚酞的Na2CO3溶液中滴入BaCl2溶液,观察溶液颜色的变化 | 证明Na2CO3溶液中存在水解平衡 |
| C | 在含等物质的量浓度Na2CO3、Na2SO4的混合溶液中,滴加少量BaCl2溶液 | 探究Ksp(BaCO3)和Ksp(BaSO4)的相对大小 |
| D | 将Fe(NO3)2样品溶于稀盐酸后,滴加KSCN溶液,观察溶液是否变红 | 检验Fe(NO3)2样品是否变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
5 . 某 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
(1)样品中物质的量之比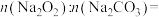
_______ 。
(2)盐酸的物质的量浓度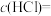
_______ 。
(3)实验Ⅲ完全反应后的溶液中,溶质除NaCl外其他组分的化学式及物质的量分别为_______ 。
 样品露置在空气中部分变质生成
样品露置在空气中部分变质生成 ,为确定其中
,为确定其中 和
和 的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸
的含量,称取四份该样品溶于水后,分别逐滴加入相同浓度盐酸 ,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:
,充分反应,产生气体的总体积(已折算成标准状况下的体积,不考虑气体在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积/ | 100.0 | 100.0 | 100.0 | 100.0 |
| 样品质量/g | 2.62 | 3.93 | 5.24 | 6.55 |
气体总体积/ | 448 | 560 | 448 | 560 |
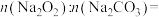
(2)盐酸的物质的量浓度
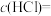
(3)实验Ⅲ完全反应后的溶液中,溶质除NaCl外其他组分的化学式及物质的量分别为
您最近一年使用:0次
6 . 根据下列实验操作和现象所得到的结论正确 的是。
| 选项 | 实验操作和现象 | 结论 |
| A | 向试管中加入2mL 5%  溶液,再滴加数滴10% NaOH溶液,振荡后加入某物质,加热,没有砖红色沉淀生成。 溶液,再滴加数滴10% NaOH溶液,振荡后加入某物质,加热,没有砖红色沉淀生成。 | 该物质中不存在醛基 |
| B | 向淀粉溶液中加适量20%  溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
| C | 取少量 样品溶于蒸馏水,加入足量稀盐酸,再加入足量 样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液,若有白色沉淀产生。 溶液,若有白色沉淀产生。 | 则该 样品已经变质 样品已经变质 |
| D | 向 溶液中滴加 溶液中滴加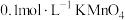 溶液,溶液褪色 溶液,溶液褪色 |  具有氧化性 具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-06-27更新
|
188次组卷
|
2卷引用:浙江省温州新力量联盟2021-2022学年高二下学期期末联考化学试题
7 . 某研究小组根据文献模拟利用氨浸法从某钢铁厂烟灰(主要成分为ZnO,并含有少量的CuO、Fe2O3等)中制备碱式碳酸锌,并测定其组成的流程如下:
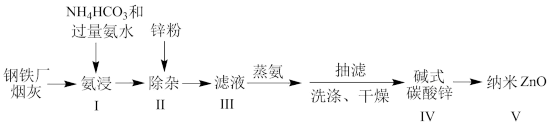
已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2 →Zn(NH3)
→Zn(NH3) +H2O
+H2O
Zn(NH3) →Zn2++4NH3
→Zn2++4NH3
Zn2++2OH-→Zn(OH)2↓
Zn2++ →ZnCO3↓
→ZnCO3↓
(1)“氨浸”时加入过量氨水的目的:
①使HCO 转化为
转化为 :
:
②_______ 。
(2)下列说法不正确的是_______。
(3)I、该研究小组利用步骤V对碱式碳酸锌[Zn3(OH)m(CO3)n(其中m。n为整数)]组成进行测定,从下列选项中选出合理的操作并排序:坩埚预处理后将样品放入坩埚中称量,再置于高温炉中加热→_______→_______→_______→_______→_______。_______
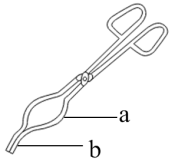
①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
①根据数据计算该碱式碳酸锌的化学式_______ 。
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式_______ 。

已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2
 →Zn(NH3)
→Zn(NH3) +H2O
+H2OZn(NH3)
 →Zn2++4NH3
→Zn2++4NH3Zn2++2OH-→Zn(OH)2↓
Zn2++
 →ZnCO3↓
→ZnCO3↓(1)“氨浸”时加入过量氨水的目的:
①使HCO
 转化为
转化为 :
:②
(2)下列说法不正确的是_______。
| A.步骤I可以采用加热方式来加快浸出速率,提高浸出量 |
| B.步骤II过滤得到的滤渣中含有Cu、Fe、Zn |
| C.步骤III蒸氨过程产生气体除了氨气还有CO2,冷凝后得到的碳化氨水循环用于氨浸 |
| D.步骤IV洗涤时可先用浓氨水洗涤,减少固体溶解,再用无水乙醇洗涤 |

①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
| 电子天平视数/g | |
| 空坩埚 | 19.2500 |
| 空坩埚+样品 | 25.7100 |
| 第一次灼烧后称量 | 24.3251 |
| 第二次灼烧后称量 | 24.1414 |
| 第三次灼烧后称量 | 24.1101 |
| 第四次灼烧后称量 | 24.1100 |
| 第五次灼烧后称量 | 24.1099 |
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式
您最近一年使用:0次
2021-09-17更新
|
709次组卷
|
4卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题(已下线)解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)2021年湖北高考化学试题变式题11-192020年全国卷Ⅰ理综化学高考真题变式题
名校
8 . 下列实验操作、现象和所得到的结论均正确的是
| 选项 | 实验内容 | 实验结论 |
| A | 将Fe(NO3)2样品溶于稀HNO3溶液中,加入KSCN溶液,显红色 | Fe(NO3)2已经氧化变质 |
| B | 用pH试纸测定同浓度的NaCl和NaF溶液的pH,pH(NaCl)<pH(NaF) | 结合H+能力:Cl-<F- |
| C | 取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI和FeCl3反应有一定限度 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-02-23更新
|
218次组卷
|
3卷引用:浙江省宁波市奉化区2021-2022学年高二上学期期末联考化学试题
名校
9 . 下列方案设计、现象和结论有不正确 的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验硫酸厂周边空气中是否含有二氧化硫 | 用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,观察溶液颜色变化 | 若溶液不变色,说明空气中不含二氧化硫 |
| B | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 若有白色沉淀产生,则样品已变质 |
| C | 探究钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2mL蒸馏水 | 若无气体生成,则固体粉末为Na2O;若有气体生成,则固体粉末为Na2O2 |
| D | 检验某样品中是否含Cl- | 取少量样品加稀硝酸酸化,再加硝酸银溶液,振荡,观察溶液变化 | 若出现白色沉淀,则说明有Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热,冷却后,取少量溶液,加入AgNO3溶液 | 若有沉淀产生,则CH3CH2Br发生水解 |
| B | 比较Br2和I2的氧化性强弱 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置 | 若下层液体呈紫红色,则Br2的氧化性强于I2 |
| C | 检验Fe(NO3)2晶体是否氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 若溶液变红,则Fe(NO3)2晶体已氧化变质 |
| D | 比较HNO2和CH3COOH电离出H+的能力 | 用pH试纸分别测CH3COONa溶液和NaNO2溶液的pH | 若CH3COONa溶液的pH比NaNO2溶液的pH大,则HNO2电离出H+的能力比CH3COOH的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



