1 . 已知磺酰氯(SO2Cl2)是一种有机氯化物,也是锂电池正极活性物质,SO2Cl2是一种无色液体,熔点—54.1 ℃,沸点69.1 ℃,极易水解,遇潮湿空气会产生白雾。磺酰氯(SO2Cl2)的制备方法及装置图如下:SO2(g)+Cl2(g)  SO2C12(g)
SO2C12(g)  H<0,
H<0,
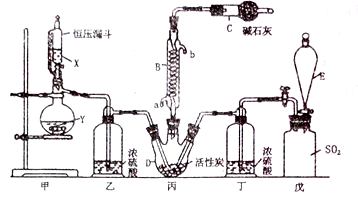
(1)化合物SO2Cl2中S元素的化合价是_________________ 。
(2)仪器D的名称是____________ ,仪器C的作用除了吸收氯气和二氧化硫,还具有__________ 作用。
(3)戊是贮气装置,则E中的溶液是____________ ;若缺少装置乙和丁,则产物变质,发生反应的化学方程式是__________________________
(4)反应结束后,将丙中混合物分离开的实验操作是________ 。
(5)有关该实验叙述正确的是________
a、X、Y最好的席间组合是铜片和浓硫酸
b、活性炭的作用是作催化剂
c、冷凝管B也可以用作蒸馏
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为: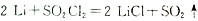 ,则电池工作时,正极的电极反应式为是
,则电池工作时,正极的电极反应式为是__________________________

 SO2C12(g)
SO2C12(g) 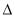 H<0,
H<0,
(1)化合物SO2Cl2中S元素的化合价是
(2)仪器D的名称是
(3)戊是贮气装置,则E中的溶液是
(4)反应结束后,将丙中混合物分离开的实验操作是
(5)有关该实验叙述正确的是
a、X、Y最好的席间组合是铜片和浓硫酸
b、活性炭的作用是作催化剂
c、冷凝管B也可以用作蒸馏
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:
 ,则电池工作时,正极的电极反应式为是
,则电池工作时,正极的电极反应式为是
您最近一年使用:0次
名校
解题方法
2 . 碱式碳酸铜[Cu2(OH)2CO3](Mr=222)是一种草绿色晶体,可用于铜盐、油漆和烟花的制备。实验室制备碱式碳酸铜的步骤如下:
I.分别配制0.50mol∙L-1CuSO4溶液和0.50mol∙L-1Na2CO3溶液。
II.将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75℃,搅拌15min。
IV.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤I中,配制0.50mol∙L-1CuSO4溶液时,不需要使用下列仪器中的_______ (填仪器名称)。
(2)步骤II中,若误将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成蓝色的Cu4(SO4)(OH)6∙2H2O晶体,其反应的离子方程式为_______ 。
(3)步骤III中,若温度高于90℃,产品中混有的黑色固体是_______ 。
(4)步骤IV中,检验沉淀是否洗涤干净的试剂是_______ ;称得产品的质量为1.332g,则该实验所得碱式碳酸铜的产率是_______ 。
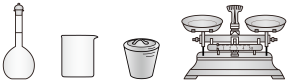
(5)对样品进行热重分析得到的曲线如下图所示,则铜元素的质量分数是_______ ,与理论值相差不大。使用_______ 实验可进一步测定样品的晶体结构。
I.分别配制0.50mol∙L-1CuSO4溶液和0.50mol∙L-1Na2CO3溶液。
II.将30mLCuSO4溶液和36mL Na2CO3溶液混合、搅拌均匀。
III.将II的混合溶液加热至75℃,搅拌15min。
IV.静置使产物沉淀完全后,抽滤、洗涤、干燥、称重,分析样品组成和晶体结构。
回答下列问题:
(1)步骤I中,配制0.50mol∙L-1CuSO4溶液时,不需要使用下列仪器中的

(2)步骤II中,若误将CuSO4溶液与Na2CO3溶液等体积混合,二者恰好完全反应,生成蓝色的Cu4(SO4)(OH)6∙2H2O晶体,其反应的离子方程式为
(3)步骤III中,若温度高于90℃,产品中混有的黑色固体是
(4)步骤IV中,检验沉淀是否洗涤干净的试剂是
(5)对样品进行热重分析得到的曲线如下图所示,则铜元素的质量分数是

您最近一年使用:0次
2022-09-17更新
|
501次组卷
|
3卷引用:河南省安阳市汤阴一中2023-2024学年高三上学期12月阶段检测化学试题
解题方法
3 . 一氧化碳是无色、无味的有毒气体,是C1化学的基础,在冶金工业中用作还原剂。回答下列问题:
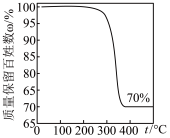
I.某学习小组拟探究CO2和锌粒反应是否生成CO,实验装置如图所示:
已知:i.CO能与银氨溶液[Ag(NH3)2OH]反应产生黑色固体;
ii.银可溶于浓硝酸;
iii..上述瓶中试剂均足量。
回答下列问题:
(1)按气流从左到右的方向,装置的连接顺序为a→____ (填仪器接口小写字母)。
(2)装置连接好后,装药品之前的操作为____ ;实验结束时,应____ (填字母)。
A.先熄灭酒精灯,再关闭活塞K;
B.先关闭活塞K,再熄灭酒精灯
(3)装置D中氢氧化钠溶液的作用是____ (用离子方程式表示)。
(4)反应结束后装置D中银氨溶液瓶底产生黑色沉淀,为验证产物,分离出上层清液和底部黑色固体,并进行如下实验:
a.测得上层清液的pH=10;
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润的红色石蕊试纸变蓝的气体;
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象;
d.将黑色沉淀用蒸馏水洗净。
①根据上述实验现象判断,上层清液中含有NH3·H2O和____ (填化学式)。
②设计实验证明黑色固体是Ag单质,其操作为____ 。
③CO与银氨溶液反应中有NH3生成,结合实验现象写出该反应的化学方程式:____ 。
II.测定某气体样品中CO含量的方法如下:将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水—乙醇混合液充分溶解产物I2,定容到100mL。取25.00mL,用0.0100mol·L-1Na2S2O3标准溶液滴定,消耗标准溶液的体积为20.00mL(已知:2NaS2O3+I2=2NaI+Na2S4O6;气体样品中其他成分与I2O5,不反应)。
(5)气体样品中CO的体积分数为____ 。
I.某学习小组拟探究CO2和锌粒反应是否生成CO,实验装置如图所示:

已知:i.CO能与银氨溶液[Ag(NH3)2OH]反应产生黑色固体;
ii.银可溶于浓硝酸;
iii..上述瓶中试剂均足量。
回答下列问题:
(1)按气流从左到右的方向,装置的连接顺序为a→
(2)装置连接好后,装药品之前的操作为
A.先熄灭酒精灯,再关闭活塞K;
B.先关闭活塞K,再熄灭酒精灯
(3)装置D中氢氧化钠溶液的作用是
(4)反应结束后装置D中银氨溶液瓶底产生黑色沉淀,为验证产物,分离出上层清液和底部黑色固体,并进行如下实验:
a.测得上层清液的pH=10;
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润的红色石蕊试纸变蓝的气体;
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象;
d.将黑色沉淀用蒸馏水洗净。
①根据上述实验现象判断,上层清液中含有NH3·H2O和
②设计实验证明黑色固体是Ag单质,其操作为
③CO与银氨溶液反应中有NH3生成,结合实验现象写出该反应的化学方程式:
II.测定某气体样品中CO含量的方法如下:将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水—乙醇混合液充分溶解产物I2,定容到100mL。取25.00mL,用0.0100mol·L-1Na2S2O3标准溶液滴定,消耗标准溶液的体积为20.00mL(已知:2NaS2O3+I2=2NaI+Na2S4O6;气体样品中其他成分与I2O5,不反应)。
(5)气体样品中CO的体积分数为
您最近一年使用:0次
名校
解题方法
4 . 六氨合氯化镁(MgCl2•6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组以MgCl2•6H2O为原料在实验室制备MgCl2•6NH3,并测定所得产品中氯的含量
(一)制备MgCl2•6NH3
I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
(1)滴液漏斗中支管的作用为___________ 。
(2)三颈瓶中发生反应的化学方程式为___________ 。
(3)该实验装置中的不足之处为___________ 。
II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应(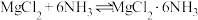 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
(4)生成MgCl2•6NH3的反应需在冰水浴中进行,其可能原因有___________(填字母)。
(5)洗涤产品时,应选择的洗涤剂为___________(填字母)。
(二)测定产品中氯的含量,步骤如下:
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20 的AgNO3标准液滴定溶液中
的AgNO3标准液滴定溶液中 ,记录消耗标准液的体积;
,记录消耗标准液的体积;
步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(6)步骒1中,用稀硝酸溶解样品的目的为___________ 。
(7)该品中氯的质量分数为___________ (保留小数点后2位);该实验值与理论值(36.04%)有偏差,造成该偏差的可能原因是(已知滴定操作均正确)___________ 。
(一)制备MgCl2•6NH3
I.首先制备无水MgCl2实验装置如下图(加热及夹持装置略去):

已知:SOCl2:熔点
 105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。
105℃、沸点76℃;遇水剧烈水解生成两种酸性气体。(1)滴液漏斗中支管的作用为
(2)三颈瓶中发生反应的化学方程式为
(3)该实验装置中的不足之处为
II.将NH3通入无水MgCl2的乙二醇溶液中,充分反应(
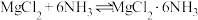 )后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
)后,过滤、洗涤并自然风干,制得粗品。相关物质的性质如表:
| NH3 | MgCl2 | MgCl2•NH3 |
| 水 | 易溶 | 易溶 | 易溶 |
| 甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
| 乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
| A.反应吸热,促进反应正向进行 | B.加快反应速率 |
| C.防止氨气挥发,提高氨气利用率 | D.降低产物的溶解度 |
| A.冰浓氨水 | B.乙二醇和水的混合液 |
| C.氨气饱和的甲醇溶液 | D.氨气饱和的乙二醇溶液 |
(二)测定产品中氯的含量,步骤如下:
步骤1:称取1.80g样品,加入足量稀硝酸溶解,配成250mL溶液;
步骤2:取25.00mL待测液于锥形瓶中,以K2CrO4为指示剂,用0.20
 的AgNO3标准液滴定溶液中
的AgNO3标准液滴定溶液中 ,记录消耗标准液的体积;
,记录消耗标准液的体积;步骤3:重复步骤2操作2~3次,平均消耗标准液10.00 mL。
(6)步骒1中,用稀硝酸溶解样品的目的为
(7)该品中氯的质量分数为
您最近一年使用:0次
2022-05-10更新
|
465次组卷
|
7卷引用:河南省商丘市2022届高三下学期第三次模拟考试化学试题
河南省商丘市2022届高三下学期第三次模拟考试化学试题(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)化学(福建B卷)-学易金卷:2023年高考第一次模拟考试天津市耀华中学2022-2023学年高三上学期第三次月考化学试题湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题
解题方法
5 . 钾铬矾在鞣革、纺织等工业中应用广泛。某学习小组用温控电炉加热钾铬矾晶体探究分析其分解产物,实验设计如下。
已知:钾铬矾[K2SO4·Cr2(SO4)3·24H2O]的相对分子质量为998。Cr2O3为两性氧化物。
I.定性探究钾铬矾晶体的热分解产物。装置图如下(夹持装置略去)。

实验步骤如下。回答下列问题:
(1)连接装置,然后进行的实验操作为_______ 。
①上图中各仪器正确的连接顺序:A→_______ (填标号)。
②盛放碱石灰的玻璃仪器名称为_______ 。
(2)加入试剂,然后缓缓通入N2,排出装置内空气。用温控电炉在不同温度下加热,分解产物(足量)依次通过各装置。若气体通过装置B发现BaCl2溶液产生白色沉淀,品红溶液不褪色,则分解所得气体产物中含有_______ (填化学式)。
II.定量分析钾铬矾晶体的热分解过程。取99.80 g钾铬矾样品不断加热,样品受热分解过程的热重曲线(固体样品质量随温度变化的曲线)如图所示。
(3)200℃时固体w的化学式为_______ 。
(4)在620℃时得到固体产物q及气体R,气体R能全部被盐酸酸化的BaCl2溶液吸收并得到白色沉淀。固体q可部分溶于水,过滤后得到固体e和滤液f,向滤液f中加入盐酸酸化的BaCl2溶液也得到白色沉淀;将固体e置于适量的NaOH溶液中恰好反应得到澄清的溶液,则固体q中的成分是_______ (填化学式),607~620 ℃时发生反应的化学方程式为_______ 。
已知:钾铬矾[K2SO4·Cr2(SO4)3·24H2O]的相对分子质量为998。Cr2O3为两性氧化物。
I.定性探究钾铬矾晶体的热分解产物。装置图如下(夹持装置略去)。

实验步骤如下。回答下列问题:
(1)连接装置,然后进行的实验操作为
①上图中各仪器正确的连接顺序:A→
②盛放碱石灰的玻璃仪器名称为
(2)加入试剂,然后缓缓通入N2,排出装置内空气。用温控电炉在不同温度下加热,分解产物(足量)依次通过各装置。若气体通过装置B发现BaCl2溶液产生白色沉淀,品红溶液不褪色,则分解所得气体产物中含有
II.定量分析钾铬矾晶体的热分解过程。取99.80 g钾铬矾样品不断加热,样品受热分解过程的热重曲线(固体样品质量随温度变化的曲线)如图所示。

(3)200℃时固体w的化学式为
(4)在620℃时得到固体产物q及气体R,气体R能全部被盐酸酸化的BaCl2溶液吸收并得到白色沉淀。固体q可部分溶于水,过滤后得到固体e和滤液f,向滤液f中加入盐酸酸化的BaCl2溶液也得到白色沉淀;将固体e置于适量的NaOH溶液中恰好反应得到澄清的溶液,则固体q中的成分是
您最近一年使用:0次
名校
解题方法
6 . 三氯化六氨合钴(III)([Co(NH3)6]Cl3,钴为+3价)在钴化合物的合成中是重要原料。实验室以CoCl2为原料制备[Co(NH3)6]Cl3,步骤如下:
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。
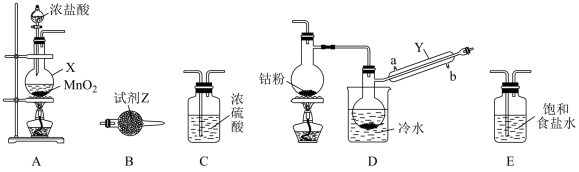
(1)仪器X的名称为____ 。
(2)X中发生反应的离子方程式为____ 。
(3)装置的连接顺序为A→____ →B;反应开始前应先点燃A处的酒精灯,其目的是___ 。
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是____ 。
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为____ 。
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
则该氧化还原滴定指示剂为____ ,该样品中钴元素的质量分数为____ 。
I.CoCl2的制备。
CoCl2可以通过钴和氯气反应制得,实验室制备纯净CoCl2可用如图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,CoCl2易潮解)。

(1)仪器X的名称为
(2)X中发生反应的离子方程式为
(3)装置的连接顺序为A→
II.[Co(NH3)6]Cl3的制备。
在100mL锥形瓶内加入4.5g研细的二氯化钴CoCl2,3gNH4Cl和5mL水,加热溶解后加入0.3g活性炭作催化剂,冷却后,通入足量NH3,混合均匀;控制温度在10℃以下,缓慢加入10mL10%的H2O2,然后加热至60℃左右,恒温20分钟,适当摇动锥形瓶:在冰水中冷却所得溶液,即有晶体析出(粗产品)。回答下列问题:
(4)该过程中控制温度为60℃的方法是
(5)制备[Co(NH3)6]Cl3的总反应化学方程式为
III.测定[Co(NH3)6]Cl3中钴的含量。
(6)原理:利用Co3+将KI氧化成I2,Co3+被还原后的产物为Co2+。然后用0.015mol•L-1Na2S2O3标准溶液滴定生成的I2,Na2S2O3所得产物为S4O
 。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。
。若称取样品的质量为0.27g,滴定I2时,达到终点消耗Na2S2O3标准溶液的平均体积为54.00mL。则该氧化还原滴定指示剂为
您最近一年使用:0次
2022-09-20更新
|
246次组卷
|
2卷引用:河南省确山县第二高级中学2021-2022学年高三上学期期中考试化学试题
名校
解题方法
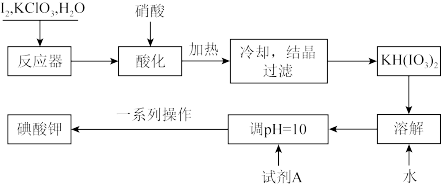
7 . 我国规定,食盐中加入KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图:
请回答下列问题:
(1)试剂A是____ ;流程图中“一系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤、干燥。其中,“洗涤剂”是75%的酒精,而不用蒸馏水,其主要原因是____ 。
(2)工业上,还可用电解法制取KIO3。以石墨和不锈钢为电极材料,电解KI溶液。化学方程式为KI+3H2O KIO3+3H2↑。在该反应中,氧化产物是
KIO3+3H2↑。在该反应中,氧化产物是____ 。
(3)常用KI淀粉试纸检验碘盐,其操作是:取少量样品溶于蒸馏水,加几滴食醋,用KI淀粉试纸蘸取该溶液,若变蓝色,则该盐为加碘盐。写出离子方程式____ 。
(4)测定产品纯度:取wg产品溶于蒸馏水,配制成250mL溶液。取20mL所配制溶液于锥形瓶中,加入过量的KI溶液,滴适量稀硫酸,再滴加几滴指示剂B,用cmol·L-1Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①根据上述数据,测得产品纯度为____ (用含w、c、V表达式表示)。
②为了充分反应,滴定之前需要“振荡”锥形瓶中溶液,如果振荡时间过长,测得结果会____ (填“偏高”、“偏低”或“无影响”)。

请回答下列问题:
(1)试剂A是
(2)工业上,还可用电解法制取KIO3。以石墨和不锈钢为电极材料,电解KI溶液。化学方程式为KI+3H2O
 KIO3+3H2↑。在该反应中,氧化产物是
KIO3+3H2↑。在该反应中,氧化产物是(3)常用KI淀粉试纸检验碘盐,其操作是:取少量样品溶于蒸馏水,加几滴食醋,用KI淀粉试纸蘸取该溶液,若变蓝色,则该盐为加碘盐。写出离子方程式
(4)测定产品纯度:取wg产品溶于蒸馏水,配制成250mL溶液。取20mL所配制溶液于锥形瓶中,加入过量的KI溶液,滴适量稀硫酸,再滴加几滴指示剂B,用cmol·L-1Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。①根据上述数据,测得产品纯度为
②为了充分反应,滴定之前需要“振荡”锥形瓶中溶液,如果振荡时间过长,测得结果会
您最近一年使用:0次
2022-07-29更新
|
208次组卷
|
3卷引用:河南省焦作市修武县第一中学2022-2023学年高二上学期定位考试化学试题
解题方法
8 . 实验室用环己醇(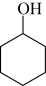 )与 85%磷酸在共热条件下制取环己烯(
)与 85%磷酸在共热条件下制取环己烯(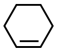 ),制取装置如图所示(加热及夹持装置略)。
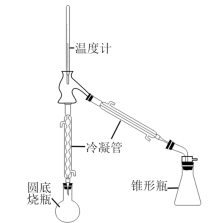
),制取装置如图所示(加热及夹持装置略)。
实验药品的物理性质:
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
Ⅰ.环己烯制备实验步骤如下:
步骤1:在干燥的圆底烧瓶中,加入10 mL环己醇、5 mL 85%磷酸,充分振摇、混合均匀,加入几粒沸石,按图示安装好反应装置,用锥形瓶作接收器。
步骤2:将烧瓶在石棉网上用小火慢慢加热,控制加热,使温度不超过95℃,馏出液为带水的混合物:当烧瓶中只剩下很少量的残液并出现白雾时,停止蒸馏。
步骤3:将蒸馏液分去水层,加入等体积的饱和食盐水,充分振荡后静置,分液:加入适量无水氯化钙干燥。
步骤4:将干燥后的产物注入干燥的蒸馏烧瓶中,加入沸石,加热蒸馏,收集80~ 85℃的馏分,称重为6.0g。
(1)该反应有副反应发生(产物为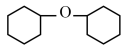 ), 反应的化学方程式为
), 反应的化学方程式为_______ 。
(2)85%H3PO4在反应中的作用是_______ ;该反应也可选用浓硫酸,选择85%磷酸而不用浓硫酸的原因为_______ 。
(3)“步骤2”中控制加热,使温度不超过95℃,其原因为_______ 。
(4)本实验的产率是_______ (保留三位有效数字)。
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入bmolBr2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用cmol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液VmL(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
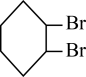
①Br2+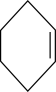 →
→
②Br2+2KI= I2+2KBr
③I2+2Na2S2O3= 2NaI+Na2S4O6
(5)滴定所用指示剂为_______ 。样品中环己烯的质量分数为_______ (用字母表示)。
(6)下列情况会导致测定结果偏低的是_______ (填序号)。
a.样品中含有环己二烯杂质
b.在测定过程中部分环己烯挥发
c. Na2S2O3 标准溶液部分被氧化
 )与 85%磷酸在共热条件下制取环己烯(
)与 85%磷酸在共热条件下制取环己烯( ),制取装置如图所示(加热及夹持装置略)。
),制取装置如图所示(加热及夹持装置略)。
实验药品的物理性质:
| 名称 | 密度(g·mL-1 ) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
| 环己烯 | 0.81 | - 103 | 83 | 不溶于水 |
| 85%H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
Ⅰ.环己烯制备实验步骤如下:
步骤1:在干燥的圆底烧瓶中,加入10 mL环己醇、5 mL 85%磷酸,充分振摇、混合均匀,加入几粒沸石,按图示安装好反应装置,用锥形瓶作接收器。
步骤2:将烧瓶在石棉网上用小火慢慢加热,控制加热,使温度不超过95℃,馏出液为带水的混合物:当烧瓶中只剩下很少量的残液并出现白雾时,停止蒸馏。
步骤3:将蒸馏液分去水层,加入等体积的饱和食盐水,充分振荡后静置,分液:加入适量无水氯化钙干燥。
步骤4:将干燥后的产物注入干燥的蒸馏烧瓶中,加入沸石,加热蒸馏,收集80~ 85℃的馏分,称重为6.0g。
(1)该反应有副反应发生(产物为
 ), 反应的化学方程式为
), 反应的化学方程式为(2)85%H3PO4在反应中的作用是
(3)“步骤2”中控制加热,使温度不超过95℃,其原因为
(4)本实验的产率是
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入bmolBr2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用cmol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液VmL(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①Br2+
 →
→
②Br2+2KI= I2+2KBr
③I2+2Na2S2O3= 2NaI+Na2S4O6
(5)滴定所用指示剂为
(6)下列情况会导致测定结果偏低的是
a.样品中含有环己二烯杂质
b.在测定过程中部分环己烯挥发
c. Na2S2O3 标准溶液部分被氧化
您最近一年使用:0次
名校
9 . “7•20”特大洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效措施之一。“84”消毒液、漂白粉和ClO2等都是有效的消杀试剂。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理____ ,标况下56L氯气完全被吸收,需要____ L1mol/L的NaOH溶液。
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为_____ 。
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论____ (填“同意”或“不同意”),若不同意,你认为的结论是____ (若同意,此空不用填)
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是_____ (从①②③中选填)。
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为_____ 。ClO2还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式_____ 。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为
您最近一年使用:0次
真题
名校
10 . 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3,质量为1.02g。计算:
(1)x=_______ (写出计算过程)。
(2)气体产物中n(O2)_______ mol。
(1)x=
(2)气体产物中n(O2)
您最近一年使用:0次
2022-01-12更新
|
4660次组卷
|
7卷引用:河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题
河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)2022年浙江1月高考真题变式题(26-31)(已下线)微专题04 以物质的量为中心的计算-备战2023年高考化学一轮复习考点微专题浙江省东阳市横店高级中学2022-2023学年高三上学期10月份检测化学试题(已下线)微专题 化学计算的思想方法(已下线)第03讲 物质的量在化学方程式计算中的应用(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)




