1 . 河南省镁资源丰富,河南崮山镁业为国内最大的氧化镁生产企业,其利用蛇纹石制备的高纯氧化镁,颗粒细腻不结团。其工艺流程如下:

某校化学兴趣小组在实验室探究流程II中的反应原理,并检验产物纯度。回答下列问题:
(1)甲同学设计了以下实验装置图探究流程II中的反应原理。
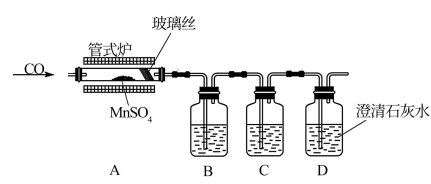
①检验气态产物中是否有SO2及SO3,则装置B、C中的溶液分别是_______ (填标号)。
a.Ba(NO3)2溶液 b.BaCl2溶液 c.浓硫酸 d.酸性高锰酸钾溶液
②实验过程中,装置B中没有明显现象,装置C、D中现象明显,写出A中发生反应的化学方程式:_______ 。
(2)乙同学认为甲设计的实验装置存在一处明显的缺陷,其理由是_______ 。
(3)丙同学利用反应:HCOOH CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
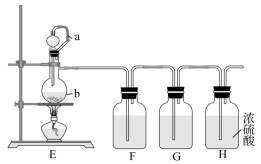
①E装置中,仪器b的名称是_______ 。
②制备的CO气体中常含有杂质气体_______ 、挥发出来的少量甲酸蒸气及水蒸气,已知F装置中盛放的是NaOH溶液,G装置中盛放的是澄清的石灰水,则G装置的作用是_______ 。
(4)Mg2+的含量测定:向含Mg2+的溶液中加入铬黑T溶液(含Hlnd2-离子)作指示剂,用EDTA标准溶液(含H2Y2-离子)滴定。溶液中发生的反应如下: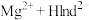 (天蓝色)
(天蓝色)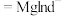 (酒红色)+H+,
(酒红色)+H+, 。丁同学称取4.1g样品MgO,溶于稀硫酸,移入1000mL容量瓶中稀释至刻度。取20 mL溶液于锥形瓶中,加2滴铬黑T溶液,用0.1000
。丁同学称取4.1g样品MgO,溶于稀硫酸,移入1000mL容量瓶中稀释至刻度。取20 mL溶液于锥形瓶中,加2滴铬黑T溶液,用0.1000 EDTA溶液滴定,实验数据如下。
EDTA溶液滴定,实验数据如下。
①滴定终点的现象是_______ 。
②计算4.1 g样品MgO中镁离子的物质的量为_______ mol(保留两位有效数字)。

某校化学兴趣小组在实验室探究流程II中的反应原理,并检验产物纯度。回答下列问题:
(1)甲同学设计了以下实验装置图探究流程II中的反应原理。

①检验气态产物中是否有SO2及SO3,则装置B、C中的溶液分别是
a.Ba(NO3)2溶液 b.BaCl2溶液 c.浓硫酸 d.酸性高锰酸钾溶液
②实验过程中,装置B中没有明显现象,装置C、D中现象明显,写出A中发生反应的化学方程式:
(2)乙同学认为甲设计的实验装置存在一处明显的缺陷,其理由是
(3)丙同学利用反应:HCOOH
 CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
CO↑+H2O为甲同学的实验提供CO气体,并设计以下实验装置图。
①E装置中,仪器b的名称是
②制备的CO气体中常含有杂质气体
(4)Mg2+的含量测定:向含Mg2+的溶液中加入铬黑T溶液(含Hlnd2-离子)作指示剂,用EDTA标准溶液(含H2Y2-离子)滴定。溶液中发生的反应如下:
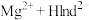 (天蓝色)
(天蓝色)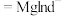 (酒红色)+H+,
(酒红色)+H+, 。丁同学称取4.1g样品MgO,溶于稀硫酸,移入1000mL容量瓶中稀释至刻度。取20 mL溶液于锥形瓶中,加2滴铬黑T溶液,用0.1000
。丁同学称取4.1g样品MgO,溶于稀硫酸,移入1000mL容量瓶中稀释至刻度。取20 mL溶液于锥形瓶中,加2滴铬黑T溶液,用0.1000 EDTA溶液滴定,实验数据如下。
EDTA溶液滴定,实验数据如下。| 序号 | 1 | 2 | 3 | 4 |
| 标准溶液体积/mL | 20.10 | 18.40 | 19.90 | 20.00 |
②计算4.1 g样品MgO中镁离子的物质的量为
您最近一年使用:0次
2022-01-11更新
|
492次组卷
|
2卷引用:河南省名校联盟2021-2022学年高三上学期1月联合考试化学试题
2021高三·全国·专题练习
名校
解题方法
2 . 高纯氧化铁性能稳定,无毒、无臭、无味,是食品、药品、化妆品常用着色剂。
某实验小组用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,以萃取剂Y(甲基异丁基甲酮)萃取法制取高纯氧化铁。实验过程中的主要操作步骤如下:
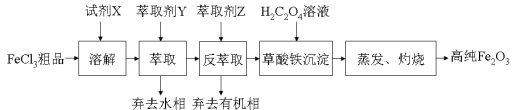
已知:试剂X是浓盐酸,HCl(浓)+FeCl3⇌HFeCl4
请回答下列问题:
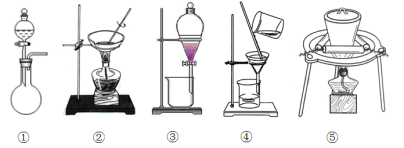
(1)据上述实验操作过程判断,下列实验装置中,没有用到的是_______ (填序号)
(2)用萃取剂Y萃取的步骤中:
①Ca、Mn、Cu等杂质离子几乎都在_______ (填“水”或“有机”)相中。
②实验时分3次萃取并合并萃取液,这样操作的目的是_______ 。
③以下关于萃取分液操作的叙述中,不正确 的是_______ 。
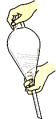
a.溶液中加入Y,转移至分液漏斗中,塞上玻璃塞,如图用力振摇
b.振摇几次后需打开分液漏斗上口的玻璃塞放气
c.经几次振摇并放气后,手持分液漏斗静置待液体分层
d.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(3)下列试剂中,作反萃取剂Z的最佳选择是_______ ,反萃取能发生的原因是_______ 。
a.高纯水b.盐酸c.稀硫酸d.酒精
(4)据上述实验操作过程判断,本实验若用适量Na2C2O4溶液代替H2C2O4溶液,是否合理并请说明理由_______ 。
(5)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定(还原产物是Cr3+)。现准确称取Wg样品经酸溶、还原为Fe2+,用0.1000mol•L-1的标准溶液进行滴定。
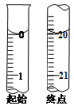
①滴定起始和终点的液面位置如图,则消耗K2Cr2O7标准溶液体积为_______ mL。
②产品中铁的含量为_______ (假设杂质不与K2Cr2O7反应)。
某实验小组用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,以萃取剂Y(甲基异丁基甲酮)萃取法制取高纯氧化铁。实验过程中的主要操作步骤如下:

已知:试剂X是浓盐酸,HCl(浓)+FeCl3⇌HFeCl4
请回答下列问题:
(1)据上述实验操作过程判断,下列实验装置中,没有用到的是

(2)用萃取剂Y萃取的步骤中:
①Ca、Mn、Cu等杂质离子几乎都在
②实验时分3次萃取并合并萃取液,这样操作的目的是
③以下关于萃取分液操作的叙述中,

a.溶液中加入Y,转移至分液漏斗中,塞上玻璃塞,如图用力振摇
b.振摇几次后需打开分液漏斗上口的玻璃塞放气
c.经几次振摇并放气后,手持分液漏斗静置待液体分层
d.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(3)下列试剂中,作反萃取剂Z的最佳选择是
a.高纯水b.盐酸c.稀硫酸d.酒精
(4)据上述实验操作过程判断,本实验若用适量Na2C2O4溶液代替H2C2O4溶液,是否合理并请说明理由
(5)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定(还原产物是Cr3+)。现准确称取Wg样品经酸溶、还原为Fe2+,用0.1000mol•L-1的标准溶液进行滴定。

①滴定起始和终点的液面位置如图,则消耗K2Cr2O7标准溶液体积为
②产品中铁的含量为
您最近一年使用:0次
2021-08-10更新
|
349次组卷
|
5卷引用:河南省南阳市第一中学校2022-2023学年高三上学期第一次月考化学试题
河南省南阳市第一中学校2022-2023学年高三上学期第一次月考化学试题河南省鹤壁市高中2022-2023学年高二上学期10月居家测试化学试题(已下线)考点29 化学实验基础-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点28 化学实验仪器与基本操作-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点49 化学实验基础-备战2023年高考化学一轮复习考点帮(全国通用)
名校
3 . 工业上以铬铁矿(主要成分 ,含
,含 、
、 等少量杂质)为主要原料制备红矾钠(
等少量杂质)为主要原料制备红矾钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:

(1)“焙烧”的目的是将 转化为
转化为 和
和 ,并将
,并将 、
、 转化为可溶性钠盐。写出将
转化为可溶性钠盐。写出将 转化为
转化为 和
和 反应的化学方程式:
反应的化学方程式:_______ ;该过程中将气体与矿料逆流而行,目的是_______ 。
(2)矿物中相关元素可溶性组分物质的量浓度c与 的关系如图所示。当溶液中可溶组分浓度
的关系如图所示。当溶液中可溶组分浓度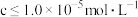 时,可认为已除尽。
时,可认为已除尽。

滤渣Ⅰ为_______ ;“中和”时 的理论范围为
的理论范围为_______ ;“酸化”的目的是_______ 。
(3)根据图中红矾钠( )和
)和 的溶解度曲线分析,副产品X为
的溶解度曲线分析,副产品X为_______ 。“冷却结晶”所得母液中,除 外,可在上流程中循环利用的物质还有
外,可在上流程中循环利用的物质还有_______ (除 外)。
外)。

(4)称取红矾钠样品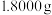 配成
配成 溶液,量取
溶液,量取 于碘量瓶中,加入
于碘量瓶中,加入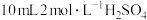 和足量碘化钾溶液(铬的还原产物为
和足量碘化钾溶液(铬的还原产物为 ),放于暗处
),放于暗处 ,加入淀粉溶液作指示剂,用
,加入淀粉溶液作指示剂,用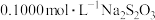 标准溶液滴定(
标准溶液滴定( ),判断达到滴定终点的现象是
),判断达到滴定终点的现象是_______ 。若实验中平均消耗 标准溶液
标准溶液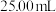 ,则
,则 的纯度为
的纯度为_______ %(设整个过程中其他杂质不参与反应,保留小数点后一位)。
 ,含
,含 、
、 等少量杂质)为主要原料制备红矾钠(
等少量杂质)为主要原料制备红矾钠( )的工艺流程如图。回答下列问题:
)的工艺流程如图。回答下列问题:
(1)“焙烧”的目的是将
 转化为
转化为 和
和 ,并将
,并将 、
、 转化为可溶性钠盐。写出将
转化为可溶性钠盐。写出将 转化为
转化为 和
和 反应的化学方程式:
反应的化学方程式:(2)矿物中相关元素可溶性组分物质的量浓度c与
 的关系如图所示。当溶液中可溶组分浓度
的关系如图所示。当溶液中可溶组分浓度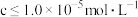 时,可认为已除尽。
时,可认为已除尽。
滤渣Ⅰ为
 的理论范围为
的理论范围为(3)根据图中红矾钠(
 )和
)和 的溶解度曲线分析,副产品X为
的溶解度曲线分析,副产品X为 外,可在上流程中循环利用的物质还有
外,可在上流程中循环利用的物质还有 外)。
外)。
(4)称取红矾钠样品
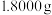 配成
配成 溶液,量取
溶液,量取 于碘量瓶中,加入
于碘量瓶中,加入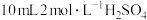 和足量碘化钾溶液(铬的还原产物为
和足量碘化钾溶液(铬的还原产物为 ),放于暗处
),放于暗处 ,加入淀粉溶液作指示剂,用
,加入淀粉溶液作指示剂,用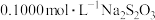 标准溶液滴定(
标准溶液滴定( ),判断达到滴定终点的现象是
),判断达到滴定终点的现象是 标准溶液
标准溶液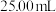 ,则
,则 的纯度为
的纯度为
您最近一年使用:0次
4 . 镍是一种常用的有机合成催化剂。某工厂以含镍废料(主要成分为NiO,还含有少量 、
、 、
、 和
和 等)为原料制备镍的流程如图:
等)为原料制备镍的流程如图:

回答下列问题:
(1)滤渣1的主要成分是_______ (填化学式)。
(2)“氧化”过程中加入 或
或 ,发现氧化效率相等时,实际用量与理论用量的质量差(实际用量大于理论用量):
,发现氧化效率相等时,实际用量与理论用量的质量差(实际用量大于理论用量):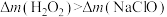 ,可能的原因是
,可能的原因是_______ 。
(3)滤渣2经过一系列操作可得到 ,将
,将 和
和 按物质的量比1:1共热反应可得到无水
按物质的量比1:1共热反应可得到无水 ,并放出两种酸性气体,其中一种能使品红溶液褪色,则总反应的化学方程式为
,并放出两种酸性气体,其中一种能使品红溶液褪色,则总反应的化学方程式为_______ 。
(4)“还原”过程中使用的试剂为 和
和 氧化产物为
氧化产物为 。
。 的电子式为
的电子式为_______ ;“还原”过程中发生反应的离子方程式为_______ 。
(5)若电解某粗镍(含Zn、Fe、Cu、Ag等杂质)提纯镍的装置如图所示。

已知氧化性: 。
。
下列说法错误的是_______ (填字母)。
A.X极为纯镍,Y极为粗镍
B.M可能是
C.X极净增质量等于Y极净减质量
D.X极的电极反应式为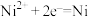
(6)测定镍样品的纯度:取wg镍样品完全溶于稀硫酸,加入 的EDTA溶液,使
的EDTA溶液,使 完全反应,煮沸,加入几滴PAN作指示剂,趁热用
完全反应,煮沸,加入几滴PAN作指示剂,趁热用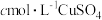 溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,达到滴定终点,消耗
溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,达到滴定终点,消耗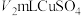 溶液(假设杂质不参与反应),则该镍样品的纯度为
溶液(假设杂质不参与反应),则该镍样品的纯度为_______ %(已知: ,
, )。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果
)。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果_______ (填“偏高”“偏低”或“无影响”)。
 、
、 、
、 和
和 等)为原料制备镍的流程如图:
等)为原料制备镍的流程如图:
回答下列问题:
(1)滤渣1的主要成分是
(2)“氧化”过程中加入
 或
或 ,发现氧化效率相等时,实际用量与理论用量的质量差(实际用量大于理论用量):
,发现氧化效率相等时,实际用量与理论用量的质量差(实际用量大于理论用量):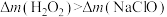 ,可能的原因是
,可能的原因是(3)滤渣2经过一系列操作可得到
 ,将
,将 和
和 按物质的量比1:1共热反应可得到无水
按物质的量比1:1共热反应可得到无水 ,并放出两种酸性气体,其中一种能使品红溶液褪色,则总反应的化学方程式为
,并放出两种酸性气体,其中一种能使品红溶液褪色,则总反应的化学方程式为(4)“还原”过程中使用的试剂为
 和
和 氧化产物为
氧化产物为 。
。 的电子式为
的电子式为(5)若电解某粗镍(含Zn、Fe、Cu、Ag等杂质)提纯镍的装置如图所示。

已知氧化性:
 。
。下列说法错误的是
A.X极为纯镍,Y极为粗镍
B.M可能是

C.X极净增质量等于Y极净减质量
D.X极的电极反应式为
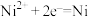
(6)测定镍样品的纯度:取wg镍样品完全溶于稀硫酸,加入
 的EDTA溶液,使
的EDTA溶液,使 完全反应,煮沸,加入几滴PAN作指示剂,趁热用
完全反应,煮沸,加入几滴PAN作指示剂,趁热用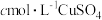 溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,达到滴定终点,消耗
溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,达到滴定终点,消耗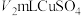 溶液(假设杂质不参与反应),则该镍样品的纯度为
溶液(假设杂质不参与反应),则该镍样品的纯度为 ,
, )。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果
)。如果滴定管用蒸馏水洗涤后未用待装溶液润洗,则测定结果
您最近一年使用:0次
名校
解题方法
5 . 部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是

下列说法正确的是
| A.样品中Fe元素的质量为2.24 g |
| B.滤液A中的阳离子为Fe2+、Fe3+、H+ |
| C.样品中CuO的质量为4.08 g |
| D.V=896 mL |
您最近一年使用:0次
2021-01-25更新
|
368次组卷
|
3卷引用:河南省郑州市维纲中学2022届高三9月月考化学试题
6 . 草酸、KMnO4均是重要的化学分析试剂,某次实验中需要使用480mL0.2000mol/L的草酸溶液,回答下列问题。
(1)实验中需要称取___________ g草酸晶体(H2C2O4•2H2O),称量后___________ (填“需要”或“不需要”)加热除去相应的结晶水;配制过程中需要使用的玻璃仪器有玻璃棒、胶头滴管及___________ 。
(2)假设称取草酸时使用的是托盘天平,称量中试剂与砝码位置错放,则所配制溶液中c(H2C2O4)0.2000
___________ (填“>”、“=”或“<”,下同);若定容时俯视刻度线,则所配溶液中c(H2C2O4)___________ 0.2000 。
。
(3)若配置溶液时所取草酸晶体不纯(杂质无还原性),为测定草酸的纯度,某同学量取20.00mL,上述所配溶液放入锥形瓶中,然后用0.1000 的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
①标准溶液应使用___________ (填“酸”或“碱”)式滴定管取用,合理的V值可能是___________ 。
A. 15.8 B. 16.20 C. 15.82 D. 16.18
②滴定终点时溶液颜色的变化为___________ ,样品中草酸晶体的质量分数为___________ (用含V的式子表示)。
(1)实验中需要称取
(2)假设称取草酸时使用的是托盘天平,称量中试剂与砝码位置错放,则所配制溶液中c(H2C2O4)0.2000

 。
。(3)若配置溶液时所取草酸晶体不纯(杂质无还原性),为测定草酸的纯度,某同学量取20.00mL,上述所配溶液放入锥形瓶中,然后用0.1000
 的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。
的酸性KMnO4标准溶液滴定(氧化产物是CO2),滴定终点时消耗VmL标准溶液。①标准溶液应使用
A. 15.8 B. 16.20 C. 15.82 D. 16.18
②滴定终点时溶液颜色的变化为
您最近一年使用:0次
解题方法
7 . 镍是一种常用的有机合成催化剂。某工厂以含镍废料(主要成分含NiO,还含少量Fe3O4、SiO2、CaO和Al2O3等)原料制备镍的流程如下:

回答下列问题:
(1)“酸浸”选30%硫酸,滤渣1的主要成分是___________ (填化学式)。
(2)“氧化”过程中加入NaClO或H2O2,发现达到等量氧化效率,实际用量m(H2O2)>m(NaClO),可能的原因是___________ 。
(3)“滤渣2”经一系列操作可获得AlC13∙6H2O,将AlCl3∙6H2O和SOCl2共热可得到无水AlCl3,写出总反应的化学方程式___________ 。
(4)“调pH”的合适试剂是___________ (填字母序号)。
a.NaOH b.NiO c.NH3∙H2O d.Ni(OH)2
(5)检验滤液2是否含Fe3+的简易方法:___________ 。
(6)“还原”过程使用试剂为NaOH和N2H4,氧化产物为N2,.N2H4的电子式为___________ ;还原过程中发生反应的离子方程式为___________ 。
(7)测定镍样品纯度:取mg镍样品完全溶于稀硫酸中,加入V1 mLc mol∙L−1的EDTA溶液,使Ni2+完全络合,煮沸,加入6滴PAN作指示剂,趁热用c mol∙L−1 CuSO4溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,到达滴定终点,消耗CuSO4溶液为V2 mL(假设杂质不参与反应)。该镍样品纯度为___________ %。已知滴定反应:Ni2++ EDTA =EDTA-Ni2+,Cu2++EDTA =EDTA-Cu2+。如果滴定管没有用待装溶液润洗,测定结果___________ (填“偏高”‘偏低”或“无影响”)。

回答下列问题:
(1)“酸浸”选30%硫酸,滤渣1的主要成分是
(2)“氧化”过程中加入NaClO或H2O2,发现达到等量氧化效率,实际用量m(H2O2)>m(NaClO),可能的原因是
(3)“滤渣2”经一系列操作可获得AlC13∙6H2O,将AlCl3∙6H2O和SOCl2共热可得到无水AlCl3,写出总反应的化学方程式
(4)“调pH”的合适试剂是
a.NaOH b.NiO c.NH3∙H2O d.Ni(OH)2
(5)检验滤液2是否含Fe3+的简易方法:
(6)“还原”过程使用试剂为NaOH和N2H4,氧化产物为N2,.N2H4的电子式为
(7)测定镍样品纯度:取mg镍样品完全溶于稀硫酸中,加入V1 mLc mol∙L−1的EDTA溶液,使Ni2+完全络合,煮沸,加入6滴PAN作指示剂,趁热用c mol∙L−1 CuSO4溶液滴定过量的EDTA,当滴定至溶液呈紫红色时,到达滴定终点,消耗CuSO4溶液为V2 mL(假设杂质不参与反应)。该镍样品纯度为
您最近一年使用:0次
名校
解题方法
8 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
789次组卷
|
10卷引用:河南省顶级名校2023届高三上学期10月月考化学试题
河南省顶级名校2023届高三上学期10月月考化学试题山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷山东省济南市商河县第三中学2022届高三10月月考化学试题2021年河北省高考化学试卷变式题10-18题广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物
名校
9 . 金属钛在医疗领域的使用非常广泛,可以应用在人体骨骼、组织移植和再造,如制人造髋关节、膝关节、头盖骨。主动心瓣等。TiCl4是制备金属钛的重要中间体,某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。

相关信息如下表所示:
请回答下列问题:
(1)仪器b的名称为_______ ,装置A中导管a的作用为_______ 。装置B中所装试剂为_______ ,装置A中发生反应的离子方程式为_______ 。
(2)装置C中除生成TiCl4外,同时还生成一种气态不成盐氧化物,该反应的化学方程式为_______ 。制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为_______ 。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;_______ (按正确的顺序填入下列操作的序号)。
①打开分液漏斗活塞
②关闭分液漏斗活塞
③停止加热,充分冷却
④加热装置C中陶瓷管
(4)设计实验证明装置D中收集到的液体中含有TiCl4:_______ 。
(5)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2∙yH2O。测定产物xTiO2∙yH2O组成的方法如下:
步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几淌KSCN溶液作指示剂,用0.1000mol·L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+。重复滴定2次。滴定所得的相关数据如下表:
①步骤一中用稀硫酸而不用水定容的原因是_______ 。
②通过计算确定该样品的组成为_______ 。

相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g∙cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)仪器b的名称为
(2)装置C中除生成TiCl4外,同时还生成一种气态不成盐氧化物,该反应的化学方程式为
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;
①打开分液漏斗活塞
②关闭分液漏斗活塞
③停止加热,充分冷却
④加热装置C中陶瓷管
(4)设计实验证明装置D中收集到的液体中含有TiCl4:
(5)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2∙yH2O。测定产物xTiO2∙yH2O组成的方法如下:
步骤一:取样品2.100g,在酸性条件下充分溶解,并用适量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几淌KSCN溶液作指示剂,用0.1000mol·L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+。重复滴定2次。滴定所得的相关数据如下表:
| 滴定序号 | 待测液体积/mL | NH4Fe(SO4)2标准溶液滴定管起点读数/mL | NH4Fe(SO4)2标准溶液滴定管终点读数/mL |
| 1 | 25.00 | 0.02 | 24.02 |
| 2 | 25.00 | 0.08 | 24.06 |
| 3 | 25.00 | 0.12 | 24.14 |
②通过计算确定该样品的组成为
您最近一年使用:0次
2021-04-04更新
|
605次组卷
|
4卷引用:河南省新乡市2021届高三第二次模拟理综化学试题
河南省新乡市2021届高三第二次模拟理综化学试题(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)陕西省榆林市2021届高考模拟第三次测试(三模)理综化学试题河北省石家庄市第二中学2021-2022学年高三上学期11月第一次考试化学试题
解题方法
10 . 根据从草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③______ 、④______ 、⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示( )
A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是因为_______________ 。
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止________ 。
(5)在进行第②③④步操作时,要用到的同一种玻璃仪器是__________________ 。
(6)所得产物中主要的钾盐有___________________________ 等。
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示
A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是因为
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止
(5)在进行第②③④步操作时,要用到的同一种玻璃仪器是
(6)所得产物中主要的钾盐有
您最近一年使用:0次



