解题方法
1 . 根据从草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③______ 、④______ 、⑤冷却结晶。
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示( )
A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是因为_______________ 。
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止________ 。
(5)在进行第②③④步操作时,要用到的同一种玻璃仪器是__________________ 。
(6)所得产物中主要的钾盐有___________________________ 等。
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示
A.左盘重,样品轻 B.左盘轻,砝码重 C.右盘重,砝码轻 D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是因为
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止
(5)在进行第②③④步操作时,要用到的同一种玻璃仪器是
(6)所得产物中主要的钾盐有
您最近一年使用:0次
名校
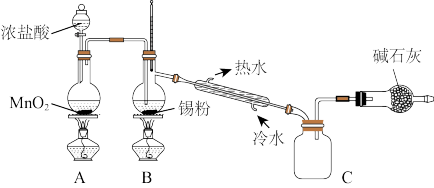
2 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33°C、 沸点为114℃;SnO2对空气和热都很稳定,不溶于水,常温下也难溶于酸或碱溶液。请回答下列问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为___________ 。
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119):
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe(SO4)3;
③用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是_____ ;此锡粉样品中锡的质量分数为___ 。若在滴定终点时俯视读数,则会导致测得的样品中锡的质量分数__________ (填“偏高“偏低”或“无影响”)。
(3)SnO2是一种优秀的透明导电材料。由锡石(主要成分SnO2,含有少量Fe2O3、Al2O3、SiO2)制备纯净SnO2的一种工艺流程为:

请选用实验室常用试剂,把流程图中的试剂1等的化学式填入下表:
(4)实验室欲用下图装置制备少量SnCl4,该装置存在明显缺陷,改进方法是______ 。
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定(已知锡的相对原子质量为119):
①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
②加入过量的Fe(SO4)3;
③用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。步骤②中加入Fe2(SO4)3的作用是
(3)SnO2是一种优秀的透明导电材料。由锡石(主要成分SnO2,含有少量Fe2O3、Al2O3、SiO2)制备纯净SnO2的一种工艺流程为:

请选用实验室常用试剂,把流程图中的试剂1等的化学式填入下表:
| 试剂1 | 沉淀1 | 试剂2 | 沉淀2 | |
| 化学式 |

您最近一年使用:0次
名校
解题方法
3 . 根据从草木灰中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③________ ,④________ ,⑤冷却、结晶.
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示______ (填下列正确选项的代码).
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝码轻
D.右盘轻,样品重
(3)在进行第③步操作时,有可能要重复进行,这是由于________ .
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止________ .
(5)所得产物中主要的钾盐有________ 等.
(1)此实验操作顺序如下:①称量样品,②溶解、沉降,③
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝码轻
D.右盘轻,样品重
(3)在进行第③步操作时,有可能要重复进行,这是由于
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止
(5)所得产物中主要的钾盐有
您最近一年使用:0次
4 . 工业上利用氟碳铈矿(主要成分 )提取
)提取 的一种工艺流程如下:
的一种工艺流程如下:

请回答下列问题:
(1)脱氟过程的实验操作是________ ,酸浸过程中加入 的作用是
的作用是________ 。
(2)常温下,若溶液中的 沉淀完全,此时溶液的
沉淀完全,此时溶液的 为
为________ (已知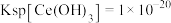 )。
)。
(3)准确称取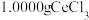 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵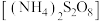 溶液将
溶液将 氧化为
氧化为 ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(已知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(已知: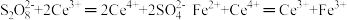 )
)
①已知:过二硫化酸的结构式为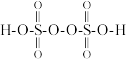 ,其中
,其中 元素的化合价为
元素的化合价为________ 。
②该样品中 的质量分数为
的质量分数为________ (精确到 )。
)。
③若使用久置的 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该 样品的质量分数将
样品的质量分数将________ (填“偏大”“偏小”或“无影响”)。
(4)脱氟过程中产生的 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾 ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢 混合物制备氟单质,电原理为
混合物制备氟单质,电原理为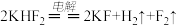 装置如图所示。已知
装置如图所示。已知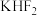 是一种酸式盐,则阴极上发生的电极反应式为
是一种酸式盐,则阴极上发生的电极反应式为________ 。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是________ 。

 )提取
)提取 的一种工艺流程如下:
的一种工艺流程如下:
请回答下列问题:
(1)脱氟过程的实验操作是
 的作用是
的作用是(2)常温下,若溶液中的
 沉淀完全,此时溶液的
沉淀完全,此时溶液的 为
为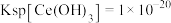 )。
)。(3)准确称取
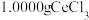 样品置于锥形瓶中,加入适量过硫酸铵
样品置于锥形瓶中,加入适量过硫酸铵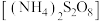 溶液将
溶液将 氧化为
氧化为 ,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(已知:
,再用0.1000mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗30.00mL标准溶液。(已知: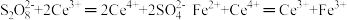 )
)①已知:过二硫化酸的结构式为
 ,其中
,其中 元素的化合价为
元素的化合价为②该样品中
 的质量分数为
的质量分数为 )。
)。③若使用久置的
 标准溶液进行滴定,测得该
标准溶液进行滴定,测得该 样品的质量分数将
样品的质量分数将(4)脱氟过程中产生的
 因活性弱于熔融的氟氢化钾
因活性弱于熔融的氟氢化钾 ,故现代工业以电解熔融的氟氢化钾和氟化氢
,故现代工业以电解熔融的氟氢化钾和氟化氢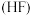 混合物制备氟单质,电原理为
混合物制备氟单质,电原理为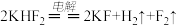 装置如图所示。已知
装置如图所示。已知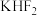 是一种酸式盐,则阴极上发生的电极反应式为
是一种酸式盐,则阴极上发生的电极反应式为
您最近一年使用:0次
解题方法
5 . 锡酸钠(Na2SnO3·xH2O)主要用作电镀铜锡合金和碱性镀锡的基本原料。锡精矿除含SnO2外,还含有少量WO3、S、As、Fe,—种由锡精矿制备锡酸钠的工艺流程如下:
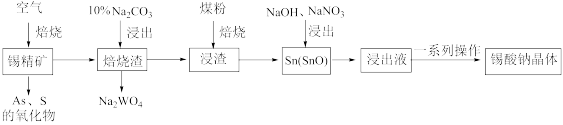
已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②Na2SnO3•xH2O。易溶于水,其在水中的溶解度随着温度的升高而降低。
请回答下列问题:
(1)Sn元素的原子序数为50,其在周期表中的位置为_____________ 。
(2)从“焙烧渣”中除去Fe3O4最简单的方法为_____________ 。加入煤粉焙烧可将SnO2还原为Sn或SnO,Sn或SnO。在碱性条件下均能被NaNO3氧化为Na2SnO3,已知NaNO3的还原产物为NH3,则NaNO3氧化Sn的化学方程式为___________________ 。
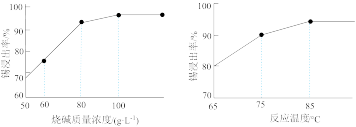
(3)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH质量浓度和反应温度间的关系图,则“碱浸”的最适宜条件为_____________ 、___________ ,
(4)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指___________ 、洗涤、干燥。
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为__________ 。
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时阳极的电极反应式为______________ 。

已知:①焙烧后,S、As变为挥发性氧化物而被除去,Fe变为Fe3O4;
②Na2SnO3•xH2O。易溶于水,其在水中的溶解度随着温度的升高而降低。
请回答下列问题:
(1)Sn元素的原子序数为50,其在周期表中的位置为
(2)从“焙烧渣”中除去Fe3O4最简单的方法为
(3)如图为加入NaOH溶液和NaNO3溶液浸出时锡的浸出率与NaOH质量浓度和反应温度间的关系图,则“碱浸”的最适宜条件为

(4)从浸出液中获得锡酸钠晶体的“一系列操作”具体是指
(5)采用热重分析法测定锡酸钠晶体样品所含结晶水数,将样品加热到140℃时,失掉全部结晶水,失重约20.2%。锡酸钠晶体的化学式为
(6)以纯锡为阳极材料,以NaOH和Na2SnO3为电解液,待镀金属为阴极材料,可实现在待镀金属上的持续镀锡,镀锡时阳极的电极反应式为
您最近一年使用:0次
6 . 利用下图所示装置可确定有机物的化学式,其原理:在玻璃管内,用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
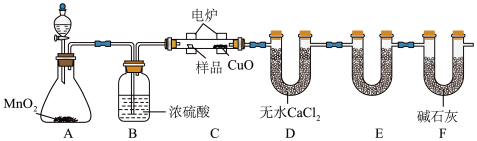
回答下列问题:
(1)装置B中的作用是____________________ ;若无B装置,则会造成测得的有机物中含氢量_________ (填“偏大”“偏小”或“不变”)。
(2)装置E中所盛放的试剂是________ ,其作用为______________ 。
(3)若准确称取1.20g有机物(只含C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为_______________ 。
(4)要确定该有机物的分子式,还需要测定_________________ 。
(5)若该有机物的相对分子质量为60,核磁共振氢谱中有2组峰且面积比为3:1,则该有机物可能为乙酸或________ (填名称),可采取_______ 方法(填一种仪器分析法)确定该有机物具体是何种物质。

回答下列问题:
(1)装置B中的作用是
(2)装置E中所盛放的试剂是
(3)若准确称取1.20g有机物(只含C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为
(4)要确定该有机物的分子式,还需要测定
(5)若该有机物的相对分子质量为60,核磁共振氢谱中有2组峰且面积比为3:1,则该有机物可能为乙酸或
您最近一年使用:0次
解题方法
7 . 硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O,M=392g·mol-1],俗称莫尔盐,是一种蓝绿色的无机复盐,易溶于水,在100℃~110℃时分解。
回答下列问题:
Ⅰ.探究莫尔盐强热时的分解产物
某同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,该同学用下列装置进行实验。

(1)该同学的实验中,装置依次连接的合理顺序为A→H→___ →G。
(2)证明分解产物中含有SO3的实验现象是__ 。
Ⅱ.探究莫尔盐的纯度
某学生取mg莫尔盐样品配制成500mL溶液,根据物质组成,分别设计了如下实验方案。
方案甲:取20.00mL所配溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
方案乙:取20.00mL所配溶液进行如下实验。

(3)方案甲中盛装标准溶液的仪器名称为__ ;涉及反应的离子方程式为__ ;达到滴定终点的现象是___ 。
(4)方案乙测得样品的纯度为__ %(用含m、w的式子表示)。
(5)若实验操作都正确,但方案甲的测定结果总是小于方案乙,其可能原因为__ 。设计实验,验证你的假设__ 。
回答下列问题:
Ⅰ.探究莫尔盐强热时的分解产物
某同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,该同学用下列装置进行实验。

(1)该同学的实验中,装置依次连接的合理顺序为A→H→
(2)证明分解产物中含有SO3的实验现象是
Ⅱ.探究莫尔盐的纯度
某学生取mg莫尔盐样品配制成500mL溶液,根据物质组成,分别设计了如下实验方案。
方案甲:取20.00mL所配溶液于锥形瓶,用0.1000mol·L-1的酸性KMnO4溶液进行滴定。
方案乙:取20.00mL所配溶液进行如下实验。

(3)方案甲中盛装标准溶液的仪器名称为
(4)方案乙测得样品的纯度为
(5)若实验操作都正确,但方案甲的测定结果总是小于方案乙,其可能原因为
您最近一年使用:0次
名校
8 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。请回答下列问题:
(1)晒制蓝图时,用)K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3 ]2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为
]2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为___ FeC2O4+___ K3[Fe(CN)6]一___ Fe3[Fe(CN)6]2+_______ ,配平并完成该显色反应的化学方程式。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
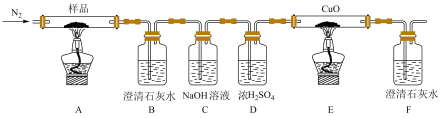
①通入氮气的目的是_________________ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有______________ ,_____________ 。
③为防止倒吸,停止实验时应进行的操作是______________ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:______________ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液的前一步,应进行的操作为____ 。滴定终点的现象是__________________ 。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为_____________________ 。若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,则测定结果_____________________ 。
③过滤、洗涤实验操作过程需要的玻璃仪器有__________________________________________ 。
(1)晒制蓝图时,用)K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3
 ]2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为
]2FeC2O4+3K2C2O4+2CO2↑:显色反应的化学反应式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1KMnO4,溶液滴定至终点。在滴定管中装入KMnO4溶液的前一步,应进行的操作为
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为
③过滤、洗涤实验操作过程需要的玻璃仪器有
您最近一年使用:0次
2019-04-08更新
|
395次组卷
|
2卷引用:河南省洛阳市新安县第一高级中学2021届高三入学测试化学试题
解题方法
9 . 某化学兴趣小组在实验室从海带灰中提取碘并制备KI晶体。请回答下列问题
(1)从水溶液中萃取碘可以选用的试剂是____________ 。(填序号)
A.酒精 B.CCl4 C.己烯 D.直馏汽油
(2)KI晶体的制备,实验装置如图:
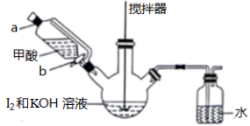
实验步骤如下
i.配制0.5mol·L−1的KOH溶液。
i.在三颈瓶中加入12.7g单质I2和250mL 0.5mol·L−1的KOH溶液,搅拌至碘完全溶解。
ⅲ.通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后,HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品8.3g。请回答下列问题:
①配制0.5mol·L−1 KOH溶液时,下列操作导致配得的溶液浓度偏高的是_____ (填序号)。
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
②步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1∶5,请写出氧化产物的化学式:____________ 。
③步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞___________ 。(填“a”“b”或“a和b”)
④实验中,加入HCOOH发生氧化还原反应的离子方程式为____________________ 。
⑤实验中KI的产率为________________ %
(1)从水溶液中萃取碘可以选用的试剂是
A.酒精 B.CCl4 C.己烯 D.直馏汽油
(2)KI晶体的制备,实验装置如图:

实验步骤如下
i.配制0.5mol·L−1的KOH溶液。
i.在三颈瓶中加入12.7g单质I2和250mL 0.5mol·L−1的KOH溶液,搅拌至碘完全溶解。
ⅲ.通过滴液漏斗向反应后的溶液中滴加适量甲酸,充分反应后,HCOOH被氧化为CO2,再用KOH溶液调pH至9~10,将所得溶液蒸发浓缩,冷却结晶、过滤、洗涤、干燥。得KI产品8.3g。请回答下列问题:
①配制0.5mol·L−1 KOH溶液时,下列操作导致配得的溶液浓度偏高的是
A.托盘上分别放置质量相等的纸片后称量KOH固体
B.KOH固体样品中混有K2O2
C.称量好的固体放入烧杯中溶解未经冷却直接转移入容量瓶
D.未洗涤烧杯及玻璃棒直接向容量瓶中加水定容
E.定容时仰视刻度线
②步骤ⅱ中I2与KOH溶液反应生成的氧化产物和还原产物的物质的量之比为1∶5,请写出氧化产物的化学式:
③步骤ⅲ中向溶液中滴加适量甲酸时,需打开活塞
④实验中,加入HCOOH发生氧化还原反应的离子方程式为
⑤实验中KI的产率为
您最近一年使用:0次
名校
解题方法
10 . 钻(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
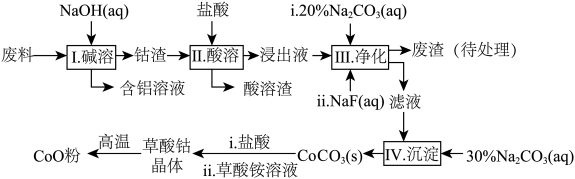
已知: LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目________ 。
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式_______________ 。
(3)步骤II所得废渣的主要成分除了LiF外,还有________________ 。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是___________ 。
(5)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4•2H2O)=183g/mol。
经测定,加热到210℃时,固体物质的化学式为_____ 。加热到210--290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________ 。温度高于890℃时,固体产物发生分解反应,固体产物为__________ 。

已知: LiF难溶于水,Li2CO3微溶于水。
请回答:
(1)写出I中发生反应的化学方程式并用单线桥标记电子转移的方向和数目
(2)写出步骤中Co2O3与盐酸反应生成Cl2的离子方程式
(3)步骤II所得废渣的主要成分除了LiF外,还有
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤IV所起的作用是
(5)在空气中加热10.98g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4•2H2O)=183g/mol。
| 温度范围/℃ | 固体质量/g |
| 150--210 | 8.82 |
| 290--320 | 4.82 |
| 890--920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为
您最近一年使用:0次
2018-05-13更新
|
504次组卷
|
2卷引用:【全国百强校】河南省南阳市第一中学2018届高三第十五次考试理科综合化学试题



