名校
1 . 回答下列问题:
(1)实验室用浓盐酸与二氧化化锰制氯气的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)实验室制取氨气的化学方程式为___________ 。
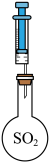
(3)用下图装置来,制备纯净的SO2装置的连接顺序为:a→___________ (按气流方向,用小写字母表示)。

(4)用如图装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、酸性KMnO4溶液、淀粉-KI溶液、新制H2S溶液。
(5)已知NaNO2在空气中会氧化变质(部分转化为NaNO3),取部分变质后的固体样品10g与20mL2molL-1的酸性KMnO4溶液恰好完全反应(Mn全部转化为Mn2+),则样品中NaNO2的纯度为___________ 。
(1)实验室用浓盐酸与二氧化化锰制氯气的反应中氧化剂与还原剂的物质的量之比为
(2)实验室制取氨气的化学方程式为
(3)用下图装置来,制备纯净的SO2装置的连接顺序为:a→

(4)用如图装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、酸性KMnO4溶液、淀粉-KI溶液、新制H2S溶液。

| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶中 | 产生淡黄色浑浊 | 该反应中+4价S体现了 |
| 用注射器将少量的 | +4价S具有还原性,反应的离子方程式为 |
您最近一年使用:0次
解题方法
2 . 下列实验操作能达到实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 测定硫酸铜晶体中结晶水的含量 | 加热盛有硫酸铜晶体的蒸发皿,待固体全部呈白色后将蒸发皿放置在铁架台上冷却,再称重 |
| B | 检验Fe(NO3)2中是否混有Fe(NO3)3 | 取样品于试管中,滴加稀硫酸溶解,再滴加几滴KSCN溶液 |
| C | 探究Na2SO3固体样品是否变质 | 取少量待测样品溶于蒸馏水,再加入足量BaCl2溶液 |
| D | 验证Na2CO3溶液中同时存在K+ | 利用焰色试验,透过蓝色钴玻璃后,发现火焰呈紫色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . SO2和焦亚硫酸钠(Na2S2O5)可作食品添加剂。某小组进行如下探究:
I. 制备SO2
(1)①实验室用 NaHSO3和70%H2SO4制取SO2,反应的化学方程式为___________ 。
②欲收集干燥的SO2,选择下列必要 的装置,按气流方向连接顺序为___________ (填仪器接口的字母编号)。

Ⅱ. 探究焦亚硫酸钠的性质
(2)焦亚硫酸钠易被氧化而变质。该小组设计实验方案,检验焦亚硫酸钠样品氧化变质的程度,完成下列表中的内容。
已知: 2NaHSO3=Na2S2O5+H2O
(3)为检验某白葡萄酒中是否含有Na2S2O5,甲同学设计的实验方案是用酸性KMnO4溶液进行检验, 乙同学认为该方案不可行, 乙同学的理由是___________ 。
Ⅲ.该小组利用下列装置测定空气中SO2的含量。

(4)①通空气样品的导管末端是带许多小孔的玻璃球泡, 其主要作用是___________ ;
②若空气流速为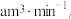 当观察到
当观察到___________ 时,结束计时,测定耗时为tmin。假定样品中的SO2可被溶液充分吸收,该空气样品中SO2,的含量为___________ mg·m-3。
I. 制备SO2
(1)①实验室用 NaHSO3和70%H2SO4制取SO2,反应的化学方程式为
②欲收集干燥的SO2,选择下列

Ⅱ. 探究焦亚硫酸钠的性质
(2)焦亚硫酸钠易被氧化而变质。该小组设计实验方案,检验焦亚硫酸钠样品氧化变质的程度,完成下列表中的内容。
已知: 2NaHSO3=Na2S2O5+H2O
| 实验编号 | 实验步骤 | 现象 | 结论 |
| i | 取少量样品于试管中,加入除氧蒸馏水 | 固体溶解,得到无色溶液 | / |
| ii | 取少量i的溶液于试管中,加入 | | 样品已氧化变质 |
| iii | 另取少量i的溶液于试管中,加入酸性KMnO4溶液,振荡 | | 样品未完全氧化变质 |
(3)为检验某白葡萄酒中是否含有Na2S2O5,甲同学设计的实验方案是用酸性KMnO4溶液进行检验, 乙同学认为该方案不可行, 乙同学的理由是
Ⅲ.该小组利用下列装置测定空气中SO2的含量。

(4)①通空气样品的导管末端是带许多小孔的玻璃球泡, 其主要作用是
②若空气流速为
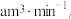 当观察到
当观察到
您最近一年使用:0次
4 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
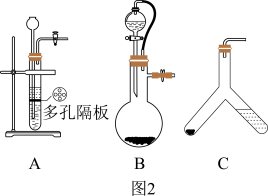
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
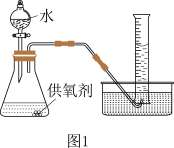
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
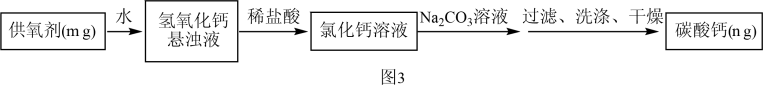
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
2023-08-17更新
|
397次组卷
|
2卷引用:广东省珠海市斗门区第一中学2023-2024学年高三上学期阶段性考试化学试题
名校
解题方法
5 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。
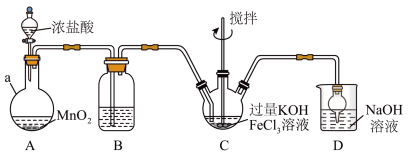
(1)A中发生反应的化学方程式为______ 。
(2)C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是_____ 。
(3)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
(4)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。

(1)A中发生反应的化学方程式为
(2)C中反应为放热反应,而反应温度需控制在0~5℃,采用的控温方法为
(3)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。(4)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
名校
解题方法
6 . I.铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
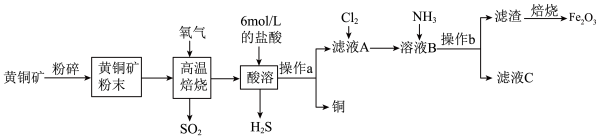
(1)将黄铜矿粉碎的目的是___________ 。
(2)高温熔烧时发生的反应是 ,
,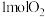 参加反应时,反应中转移电子
参加反应时,反应中转移电子___________  。
。
(3)操作a为___________ 。
(4)向滤液A中通入Cl2的目的是___________ 。
(5)向溶液B中通入NH3后发生反应的离子方程式为___________ 。
Ⅱ.某小组同学咨询老师,准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的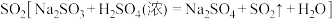 。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】该瓶溶液中溶质成分是什么?
【查阅资料】
a.Na2SO3能与酸反应产生SO2气体
b.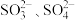 均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
【作出猜想】猜想1:没有变质,成分是Na2SO3
猜想2:完全变质,成分是Na2SO4
猜想3:部分变质,成分是Na2SO3和Na2SO4
【实验探究】甲组设计实验探究溶液是否变质
(6)完成下列问题。
实验结论是___________ 。

(1)将黄铜矿粉碎的目的是
(2)高温熔烧时发生的反应是
 ,
,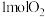 参加反应时,反应中转移电子
参加反应时,反应中转移电子 。
。(3)操作a为
(4)向滤液A中通入Cl2的目的是
(5)向溶液B中通入NH3后发生反应的离子方程式为
Ⅱ.某小组同学咨询老师,准备用亚硫酸钠溶液与浓硫酸反应来制备一定量的
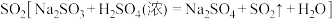 。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质,小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。【提出问题】该瓶溶液中溶质成分是什么?
【查阅资料】
a.Na2SO3能与酸反应产生SO2气体
b.
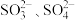 均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。【作出猜想】猜想1:没有变质,成分是Na2SO3
猜想2:完全变质,成分是Na2SO4
猜想3:部分变质,成分是Na2SO3和Na2SO4
【实验探究】甲组设计实验探究溶液是否变质
(6)完成下列问题。
| 甲组 | 实验操作 | 现象 | 结论 |
| 步骤1 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 容液中含有 |
| 步骤2 | 溶液中含有Na2SO4 |
实验结论是
您最近一年使用:0次
7 . 为探索工业废料的再利用,某化学兴趣小组用含有铝、铁和铜等合金废料制取纯碱、氧化铝和绿矾(FeSO4·7H2O),其工艺流程如下图。
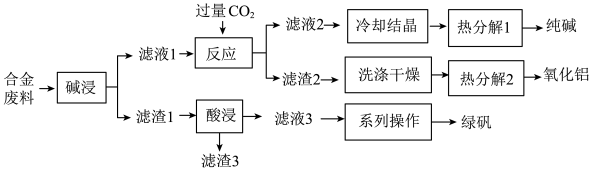
请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式_______ ,滤渣2的主要成分是_______ (填化学式)。
(2)写出“酸浸”中发生反应的离子方程式_______ ,滤渣3的主要成分是_______ (填化学式)。
(3)写出“热分解1”的化学方程式为_______ ,纯碱在生产生活中的一种用途是_______ 。
(4)该工艺流程中,可循环的物质是_______ (填化学式)。
(5)绿矾可用作补铁剂,长期放置易被氧化而变质。为了探究某绿矾样品是否已变质和变质的程度,该小组同学将样品溶于水,制成待测液,进行如下实验。

请回答下列问题:
(1)写出“碱浸”中发生反应的化学方程式
(2)写出“酸浸”中发生反应的离子方程式
(3)写出“热分解1”的化学方程式为
(4)该工艺流程中,可循环的物质是
(5)绿矾可用作补铁剂,长期放置易被氧化而变质。为了探究某绿矾样品是否已变质和变质的程度,该小组同学将样品溶于水,制成待测液,进行如下实验。
| 实验步骤 | 实验现象 | 结论或方程式 |
| 步骤一:取待测液于试管中,向其中滴加KSCN溶液 | ① | 待测液含有Fe3+。 |
| 步骤二:另取待测液于试管中,向其中滴加② | ③ | 待测液含有Fe2+。 |
| 实验结论:该绿矾样品是部分变质的。 | ||
您最近一年使用:0次
名校
解题方法
8 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
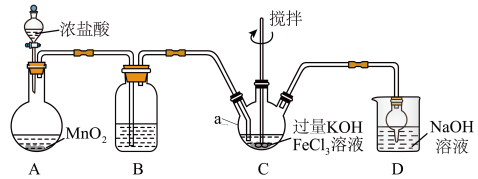
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和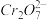 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
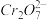 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
710次组卷
|
8卷引用:一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)
(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略(已下线)实验综合题
名校
解题方法
9 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入_______ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取 样品,并设计用下图装置来测定过氧化钠的质量分数。
样品,并设计用下图装置来测定过氧化钠的质量分数。
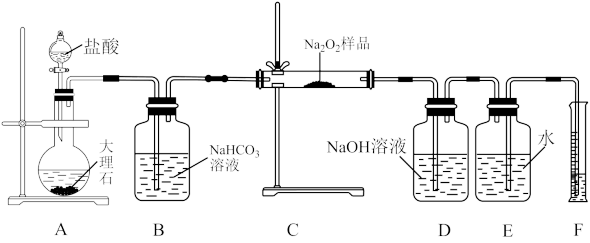
①A中发生反应离子方程式为_______ 。
②将仪器连接好以后,必须进行的第一步操作是_______ 。
③B装置出来的气体是否需要干燥_______ 。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_______ ,_______ 。
⑤D中 溶液的作用
溶液的作用_______ 。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果_______ (填“偏大”、“偏小”或“不影响”)
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取
 样品,并设计用下图装置来测定过氧化钠的质量分数。
样品,并设计用下图装置来测定过氧化钠的质量分数。
①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③B装置出来的气体是否需要干燥
④写出装置C中发生的所有反应的化学方程式
⑤D中
 溶液的作用
溶液的作用⑥实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2022-11-17更新
|
377次组卷
|
2卷引用:广东省广州市铁一中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
10 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用下图所示装置制备干燥纯净的氯气,请回答下列问题。

(1)I中所盛试剂为_______。
(2)请按正确的顺序连接装置:_______ 。
H→_______、_______、→_______、_______→_______;
选择最后一个装置的目的是_______ 。
(3)写出二氧化锰与浓盐酸制取氯气的离子方程式:_______ ;写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:_______ 。
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有CaCl2,请设计实验探究该样品中可能存在的其他物质。[已知Ca(ClO)2可使品红溶液褪色]
I.提出合理假设。
假设1:该漂白粉未变质,含有_______ ;
假设2:该漂白粉全部变质,含有_______ ;
假设3:该漂白粉部分变质,既含有CaCl2、Ca(ClO)2,又含有CaCO3。
II.设计实验方案,进行实验。

(1)I中所盛试剂为_______。
| A.氢氧化钠溶液 | B.饱和食盐水 | C.浓硫酸 | D.硝酸银溶液 |
H→_______、_______、→_______、_______→_______;
选择最后一个装置的目的是
(3)写出二氧化锰与浓盐酸制取氯气的离子方程式:
(4)实验室有一瓶密封不严的漂白粉样品,其中肯定含有CaCl2,请设计实验探究该样品中可能存在的其他物质。[已知Ca(ClO)2可使品红溶液褪色]
I.提出合理假设。
假设1:该漂白粉未变质,含有
假设2:该漂白粉全部变质,含有
假设3:该漂白粉部分变质,既含有CaCl2、Ca(ClO)2,又含有CaCO3。
II.设计实验方案,进行实验。
| 实验步骤 | 预期现象和结论 |
| ①取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 | a.若无气泡产生,则 |
| ②向步骤①反应后的试管中滴加1~2滴品红溶液,振荡 | c.若品红溶液褪色,结合实验①中的b判断,则 |
您最近一年使用:0次



