名校
1 . 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为_______ 。
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能_______ 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为_______ 。
②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_______ (填化学式),在350~400℃范围内,剩余固体的成分为_______ (填化学式)。

(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O
 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为

您最近一年使用:0次
2023-04-26更新
|
179次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
2 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
名校
解题方法
3 . 下列反应的离子方程式与解释均正确的是
| A.将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++ =Fe3++2H2O+NO↑ =Fe3++2H2O+NO↑ |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
您最近一年使用:0次
2023-04-26更新
|
304次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
4 . Ⅰ.有下列物质:①Na2CO3•10H2O晶体;②铜;③硫酸溶液;④CO2;⑤NaHSO4固体;⑥Ba(OH)2固体;⑦红褐色的氢氧化铁胶体;⑧氨水;⑨稀硝酸;⑩Al2(SO4)3固体。
(1)上述物质属于电解质的有___________ (填编号)。
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式___________ 。
(3)写出固体⑤溶于水中的电离方程式___________ 。
(4)17.1g⑩溶于水配成250mL溶液, 的物质的量浓度为
的物质的量浓度为___________ 。
Ⅱ.
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为___________ ,物质的量之比为___________ ,质量之比为___________ 。
(6)等质量的SO2和SO3物质的量之比是___________ ,氧原子数之比为___________ 。
(7)19g某二价金属的氯化物ACl2中含有0.4molCl-,则A的摩尔质量为___________ 。
(1)上述物质属于电解质的有
(2)上述物质中有两种物质之间可发生离子反应:H++OH-=H2O,写出该离子反应对应的化学方程式
(3)写出固体⑤溶于水中的电离方程式
(4)17.1g⑩溶于水配成250mL溶液,
 的物质的量浓度为
的物质的量浓度为Ⅱ.
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
(6)等质量的SO2和SO3物质的量之比是
(7)19g某二价金属的氯化物ACl2中含有0.4molCl-,则A的摩尔质量为
您最近一年使用:0次
名校
解题方法
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如下图所示(
的混合溶液中回收S,其转化如下图所示( 不溶于水)。下列说法中,不正确的是
不溶于水)。下列说法中,不正确的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 和
和 的混合溶液中回收S,其转化如下图所示(
的混合溶液中回收S,其转化如下图所示( 不溶于水)。下列说法中,不正确的是
不溶于水)。下列说法中,不正确的是
A.回收S的总反应为: |
B.过程①中,生成 的反应为: 的反应为: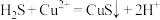 |
C.过程②中, 作氧化剂 作氧化剂 |
| D.过程③中,各元素化合价均未改变 |
您最近一年使用:0次
2023-04-22更新
|
1498次组卷
|
52卷引用:北京市2020年普通高中学业水平合格性模拟考试化学试题
北京市2020年普通高中学业水平合格性模拟考试化学试题北京市首都师范大学附属中学2019-2020学年高一下学期期末考试化学(非选考)试题2020年北京市第一次普通高中学业水平合格性考试化学试题北京市海淀区19中2019-2020学年高一下学期期末考试化学试题江苏省靖江高级中学2020-2021学年度高一上学期第一次阶段考试化学试题广东省河源高级中学2020-2021学年高一上学期第一次段考化学试题江苏省宜兴市第一中学2020-2021学年高一上学期第一次阶段性检测化学试题江苏省南京市金陵中学河西分校2020-2021学年高一上学期10月月考化学试题北京市石景山区2020-2021学年高一上学期期末调研化学试卷题北京市第三十五中学2020-2021学年 高一下学期期中测试化学试题北京市第一五九中学2020-2021学年高一下学期期中考化学试题北京市第五十六中学2020-2021学年高一下学期期中考试化学试题北京市第五中学2020-2021学年高一下学期第一次阶段考试化学试题黑龙江省哈尔滨市第六中学2021-2022学年高一上学期10月月考化学试题广东省东莞市光明中学2021-2022学年高一上学期第一次月考化学试题(已下线)4.2.1 含硫物质间的转化-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)河北正中实验中学2021-2022学年高一上学期期中考试化学试题山西省太原市第五中学2021-2022学年高一上学期12月月考化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题安徽省六安市第一中学2021-2022学年高一下学期开学考试化学试题江苏省泰州中学2021-2022学年高一上学期期末考试化学试题北京市北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题北京师范大学附属实验中学2021-2022学年高一下学期期中考试化学试题(已下线)第13讲 铁的氧化物和铁的氢氧化物-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)北京市石景山区2021-2022学年高一下学期期末考试化学试题黑龙江省哈尔滨市第六中学校2021-2022学年高一上学期10月月考化学试题黑龙江省大庆铁人中学2022-2023学年高一上学期第一次月考化学试题北京市首师附密云中学2021-2022学年高一下学期等级考化学试题(已下线)易错点04 氧化还原反应-备战2023年高考化学考试易错题北京市第六十六中学2022-2023学年高一上学期期中考试化学试题北京市第十二中学2022-2023学年高一上学期期中考试化学试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题湖北省武汉大学附属中学2021-2022学年高二上学期开学考试化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷北京师范大学附属中学2022-2023学年高一上学期期末考试化学试题四川省成都市第七中学2022-2023学年高一上学期期末考试化学试题江西省南昌市2022-2023学年高一下学期选课走班调研检测化学试题江苏省淮安市2022-2023学年高一上学期期末考试化学试题第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)北京市西城外国语学校2022-2023学年高一下学期期中考试化学试题(已下线)北京市第四中学2022~2023学年高一下学期期中考试化学试题陕西省西安市第八十五中学2022-2023学年高一下学期月考化学试题 甘肃省兰州大学附属中学2022-2023学年高一下学期5月月考(分班考试)化学试题江苏省南京市江宁区2022-2023学年高一下学期期末考试化学试题广东省部分名校2023-2024学年高一上学期期中联合考试化学试题广东省珠海市第二中学2023-2024学年高一上学期10月月考化学试题广东省茂名市化州市第一中学2023-2024学年高一上学期期中测评化学试题(已下线)专题07 硫及含硫化合物 环境保护-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)江苏省泗阳县实验高级中学2023-2024学年高一上学期第二次调研测试化学试卷江苏省泰州市2023-2024学年高一上学期1月期末化学试题宁夏石嘴山第三中学2023-2024学年高三上学期期中考试化学试题(已下线)安徽省皖北县中联盟2023-2024学年高一下学期3月月考化学试题
名校
6 . 已知酸性:H2CO3>HClO>HCO ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述表达中,正确的是
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述表达中,正确的是
 ,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述表达中,正确的是
,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述表达中,正确的是| A.向溴水中加入足量氯化亚铁溶液能使溴水褪色 |
| B.能使酚酞显红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存 |
C.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O=2HClO+ |
| D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- |
您最近一年使用:0次
名校
解题方法
7 . 将标准状况下的22.4L SO2通入4mol NaOH溶液中,下列用来解释事实的方程式中不合理的是(已知室温下饱和Na2SO3溶液的pH约为8.3)
A.标准状况下的22.4L SO2通入含4mol NaOH的溶液:2OH-+SO2=SO +H2O +H2O |
B.上述反应后所得溶液的pH约为12:SO +H2O +H2O HSO HSO +OH- +OH- |
C.向上述反应后所得溶液中,通入氯气,pH下降:SO +Cl2+2OH-=SO +Cl2+2OH-=SO +2Cl-+H2O +2Cl-+H2O |
D.向上述反应后所得溶液中,滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO +Ba2++H2O2=BaSO4↓+H2O +Ba2++H2O2=BaSO4↓+H2O |
您最近一年使用:0次
2023-04-21更新
|
249次组卷
|
2卷引用:北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
名校
8 . 酸与碱的中和反应在生活生产中有重要的应用。下图从不同角度反映稀硫酸和氢氧化钠溶液的反应。

请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是_______ ,变色的原因是溶液的pH_______ 7(填写大于、等于或小于)。
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是_______ (填写化学式)。
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是_______ (填写符号和比值)。
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH_______ 7(填写大于、等于或小于)。
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO ,其溶液呈酸性。
,其溶液呈酸性。
①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是_______ 。
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式_______ 。

请回答下列问题:
(1)图甲,烧杯中盛有氢氧化钠溶液,滴入2~3滴酚酞溶液,现象是
(2)向稀硫酸中滴加氢氧化钠溶液,得到溶液pH与加入氢氧化钠溶液质量的关系如图乙。
①当加入ag氢氧化钠溶液时,此时溶液中的溶质是
②当加入氢氧化钠溶液的质量正好反应到M点时,溶液中的主要离子及其比值是
③当加入氢氧化钠溶液的质量为bg时,所得溶液中的pH
(3)在溶液中硫酸氢钠(NaHSO4)完全解离出Na+、H+、SO
 ,其溶液呈酸性。
,其溶液呈酸性。①向硫酸氢钠溶液中滴加氢氧化钠溶液,完全反应的化学方程式是
②向硫酸氢钠溶液中滴加氢氧化钡溶液反应至溶液呈中性,写出反应的化学方程式
您最近一年使用:0次
名校
9 . 我国科学家提出了由物质A和物质B转化为高附加值产品乙酸(CH3COOH)的催化反应历程,该历程示意图如下(模型中的短线仅代表原子间的连接方式)。
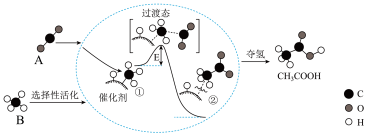
请回答下列问题:
(1)物质B的化学式是_______ ;实验室中制备A的化学方程式是_______ 。
(2)反应过程中,催化剂吸附的物质是_______ 。(写名称)
(3)写出物质A、B反应生成乙酸的化学方程式_______ 。
(4)物质A能与氢氧化钠溶液反应生成纯碱,反应的化学方程式是_______ 。
(5)物质B和乙酸都能完全燃烧生成二氧化碳和水,等质量的物质B和乙酸完全燃烧时消耗氧气的质量比为_______ 。

请回答下列问题:
(1)物质B的化学式是
(2)反应过程中,催化剂吸附的物质是
(3)写出物质A、B反应生成乙酸的化学方程式
(4)物质A能与氢氧化钠溶液反应生成纯碱,反应的化学方程式是
(5)物质B和乙酸都能完全燃烧生成二氧化碳和水,等质量的物质B和乙酸完全燃烧时消耗氧气的质量比为
您最近一年使用:0次
名校
10 . 向一定质量Ba(OH)2溶液中先后滴加CuSO4、H2SO4溶液,滴加过程中加入溶液的质量与产生沉淀的质量关系如图所示。下列说法正确的是
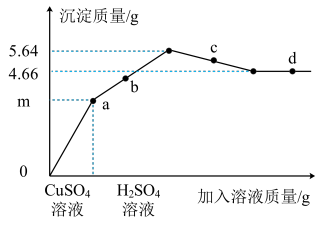

| A.a点对应溶液pH<7 |
| B.b点时存在的沉淀有BaSO4、Cu(OH)2 |
| C.c点对应溶液中溶质有2种 |
| D.Ba(OH)2溶液中约含3.42g Ba(OH)2 |
您最近一年使用:0次



