名校
解题方法
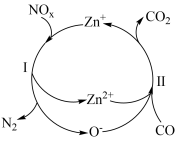
1 . 用 方法可将汽车尾气中的
方法可将汽车尾气中的 和
和 转化为无污染的气体,下列说法错误的是
转化为无污染的气体,下列说法错误的是
 方法可将汽车尾气中的
方法可将汽车尾气中的 和
和 转化为无污染的气体,下列说法错误的是
转化为无污染的气体,下列说法错误的是
A.整个过程中 作催化剂 作催化剂 |
| B.反应过程中涉及的反应均为氧化还原反应 |
C.过程Ⅰ中发生的反应为 |
D.总反应中氧化剂和还原剂的物质的量之比为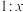 |
您最近一年使用:0次
2022-04-10更新
|
1322次组卷
|
14卷引用:天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题
天津市咸水沽第一中学2022届高三学业等级性考试押题卷化学试题天津市第十四中学2022-2023学年高三上学期期末考试化学试题河北省保定市2022届高三第一次模拟考试(一模)化学试题(已下线)专项05 氧化还原反应-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(辽宁卷)(已下线)化学-2022年高考考前押题密卷(广东卷)(已下线)专题04 氧化还原反应-三年(2020-2022)高考真题分项汇编(已下线)专题一 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省铁岭市六校协作体2021-2022学年高二下学期期末联考化学试题福建省宁德第一中学2022-2023学年高一上学期12月月考化学试题福建省福州第三中学2023届高三下学期第一次质量检测化学试题河北省邯郸市大名县第一中学2022-2023学年高二下学期6月月考化学试题河北正定中学2022-2023学年高一下学期第四次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第二次月考化学试题
2022·全国·模拟预测
2 . 氰化钠(NaCN)是一种重要的基本化工原料,用于化学合成、电镀、冶金和有机合成医药、农药,同时也是一种剧毒物质,一旦泄漏需要及时处理。一般可以用二氧化氯(ClO2)水溶液或硫代硫酸钠(Na2S2O3)溶液来处理,以减轻环境污染。
I.
(1) 用二氧化氯(ClO2)水溶液处理后,
用二氧化氯(ClO2)水溶液处理后, 被氧化为
被氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
II.工业制备硫代硫酸钠的反应原理: 。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
【实验一】实验室通过如图所示装置制备硫代硫酸钠。

关闭 ,打开
,打开 ,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
(2)①装置C中盛放 和
和 混合溶液的仪器名称是
混合溶液的仪器名称是___________ ;
②装置B的作用是___________ ;
③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有___________ ;
(3)实验结束后,在E处可连接盛有___________(填序号)溶液的注射器,再关闭 ,打开
,打开 ,以防止拆除装置时装置中的有害气体逸出污染空气。
,以防止拆除装置时装置中的有害气体逸出污染空气。
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为 ,一般可用
,一般可用 的标准溶液测定产品纯度:取
的标准溶液测定产品纯度:取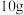 产品配制成
产品配制成 溶液,取
溶液,取 溶液,用浓度为
溶液,用浓度为 的标准溶液进行滴定(原理为
的标准溶液进行滴定(原理为 ),相关数据记录如表:
),相关数据记录如表:
(4)①上述滴定操作中应该选用___________ 作为反应的指示剂;
②计算 产品的纯度为
产品的纯度为___________ 。
(5)查阅资料知氰化钠与硫代硫酸钠的反应是 ;实验室中
;实验室中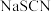 可以代替
可以代替 检验
检验___________ (填离子符号)。
I.
(1)
 用二氧化氯(ClO2)水溶液处理后,
用二氧化氯(ClO2)水溶液处理后, 被氧化为
被氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为II.工业制备硫代硫酸钠的反应原理:
 。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。
。某化学小组利用上述原理在实验室制备硫代硫酸钠,并用硫代硫酸钠溶液处理含氰化钠废水。【实验一】实验室通过如图所示装置制备硫代硫酸钠。

关闭
 ,打开
,打开 ,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。
,打开分液漏斗,缓慢滴加硫酸,控制好反应速率。(2)①装置C中盛放
 和
和 混合溶液的仪器名称是
混合溶液的仪器名称是②装置B的作用是
③实验结束后装置D烧杯中的溶质除NaOH之外,还可能有
(3)实验结束后,在E处可连接盛有___________(填序号)溶液的注射器,再关闭
 ,打开
,打开 ,以防止拆除装置时装置中的有害气体逸出污染空气。
,以防止拆除装置时装置中的有害气体逸出污染空气。A. 溶液 溶液 | B.浓硫酸 |
C.酸性 溶液 溶液 | D. 溶液 溶液 |
【实验二】测定硫代硫酸钠产品纯度并处理废水中的氰化钠。
制备的硫代硫酸钠产品一般为
 ,一般可用
,一般可用 的标准溶液测定产品纯度:取
的标准溶液测定产品纯度:取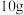 产品配制成
产品配制成 溶液,取
溶液,取 溶液,用浓度为
溶液,用浓度为 的标准溶液进行滴定(原理为
的标准溶液进行滴定(原理为 ),相关数据记录如表:
),相关数据记录如表:| 实验编号 | 1 | 2 | 3 |
| 溶液体积/mL | 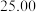 | 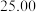 | 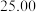 |
消耗 的标准溶液体积/mL 的标准溶液体积/mL |  |  |  |
②计算
 产品的纯度为
产品的纯度为(5)查阅资料知氰化钠与硫代硫酸钠的反应是
 ;实验室中
;实验室中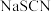 可以代替
可以代替 检验
检验
您最近一年使用:0次
名校
3 . 在含等物质的量的NaBr和KI混合溶液中,通入一定量的Cl2,当一半的NaBr被氧化时,参与置换反应的Cl2的物质的量与原NaBr的物质的量之比为
| A.3:4 | B.4:3 | C.2:1 | D.1:2 |
您最近一年使用:0次
2022-03-16更新
|
295次组卷
|
3卷引用:天津市南开区2022~2023学年高一上学期阶段性质量监测化学试题
解题方法
4 . 下表列出了①~⑩十种元素在周期表中的位置:
请按要求回答下列问题
(1)上述元素中,金属性最强的是_______ (填元素名称),最高价氧化物对应水化物酸性最强的是_______ (写出酸的化学式)。
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:_______ 。(用离子符号表示)
(3)由元素①和④形成的18电子的结构式为_______ ;由元素①、③、⑨形成的离子化合物的电子式为_______ ,由元素⑥和⑨形成化合物乙,请用电子式表示物质乙的形成过程_______ 。
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为:_______
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系_______ 。
(6)可以比较⑤、⑥两元素金属性强弱的实验是_______。
(7)元素③、磷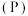 、砷
、砷 、锑
、锑 、铋
、铋 为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置_______ 。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ | |||||||
(1)上述元素中,金属性最强的是
(2)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是:
(3)由元素①和④形成的18电子的结构式为
(4)由元素①、③、④、⑧形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为:
(5)请用一个化学方程式证明元素⑧和⑨的非金属性强弱关系
(6)可以比较⑤、⑥两元素金属性强弱的实验是_______。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将这两种元素的单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
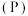 、砷
、砷 、锑
、锑 、铋
、铋 为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
为元素周期表中原子序数依次增大的同族元素。砷在元素周期表中的位置
您最近一年使用:0次
解题方法
5 . 回答下列问题:
(1)下列物质中:①液氯和氯气②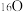 、
、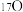 和
和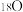 ③金刚石与“足球烯”
③金刚石与“足球烯” ④白磷和红磷⑤
④白磷和红磷⑤ 与
与 ⑥D与T互为同素异形体的有
⑥D与T互为同素异形体的有_______ (填序号,下同),属于同位素的有_______ ,属于同一种物质的有_______ 。
(2)某元素R与氢形成的气态氢化物的化学式为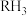 ,其最高价氧化物的化学式为
,其最高价氧化物的化学式为_______ 。
(3)标况下有①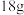 水②
水②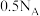 个
个 分子③
分子③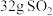 气体④
气体④ ⑤
⑤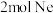 所含原子个数从大到小的顺序为
所含原子个数从大到小的顺序为_______ (用序号表示)。
(4)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的黄绿色有毒气体,写出该反应的离子方程式:_______ 。
(5)过氧化钠与二氧化碳反应化学方程式为_______ ,等物质的量的 分别与足量的
分别与足量的 、
、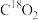 反应生成氧气的质量之比为
反应生成氧气的质量之比为_______ 。
(1)下列物质中:①液氯和氯气②
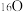 、
、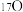 和
和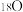 ③金刚石与“足球烯”
③金刚石与“足球烯” ④白磷和红磷⑤
④白磷和红磷⑤ 与
与 ⑥D与T互为同素异形体的有
⑥D与T互为同素异形体的有(2)某元素R与氢形成的气态氢化物的化学式为
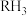 ,其最高价氧化物的化学式为
,其最高价氧化物的化学式为(3)标况下有①
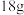 水②
水②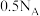 个
个 分子③
分子③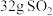 气体④
气体④ ⑤
⑤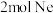 所含原子个数从大到小的顺序为
所含原子个数从大到小的顺序为(4)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的黄绿色有毒气体,写出该反应的离子方程式:
(5)过氧化钠与二氧化碳反应化学方程式为
 分别与足量的
分别与足量的 、
、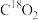 反应生成氧气的质量之比为
反应生成氧气的质量之比为
您最近一年使用:0次
解题方法
6 . 加碘食盐中的碘以碘酸钾 的形式存在。现实验室需要配制
的形式存在。现实验室需要配制 溶液(
溶液( 的摩尔质量为
的摩尔质量为 ),请回答下列问题:
),请回答下列问题:
(1)计算需要 的质量为出
的质量为出_______ g。
(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有_______ 和_______ (填名称)。
(3)溶解过程中玻璃棒的作用是_______ ,转移溶液过程中玻璃棒的作用是_______ 。
(4)在此配制过程中,下列情况会使所得溶液的浓度偏高的是_______(填序号)。
(5)已知在溶液中可发生如下反应: 。
。
①如果反应中转移 电子,则生成
电子,则生成 的物质的量为
的物质的量为_______  。
。
②根据上述反应,向某食盐样品的溶液中加入稀硫酸和碘化钾淀粉溶液进行实验,若观察到_______ ,证明该食盐样品中含有碘酸钾。
 的形式存在。现实验室需要配制
的形式存在。现实验室需要配制 溶液(
溶液( 的摩尔质量为
的摩尔质量为 ),请回答下列问题:
),请回答下列问题:(1)计算需要
 的质量为出
的质量为出(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
(3)溶解过程中玻璃棒的作用是
(4)在此配制过程中,下列情况会使所得溶液的浓度偏高的是_______(填序号)。
| A.转移溶液时未洗涤烧杯和玻璃棒 |
| B.定容时俯视刻度线观察液面 |
| C.容量瓶用蒸馏水洗净后未干燥 |
| D.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线 |
 。
。①如果反应中转移
 电子,则生成
电子,则生成 的物质的量为
的物质的量为 。
。②根据上述反应,向某食盐样品的溶液中加入稀硫酸和碘化钾淀粉溶液进行实验,若观察到
您最近一年使用:0次
2022-03-02更新
|
215次组卷
|
3卷引用:天津市河北区2021-2022学年高一上学期期末质量检测化学试题
天津市河北区2021-2022学年高一上学期期末质量检测化学试题2020年天津市普通高中学业水平合格性考试化学试题(已下线)专项03 有关阿伏加德罗常数的判断和物质的量浓度的计算-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
7 . 回答下列问题
(1)补齐物质(或粒子)与其用途之间的连线_______ 。
(2)下列物质中① MgCl2 ②NaOH ③Na2O2 ④N2 ⑤H2S ⑥H2O2 ⑦CO2 ⑧CaO ⑨CH4 ⑩NH4Cl
只含有极性键的物质是______________ (填序号,下同),既含有极性键又含有非极性键的物质是______________ ,既含有共价键又含有离子键的物质是 _____________ ,属于离子化合物的物质是______________ ,属于共价化合物的物质是______________ 。
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时反应为:S + 2KNO3 + 3C = K2S + N2↑ + 3CO2↑。在该反应中,还原剂是_______ (填化学式),化合价升高;氧化剂是S和KNO3,被______ ,发生 ______ 反应;当反应释放出33.6L(标准状况)的CO2气体时,转移电子数目为________ 。
(1)补齐物质(或粒子)与其用途之间的连线
物质(粒子) 用途 A.铝 a.制合金 B.四氧化三铁 b.测定文物年代 C.碳酸氢钠 c.作自来水消毒剂 D.14C d.作食用碱 E.氯气 e.作磁性材料 |
只含有极性键的物质是
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时反应为:S + 2KNO3 + 3C = K2S + N2↑ + 3CO2↑。在该反应中,还原剂是
您最近一年使用:0次
名校
8 . 2021年12月9日下午,神舟十三号“太空出差三人组”在中国空间站进行了太空授课,“太空教师”王亚平介绍了宇航员在太空中的主要氧气来源为电解水产生。下列关于电解水的说法正确的是
| A.水既是氧化剂也是还原剂 |
B.常温下每消耗18g水即可产生 |
C.每生成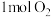 共转移 共转移 电子 电子 |
D.电解水时产生的 为氧化产物 为氧化产物 |
您最近一年使用:0次
2022-01-24更新
|
136次组卷
|
2卷引用:天津市滨海新区塘沽第一中学2023届高三第一次月考化学试题
名校
解题方法
9 . 探究金属钠性质的实验如下:
实验1:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察到新切开的钠光亮表面变暗。
实验2:将一个干燥的坩埚加热,切取一块绿豆大的钠,投到坩埚中,继续加热,观察到钠先熔化,然后发出黄色火焰,生成淡黄色固体。
实验3:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一小块绿豆大的钠放入水中,产生气体,溶液变红。
下列说法不正确的是
实验1:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察到新切开的钠光亮表面变暗。
实验2:将一个干燥的坩埚加热,切取一块绿豆大的钠,投到坩埚中,继续加热,观察到钠先熔化,然后发出黄色火焰,生成淡黄色固体。
实验3:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一小块绿豆大的钠放入水中,产生气体,溶液变红。
下列说法不正确的是
| A.实验1中钠表面变暗是因为钠与氧气发生反应 |
| B.实验2中生成的淡黄色固体是Na2O |
| C.实验3中溶液变红是因为生成了碱性物质 |
D.实验3中发生反应中的电子转移可表示为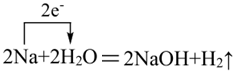 |
您最近一年使用:0次
2022-01-20更新
|
380次组卷
|
4卷引用:天津市实验中学滨海学校2023-2024学年高一上学期期中质量调查化学试题
天津市实验中学滨海学校2023-2024学年高一上学期期中质量调查化学试题江苏省南京市2021-2022学年高一上学期 期末统考化学试题山西省阳泉市第一中学2022-2023学年高一上学期期中考试化学试题(已下线)专题05 金属钠及钠的化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
10 . 下列有关说法不正确 的是
| A.电解熔融氯化钠制取金属钠时,钠离子被还原,氯离子被氧化 |
| B.生铁、碳素钢、不锈钢等都属于铁的合金 |
C.新型储氢合金因具有较大空隙,通过物理吸附大量 而广泛用于新能源汽车行业 而广泛用于新能源汽车行业 |
| D.合金中加入其他元素原子后,使原子层之间的相对滑动变得困难,导致合金的硬度变大 |
您最近一年使用:0次
2022-01-19更新
|
695次组卷
|
8卷引用:天津市新华中学2023-2024学年高一上学期第二次月考化学试卷



