名校
解题方法
1 . 大量的镁是从海水中提取的,其主要步骤如下:

上述各步骤涉及镁及其化合物的转化中,发生了氧化还原反应的是

上述各步骤涉及镁及其化合物的转化中,发生了氧化还原反应的是
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
2022-05-27更新
|
545次组卷
|
4卷引用:天津市第二南开学校2021-2022学年高一下学期6月阶段性线上测试化学试题
天津市第二南开学校2021-2022学年高一下学期6月阶段性线上测试化学试题2021年海南省普通高中学业水平合格性考试化学试题(已下线)第06讲 氧化剂和还原剂 (讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第06讲 氧化剂和还原剂 (讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
2 . 在酸性溶液中,FeS2催化氧化的物质转化关系如图所示。

下列有关叙述正确的是

下列有关叙述正确的是
| A.Fe2+是该反应的催化剂 |
| B.反应中,FeS2作氧化剂 |
| C.反应过程中须不断加入NO和O2 |
D.每消耗7molO2,溶液中最多增加4mol |
您最近一年使用:0次
2022-05-26更新
|
606次组卷
|
3卷引用:天津市南开区2022届高三下学期第三次模拟化学试题
天津市南开区2022届高三下学期第三次模拟化学试题(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)甘肃省武威市银科致远补习学校2023-2024学年高三上学期第三次调研化学试题
名校
3 . 按要求填空
(1)写出由石英砂与焦炭在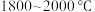 反应制备粗硅的化学方程式
反应制备粗硅的化学方程式_______
(2)写出工业上合成 的化学方程式
的化学方程式_______
(3)写出硫代硫酸钠和稀硫酸反应的化学方程式_______
(4)写出氢氧燃料电池(电解质是 溶液)的负极反应方程式:
溶液)的负极反应方程式:_______
(5) 、
、 时,
时,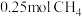 完全燃烧生成
完全燃烧生成 气体和液态
气体和液态 时,放出
时,放出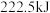 的热量。其热化学方程式为
的热量。其热化学方程式为_______
(1)写出由石英砂与焦炭在
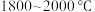 反应制备粗硅的化学方程式
反应制备粗硅的化学方程式(2)写出工业上合成
 的化学方程式
的化学方程式(3)写出硫代硫酸钠和稀硫酸反应的化学方程式
(4)写出氢氧燃料电池(电解质是
 溶液)的负极反应方程式:
溶液)的负极反应方程式:(5)
 、
、 时,
时,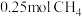 完全燃烧生成
完全燃烧生成 气体和液态
气体和液态 时,放出
时,放出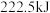 的热量。其热化学方程式为
的热量。其热化学方程式为
您最近一年使用:0次
解题方法
4 . 化学在人类社会发展中发挥着重要作用,下列说法不正确 的是
A.双氧水可用于处理泄漏的有毒物质 |
| B.在钢铁设备上连接金属铜保护钢铁 |
| C.高纯硅可用于制作通信设备的芯片 |
| D.可用核磁共振氢谱区分苯甲醇和对甲基苯酚 |
您最近一年使用:0次
名校
5 . 某小组探究Cu与H2O2在不同条件下的反应,实验结果如表:
下列说法不正确的是

| 实验 | 试剂a | 现象与结果 |
| I | 10h后,液体变为浅蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2 | |
| II | 8mL5mol/L氨水 | 立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2 |
| III | 8mL5mol/L氨水和1gNH4Cl固体 | 立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜片依然保持光亮 |
| A.I中生成Cu(OH)2的反应是Cu+H2O2=Cu(OH)2 |
| B.由实验可知,增大c(OH-),H2O2的氧化性增强 |
| C.增大c(NH4+)有利于[Cu(NH3)4]2+的生成 |
| D.[Cu(NH3)4]2+可能是H2O2分解的催化剂 |
您最近一年使用:0次
2022-05-08更新
|
901次组卷
|
6卷引用:天津市和平区2023-2024学年高三下学期第二次质量调查化学试卷
6 . 某小组为探究 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
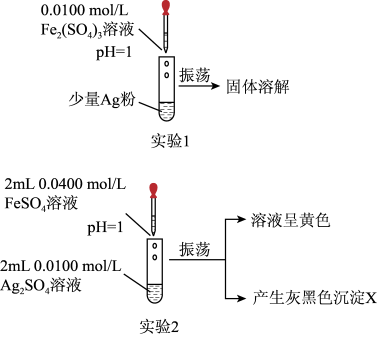
(1)实验1:如图所示,可得出的实验结论是___________ 。该实验不选用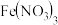 的原因是
的原因是___________ 。
(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:___________ 。
②请用离子方程式解释产生红棕色气体的原因:___________ 。
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。
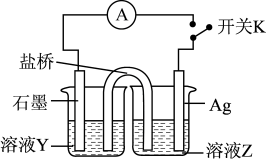
①溶液Y为___________ 。
②为实现该实验目的,接下来的操作及现象为___________ 。
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知, 下,
下,  (白色)
(白色) 
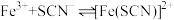 (红色)
(红色) 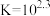
 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液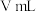 ,用
,用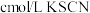 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗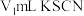 标准溶液。
标准溶液。
①判断滴定终点现象为___________ ;
②实验2试管中反应的平衡常数
___________ 。
③不取用实验1反应后所得清液测定反应的平衡常数的原因:___________ 。
 和
和 的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
的化学性质特点及其参与反应的限度,设计并进行如下四个实验,得到部分现象和数据。请围绕实验目的,按要求回答下列问题。
(1)实验1:如图所示,可得出的实验结论是
 的原因是
的原因是(2)实验2:取出如图中沉淀X于烧杯中,滴入少量浓硝酸,立刻观察到有红棕色气体产生。
①写出实验2试管中发生反应的离子方程式:
②请用离子方程式解释产生红棕色气体的原因:
(3)实验3:为进一步证明实验1反应是可逆的,用如图装置进行验证。闭合开关K,电流计指针向右偏转,一段时间后指针归零。

①溶液Y为
②为实现该实验目的,接下来的操作及现象为
(4)实验4:为定量认识实验2中反应限度情况,查阅资料知,
 下,
下,  (白色)
(白色) 
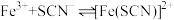 (红色)
(红色) 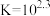
 ,取实验2试管中充分反应静置后的上层清液
,取实验2试管中充分反应静置后的上层清液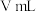 ,用
,用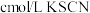 标准溶液滴定,至终点时消耗
标准溶液滴定,至终点时消耗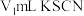 标准溶液。
标准溶液。①判断滴定终点现象为
②实验2试管中反应的平衡常数

③不取用实验1反应后所得清液测定反应的平衡常数的原因:
您最近一年使用:0次
名校
7 . 氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1) 为淡棕黄色气体,可由新制的HgO和
为淡棕黄色气体,可由新制的HgO和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
① 电子式
电子式___________ , 分子属于
分子属于___________ (填“极性”或“非极性”)分子,该分子中心原子杂化轨道类型___________ 。
②写出制备 的化学方程式
的化学方程式___________ 。
(2) 气体可处理污水中的
气体可处理污水中的 。
。 与
与 反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为___________ 。
(3)一定条件下,在水溶液中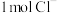 、
、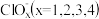 的能量(kJ)相对大小如图1所示。
的能量(kJ)相对大小如图1所示。___________ (填离子符号)。
②用离子符号表示B→A+C的热化学方程式___________ 。
(4)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 ,X为HClO或
,X为HClO或 与pH的关系如图2所示。HClO的电离常数
与pH的关系如图2所示。HClO的电离常数 值为
值为___________ 。 的两种制备方法:方法一:
的两种制备方法:方法一: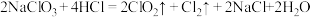
方法二: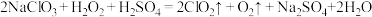
方法二制备的 更适合用于饮用水的消毒,其主要原因是
更适合用于饮用水的消毒,其主要原因是___________ 。
(1)
 为淡棕黄色气体,可由新制的HgO和
为淡棕黄色气体,可由新制的HgO和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。①
 电子式
电子式 分子属于
分子属于②写出制备
 的化学方程式
的化学方程式(2)
 气体可处理污水中的
气体可处理污水中的 。
。 与
与 反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为(3)一定条件下,在水溶液中
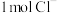 、
、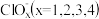 的能量(kJ)相对大小如图1所示。
的能量(kJ)相对大小如图1所示。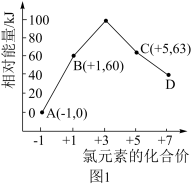
②用离子符号表示B→A+C的热化学方程式
(4)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 ,X为HClO或
,X为HClO或 与pH的关系如图2所示。HClO的电离常数
与pH的关系如图2所示。HClO的电离常数 值为
值为
 的两种制备方法:方法一:
的两种制备方法:方法一: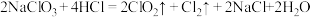
方法二:
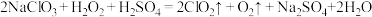
方法二制备的
 更适合用于饮用水的消毒,其主要原因是
更适合用于饮用水的消毒,其主要原因是
您最近一年使用:0次
2022-04-25更新
|
587次组卷
|
3卷引用:天津市部分区2022届高三质量调查(一)化学试题
8 . 便携式消毒除菌卡主要活性成分为亚氯酸钠(NaClO2),通过与空气作用释放低浓度二氧化氯(ClO2)杀菌消毒从而起到防护效果。一种制备NaClO2粗产品的工艺流程如下:
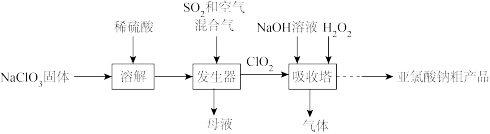
*纯ClO2易分解爆炸,一般用空气稀释到10%以下。下列说法错误的是

*纯ClO2易分解爆炸,一般用空气稀释到10%以下。下列说法错误的是
| A.母液中含有的溶质有NaHSO4 |
B.氧化性:H2O2>ClO2>ClO |
| C.发生器中鼓入空气的主要目的是稀释ClO2以防爆炸 |
| D.吸收塔中温度不宜过高,否则会导致H2O2分解 |
您最近一年使用:0次
2022-04-20更新
|
737次组卷
|
6卷引用:天津市第四十七中学2022-2023学年高三上学期期中考试化学试题
天津市第四十七中学2022-2023学年高三上学期期中考试化学试题重庆市主城区2022届高三第二次学业教学质量抽测化学试题(已下线)专题14 物质的反应和转化-三年(2020-2022)高考真题分项汇编(已下线)微专题20 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2023年高考化学一轮复习考点微专题陕西省安康中学2023届高三第一次检测性考试化学试题(已下线)学科特色7 工艺流程推断
名校
9 . 德国化学家哈伯在1918年荣获了诺贝尔化学奖,但是后人对他的评价却褒贬不一。
I.有人认为哈伯是一位伟大的科学家,因为他是实现人工合成氨并进行工业生产的第一人。所以赞美他是“用空气制造面包的天使”。
(1)工业上合成氨气的方程式:N2(g) + 3H2(g) ⇌ 2NH3(g), ΔH = -91.3 kJ/mol,下表为破坏1mol相关化学键需要的能量。
求a值:_____
(2)在密闭容器中合成氨气,有利于提高H2的转化率且加快反应速率的措施_____
A.升高反应温度 B.增大反应的压强 C.移走生成的NH3 D.增加H2的量 E.添加合适的催化剂
(3)将0.3 mol N2和0.9 mol H2充入3L密闭容器中,图为在不同温度下,平衡时NH3的体积分数随压强的变化曲线。

甲、乙、丙中温度从高到低的顺序是___________ ,d点N2的转化率是___________ 。(结果保留1位小数)
II.有人认为哈伯是一战的“催化剂”,因为在一战中,哈伯担任德国化学兵工厂厂长时负责研制和生产氯气、芥子气等毒气,并使用于战争之中,造成近百万人伤亡。
(4)实验室制备氯气后通常用NaOH溶液进行尾气处理,反应的温度不同产物也会有变化。某温度下发生的反应为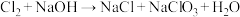 ,生成1 mol NaClO3被氧化的与被还原的Cl2的质量比例
,生成1 mol NaClO3被氧化的与被还原的Cl2的质量比例___________ 。
(5)将上述反应后的溶液倒入电解池的阳极区,可以提高NaClO3的含量,装置如图所示:

电极E是____ (填“阳极”或“阴极”),阳极区发生的反应:____
III.其实物质并没有好坏之分,关键是人们用这些物质来做了什么!
(6)请列举Cl2在日常生活中的作用(列举一种): Cl2_______
I.有人认为哈伯是一位伟大的科学家,因为他是实现人工合成氨并进行工业生产的第一人。所以赞美他是“用空气制造面包的天使”。
(1)工业上合成氨气的方程式:N2(g) + 3H2(g) ⇌ 2NH3(g), ΔH = -91.3 kJ/mol,下表为破坏1mol相关化学键需要的能量。
N N N | N_H | H_H |
| 945.8 kJ | a kJ | 435.9 kJ |
(2)在密闭容器中合成氨气,有利于提高H2的转化率且加快反应速率的措施
A.升高反应温度 B.增大反应的压强 C.移走生成的NH3 D.增加H2的量 E.添加合适的催化剂
(3)将0.3 mol N2和0.9 mol H2充入3L密闭容器中,图为在不同温度下,平衡时NH3的体积分数随压强的变化曲线。

甲、乙、丙中温度从高到低的顺序是
II.有人认为哈伯是一战的“催化剂”,因为在一战中,哈伯担任德国化学兵工厂厂长时负责研制和生产氯气、芥子气等毒气,并使用于战争之中,造成近百万人伤亡。
(4)实验室制备氯气后通常用NaOH溶液进行尾气处理,反应的温度不同产物也会有变化。某温度下发生的反应为
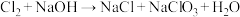 ,生成1 mol NaClO3被氧化的与被还原的Cl2的质量比例
,生成1 mol NaClO3被氧化的与被还原的Cl2的质量比例(5)将上述反应后的溶液倒入电解池的阳极区,可以提高NaClO3的含量,装置如图所示:

电极E是
III.其实物质并没有好坏之分,关键是人们用这些物质来做了什么!
(6)请列举Cl2在日常生活中的作用(列举一种): Cl2
您最近一年使用:0次
2022-04-13更新
|
923次组卷
|
8卷引用:天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题
天津市第一中学2022-2023学年高三上学期期末考试(第三次月考)化学试题天津市第一中学2022-2023学年高三上学期1月期末质量检测化学试题贵州省遵义市2022届高三模拟卷(二)理综化学试题(已下线)专题14化学反应原理综合-2022年高考真题+模拟题汇编(全国卷)(已下线)专题15化学反应原理综合-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题15化学反应原理综合-五年(2018~2022)高考真题汇编(全国卷)四川省绵阳南山中学2022-2023学年高三上学期入学考试理综化学试题四川省绵阳市高中2022-2023学年高二下学期理科突击班6月月考化学试题
名校
10 . 硫、氮及其化合物是这一段时间学习的重点。现就硫、氮及其化合物的知识,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应有关的化学方程式是:_______ 。
(2)为实现燃煤脱硫,向煤中加入 ,使燃烧产生的
,使燃烧产生的 转变为稳定的盐类,写出该反应的化学方程式:
转变为稳定的盐类,写出该反应的化学方程式:_______ 。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
① 被烧碱溶液吸收时,生成两种钠盐,其物质的量之比1:1,写出该反应的化学方程式:
被烧碱溶液吸收时,生成两种钠盐,其物质的量之比1:1,写出该反应的化学方程式:_______ 。
②NO与 按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是
按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是_______ 。
(4)浓氨水可以检验输送氯气的管道是否泄漏,如泄漏会冒白烟,写出该反应的化学方程式_______ (氨水用氨气表示)
(5)将一定量的锌与 浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的
浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的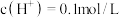 ,则反应过程中转移的电子的物质的量为
,则反应过程中转移的电子的物质的量为_______ 。
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应有关的化学方程式是:
(2)为实现燃煤脱硫,向煤中加入
 ,使燃烧产生的
,使燃烧产生的 转变为稳定的盐类,写出该反应的化学方程式:
转变为稳定的盐类,写出该反应的化学方程式:(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①
 被烧碱溶液吸收时,生成两种钠盐,其物质的量之比1:1,写出该反应的化学方程式:
被烧碱溶液吸收时,生成两种钠盐,其物质的量之比1:1,写出该反应的化学方程式:②NO与
 按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是
按物质的量之比1:1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是(4)浓氨水可以检验输送氯气的管道是否泄漏,如泄漏会冒白烟,写出该反应的化学方程式
(5)将一定量的锌与
 浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的
浓硫酸充分反应后,锌完全溶解,同时生成气体A33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的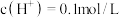 ,则反应过程中转移的电子的物质的量为
,则反应过程中转移的电子的物质的量为
您最近一年使用:0次



