解题方法
1 . 如图为实验室制取和收集氯气的实验装置图,并进行氯气性质探究。

请回答:
(1)实验室制氯气的化学方程式___________ ,此反应中 既表现
既表现___________ 性,又表现___________ 性;此反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)写出尾气吸收装置中氯气与氢氧化钠溶液反应的化学方程式:___________ 。
(3)下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是___________。
(4)将氯气通入碘化钾溶液反应的离子方程式:___________ 。该反应能够证明 的氧化性比
的氧化性比 的氧化性
的氧化性___________ (填“强”或“弱”)。
(5)实验室用下列两种方法制氯气:①用含
 的浓盐酸与足量的
的浓盐酸与足量的 反应;②用
反应;②用
 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量①___________ ②(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(6)某同学欲用上述实验中所用的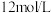 浓盐酸和蒸馏水配制
浓盐酸和蒸馏水配制
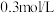 的稀盐酸,需要量取浓盐酸
的稀盐酸,需要量取浓盐酸___________  。
。

请回答:
(1)实验室制氯气的化学方程式
 既表现
既表现(2)写出尾气吸收装置中氯气与氢氧化钠溶液反应的化学方程式:
(3)下列氯化物中,既能由金属和氯气直接反应得到,又能由金属和盐酸反应制得的是___________。
A. | B. | C. | D. |
 的氧化性比
的氧化性比 的氧化性
的氧化性(5)实验室用下列两种方法制氯气:①用含

 的浓盐酸与足量的
的浓盐酸与足量的 反应;②用
反应;②用
 与足量浓盐酸反应。所得的氯气质量①
与足量浓盐酸反应。所得的氯气质量① ”、“
”、“ ”或“
”或“ ”)。
”)。(6)某同学欲用上述实验中所用的
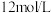 浓盐酸和蒸馏水配制
浓盐酸和蒸馏水配制
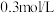 的稀盐酸,需要量取浓盐酸
的稀盐酸,需要量取浓盐酸 。
。
您最近一年使用:0次
2 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2594次组卷
|
11卷引用:天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题
天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题(已下线)热点19 化学微型实验北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
解题方法
3 . 某小组同学设计如下实验装置制备高铁酸钾 (夹持装置略),同时探究制备的适宜条件,已知:常温下,
(夹持装置略),同时探究制备的适宜条件,已知:常温下, 为紫色固体,微溶于KOH溶液。
为紫色固体,微溶于KOH溶液。
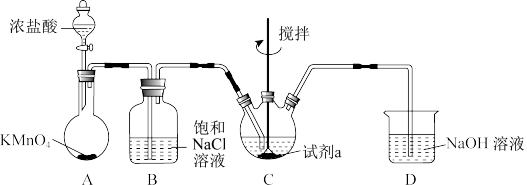
(1)装置A反应中的氧化剂为___________ 。
(2)进一步设计如下对比实验,探究在不同试剂a对 产率的影响。已知实验中,溶液总体积、
产率的影响。已知实验中,溶液总体积、 和
和 的物质的量、
的物质的量、 的通入量均相同。
的通入量均相同。
①对比实验i与ii现象,提出假设;“实验ii溶液碱性较强,、增强+3价铁的还原性”验证此假设的实验装置如图所示:

当通入 ,电压表示数为
,电压表示数为 ;再向右侧烧杯中加入的试剂为
;再向右侧烧杯中加入的试剂为___________ ,电压表示数为 ;且观察
;且观察
___________  (填“>”“<”或“=”)证明上述假设成立。
(填“>”“<”或“=”)证明上述假设成立。
②配平实验iii中反应的离子方程式:_________
□ □
□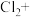 □
□ □
□ □
□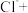 □
□
③实验ii中 的产率比实验iii的低,其原因可能是
的产率比实验iii的低,其原因可能是___________ 。
(3)随着反应的发生,装置B中不断有白色片状固体产生。
①结合化学用语解释该现象:___________ ;
②若拆除装置B,而使 的产率降低的原因是
的产率降低的原因是___________ 。
(4)向实验ii所得紫色溶液中继续通入 ,溶液紫色变浅,
,溶液紫色变浅, 的产率降低。可能原因是通入的
的产率降低。可能原因是通入的 消耗了KOH,写出该反应的离子方程式:
消耗了KOH,写出该反应的离子方程式:___________ 。
(5)综上可知制备 ,所需的适宜条件是
,所需的适宜条件是___________ 。
 (夹持装置略),同时探究制备的适宜条件,已知:常温下,
(夹持装置略),同时探究制备的适宜条件,已知:常温下, 为紫色固体,微溶于KOH溶液。
为紫色固体,微溶于KOH溶液。
(1)装置A反应中的氧化剂为
(2)进一步设计如下对比实验,探究在不同试剂a对
 产率的影响。已知实验中,溶液总体积、
产率的影响。已知实验中,溶液总体积、 和
和 的物质的量、
的物质的量、 的通入量均相同。
的通入量均相同。| 实验编号 | 试剂a | 实验现象 |
| i |  溶液和少量KOH 溶液和少量KOH | 无明显现象 |
| ii |  溶液和过量KOH 溶液和过量KOH | 得到紫色溶液,无紫色固体 |
| iii |  溶液和过量KOH 溶液和过量KOH | 得到深紫色溶液,有紫色固体 |

当通入
 ,电压表示数为
,电压表示数为 ;再向右侧烧杯中加入的试剂为
;再向右侧烧杯中加入的试剂为 ;且观察
;且观察
 (填“>”“<”或“=”)证明上述假设成立。
(填“>”“<”或“=”)证明上述假设成立。②配平实验iii中反应的离子方程式:
□
 □
□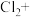 □
□ □
□ □
□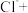 □
□③实验ii中
 的产率比实验iii的低,其原因可能是
的产率比实验iii的低,其原因可能是(3)随着反应的发生,装置B中不断有白色片状固体产生。
①结合化学用语解释该现象:
②若拆除装置B,而使
 的产率降低的原因是
的产率降低的原因是(4)向实验ii所得紫色溶液中继续通入
 ,溶液紫色变浅,
,溶液紫色变浅, 的产率降低。可能原因是通入的
的产率降低。可能原因是通入的 消耗了KOH,写出该反应的离子方程式:
消耗了KOH,写出该反应的离子方程式:(5)综上可知制备
 ,所需的适宜条件是
,所需的适宜条件是
您最近一年使用:0次
名校
4 . 非金属元素Si、N、S的单质及其化合物在生产生活中起到重要的作用。
I.氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是___________。(填序号)
II.
(2)为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置(尾气处理装置省略):

上述三套装置中,仅通过观察不能探究出“铜与浓硝酸反应是吸热反应还是放热反应”的是___________ (填“I”“II”或“III”)。
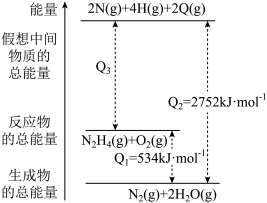
(3)已知化学反应 的能量变化如图所示,回答下列问题:
的能量变化如图所示,回答下列问题:
① 和
和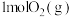 生成
生成 原子、
原子、 原子、
原子、 原子的过程中
原子的过程中___________ (填“吸收”或“放出”)___________  能量。
能量。
② 和
和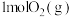 生成
生成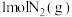 和
和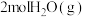 的反应中
的反应中___________ (填“吸收”或“放出”)___________  能量。
能量。
(4)下列性质的比较中,不能说明N的非金属性强于P的是___________ (填序号)。
A.熔沸点: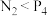 (白磷) B.稳定性:
(白磷) B.稳定性: C.酸性:
C.酸性:
III.
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理: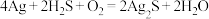 。
。 在该反应中___________(填标号)。
在该反应中___________(填标号)。
(6)酸雨中的亚硫酸易被氧化,如:能被酸性 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:___________ 。
I.氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是___________。(填序号)
| A.制汽轮机 | B.制有色玻璃 | C.制永久性模具 | D.制造柴油机 |
II.
(2)为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置(尾气处理装置省略):

上述三套装置中,仅通过观察不能探究出“铜与浓硝酸反应是吸热反应还是放热反应”的是
(3)已知化学反应
 的能量变化如图所示,回答下列问题:
的能量变化如图所示,回答下列问题:①
 和
和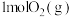 生成
生成 原子、
原子、 原子、
原子、 原子的过程中
原子的过程中 能量。
能量。②
 和
和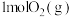 生成
生成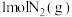 和
和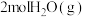 的反应中
的反应中 能量。
能量。
(4)下列性质的比较中,不能说明N的非金属性强于P的是
A.熔沸点:
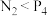 (白磷) B.稳定性:
(白磷) B.稳定性: C.酸性:
C.酸性:
III.
(5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:
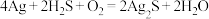 。
。 在该反应中___________(填标号)。
在该反应中___________(填标号)。| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 氧化为
氧化为 ,
, 被还原为
被还原为 ,写出此反应的离子方程式:
,写出此反应的离子方程式:
您最近一年使用:0次
名校
5 . 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法不正确的是


| A.用于循环的氢原子利用率为100% |
| B.太阳能可作为反应①和②的能量来源 |
C.反应①为 |
D.等物质的量的 和 和 含有的电子数相同 含有的电子数相同 |
您最近一年使用:0次
2023-03-16更新
|
2135次组卷
|
8卷引用:天津市红桥区2024届高三一模化学试题
解题方法
6 . 氯化亚铜(化学式可表示为CuCl)常用作有机合成工业中的催化剂,微溶于水、不溶于乙醇,在潮湿空气中易水解、易被氧化。某学习小组用工业废渣(主要成分为Cu2S和Fe2O3)制取CuCl并同时得到电路板蚀刻液,实验步骤如图:
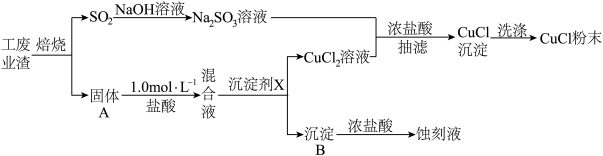
已知:
根据以上信息回答下列问题:
(1)写出焙烧过程中产生SO2的化学方程式:______ ;实验室中常用亚硫酸钠固体与70%的浓硫酸制备二氧化硫,若要达到控制反应速率的目的,图中可选用的装置是_____ (填标号)。
A.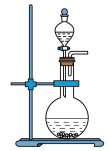 B.
B. C.
C. D.
D.
(2)混合液中加入的沉淀剂X可为______ ;(填化学式),调节溶液的pH至______ ,过滤得到CuCl2溶液。
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为______ 。
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。______
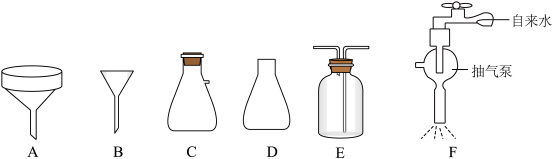
下列有关抽滤的说法错误的是_____ (填标号)。
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是______ 。
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为_____ ;氯化亚铜定量吸收CO后形成配合物Cu2(CO)2Cl2·2H2O(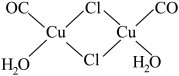 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为_____ (填化学式)。

已知:
| 金属阳离子 | 开始沉淀的pH | 完全沉淀的pH |
| Cu2+ | 4.8 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
(1)写出焙烧过程中产生SO2的化学方程式:
A.
 B.
B. C.
C. D.
D.
(2)混合液中加入的沉淀剂X可为
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。

下列有关抽滤的说法错误的是
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为
 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为
您最近一年使用:0次
2023-03-16更新
|
661次组卷
|
5卷引用:2022年天津市普通高中学业水平等级性考试化学试题变式题(实验综合题)
(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(实验综合题)河北省邯郸市2023届高三一模考试化学试题(已下线)专题16 实验题广西壮族自治区玉林市2022-2023学年高二下学期期中考试化学试题(已下线)工业流程题
真题
名校
7 . 燃油汽车行驶中会产生CO、NO等多种污染物。下图为汽车发动机及催化转化器中发生的部分化学反应。以下判断错误 的是
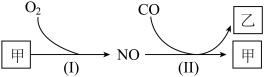

| A.甲是空气中体积分数最大的成分 | B.乙是引起温室效应的气体之一 |
| C.反应(Ⅰ)在常温下容易发生 | D.反应(Ⅱ)中NO是氧化剂 |
您最近一年使用:0次
2023-03-16更新
|
5475次组卷
|
14卷引用:2022年天津市普通高中学业水平等级性考试化学试题
2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(选择题5-8)辽宁省沈阳市第二中学2022-2023学年高一下学期第一阶段测试化学试题(已下线)专题09 氧化还原反应(已下线)专题09 氧化还原反应(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)(已下线)第13讲氮及其化合物(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西省渭南市富平县2023-2024学年高三摸底考试化学试题安徽省合肥市第一中学2023-2024学年高二上学期9月素质拓展(一)化学试题河北省衡水市武强中学2023-2024学年高三上学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高一下学期开学摸底考试化学试卷
解题方法
8 . 硝酸铈铵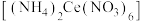 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。

(1)“沉淀1”时,溶液中 转化为
转化为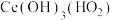 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:_______ 。
(2)“酸溶2”时,控制反应温度为80℃,硝酸与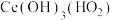 分解产生的
分解产生的 反应生成
反应生成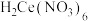 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是_______ 。
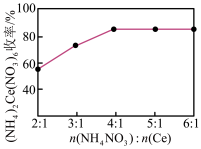
(3)“沉淀2”时,控制其他条件一定,改变加入 固体的量,测得
固体的量,测得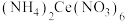 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是_______ 。
(4)实验小组以 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中,_______ ,得 固体。[已知:
固体。[已知: (白色沉淀)
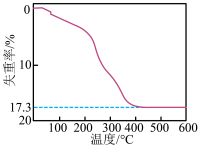
(白色沉淀)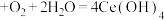 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、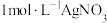 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为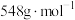 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用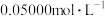 硫酸亚铁铵
硫酸亚铁铵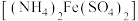 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数______ 。
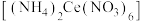 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。
(1)“沉淀1”时,溶液中
 转化为
转化为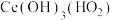 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:(2)“酸溶2”时,控制反应温度为80℃,硝酸与
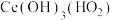 分解产生的
分解产生的 反应生成
反应生成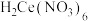 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是(3)“沉淀2”时,控制其他条件一定,改变加入
 固体的量,测得
固体的量,测得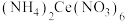 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是
(4)实验小组以
 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中, 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)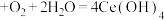 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、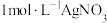 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为
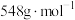 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用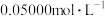 硫酸亚铁铵
硫酸亚铁铵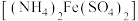 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
您最近一年使用:0次
解题方法
9 . 将23.0gNa溶于一定量水中,反应后溶液的体积为1.00L,设NA为阿伏加德罗常数的值,下列叙述错误 的是
| A.反应后溶液中c(OH-)为1.00mol/L | B.反应后溶液中Na+数目为NA |
| C.反应生成标准状况下气体22.4L | D.反应转移的电子数为NA |
您最近一年使用:0次
解题方法
10 . 金属及其化合物应用广泛,回答下列问题。
(1)钠长期置于空气中,最后形成的物质是_______ (填化学式),该物质与氯化钙溶液混合后,发生反应的离子方程式为_______ 。
(2)服用维生素C可将人体中的 转化成
转化成 ,这说明维生素C具有
,这说明维生素C具有_______ (填“还原”或“氧化”)性。
(3)红热的铁与水蒸气反应的化学方程式为_______ 。
(4)为消除废气中的 对环境的污染,将废气通过含有铁粉的
对环境的污染,将废气通过含有铁粉的 溶液,即可有效地除去
溶液,即可有效地除去 ,用离子方程式表示这一处理过程的原理:
,用离子方程式表示这一处理过程的原理:_______ 、_______ ;处理过程中需定期添加的原料是_______ (填名称)。
(5)某同学为检验某未知溶液是否含 ,采取如下实验方案加以验证:
,采取如下实验方案加以验证:
取少许未知溶液于试管中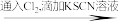 溶液呈红色(证明含有
溶液呈红色(证明含有 )
)
你认为此方案是否合理_______ (填“合理”或“不合理”);若不合理,如何改进_______ 。
(6)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应,写出反应的离子方程式_______ 。
(7)把0.5mol/L 溶液和0.5mol/L
溶液和0.5mol/L 溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量铁粉,经过充分反应后,铁粉有剩余。求此时溶液中
溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量铁粉,经过充分反应后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度_______ 。
(1)钠长期置于空气中,最后形成的物质是
(2)服用维生素C可将人体中的
 转化成
转化成 ,这说明维生素C具有
,这说明维生素C具有(3)红热的铁与水蒸气反应的化学方程式为
(4)为消除废气中的
 对环境的污染,将废气通过含有铁粉的
对环境的污染,将废气通过含有铁粉的 溶液,即可有效地除去
溶液,即可有效地除去 ,用离子方程式表示这一处理过程的原理:
,用离子方程式表示这一处理过程的原理:(5)某同学为检验某未知溶液是否含
 ,采取如下实验方案加以验证:
,采取如下实验方案加以验证:取少许未知溶液于试管中
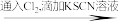 溶液呈红色(证明含有
溶液呈红色(证明含有 )
)你认为此方案是否合理
(6)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应,写出反应的离子方程式
(7)把0.5mol/L
 溶液和0.5mol/L
溶液和0.5mol/L 溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量铁粉,经过充分反应后,铁粉有剩余。求此时溶液中
溶液等体积混合(假设混合溶液的体积等于混合前两种溶液的体积之和),再向其中加入足量铁粉,经过充分反应后,铁粉有剩余。求此时溶液中 的物质的量浓度
的物质的量浓度
您最近一年使用:0次



