名校
解题方法
1 . 一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 HClO, 遇有机物易燃烧或爆炸,42℃以上易分解。制备出的Cl2O要冷却成固体才便于操作和保存,制取少量的Cl2O是用干燥的氧化汞和氯气反应:2HgO+2Cl2 = Cl2O+HgCl2·HgO (反应放热)。某化学兴趣小组设计如图装置以制备 Cl2O(支撑、加热及夹持装置已省略)。
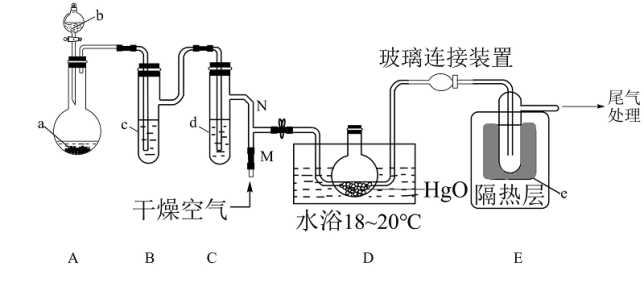
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
请回答:
(1)仪器b的名称___________
(2)写出装置 A 中制备 Cl2的化学方程式___________ 。
(3)B中盛有的液体c应是___________ ,C中的液体d的作用___________
(4)E中的保温瓶中盛有液态制冷剂e是___________ (在“干冰”“冰水”“液态空气”“液氨”“液氯”中选择一种)
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式___________ 。

已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
| Cl2O | N2 | O2 | CO2 | NH3 | Cl2 | |
| 熔点 | -120.6 ℃ | -209.86℃ | -218.4℃ | -78.5℃(升华) | -77.3℃ | -101℃ |
| 沸点 | 3.8℃ | -195.8℃ | -183℃ | -33.35℃ | -34.6℃ |
(1)仪器b的名称
(2)写出装置 A 中制备 Cl2的化学方程式
(3)B中盛有的液体c应是
(4)E中的保温瓶中盛有液态制冷剂e是
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式
您最近一年使用:0次
2021-11-08更新
|
379次组卷
|
3卷引用:天津滨海新区八所重点学校2021-2022学年高三下学期毕业班联考化学试题
名校
2 . 下列说法正确的有
(1)物质的量就是1 mol物质的质量
(2)1 mol H2O中含有2 mol氢和1 mol氧
(3)标准状况下,22.4 L O2、N2和CO的混合气体中含有2NA个原子
(4)7.8 g Na2O2中含有的阴离子数为0.1NA
(5)过氧化氢分解制得标准状况下1.12 L O2,转移电子数为0.2 NA
(6)31 g Na2O 溶于水,配成1 L溶液,c(Na2O)=0.5 mol/L
(7)1 L 0.1 mol/L NH4NO3溶液中含氧原子数目为0.3NA
(8)常温常压下,8 g O2含有4NA 个电子
(1)物质的量就是1 mol物质的质量
(2)1 mol H2O中含有2 mol氢和1 mol氧
(3)标准状况下,22.4 L O2、N2和CO的混合气体中含有2NA个原子
(4)7.8 g Na2O2中含有的阴离子数为0.1NA
(5)过氧化氢分解制得标准状况下1.12 L O2,转移电子数为0.2 NA
(6)31 g Na2O 溶于水,配成1 L溶液,c(Na2O)=0.5 mol/L
(7)1 L 0.1 mol/L NH4NO3溶液中含氧原子数目为0.3NA
(8)常温常压下,8 g O2含有4NA 个电子
| A.6个 | B.5个 | C.4个 | D.3个 |
您最近一年使用:0次
名校
3 . 请按要求书写下列离子方程式:
(1)利用FeCl3溶液制备胶体的离子方程式为_______
(2)Na2O2可以做防毒面具的供氧剂,写出与水反应的离子方程式_______ 。(用双线桥标出该反应电子转移的方向和数目)
(3)FeSO4的酸性溶液与H2O2反应试写出该反应的离子方程式:_______
(4)Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为_______ 。
(5)向NaClO溶液中通入少量的CO2离子方程式为_______ 。
(6)FeBr2溶液中通入等物质的量的Cl2气体,离子方程式为:_______
(7)工业上用次氯酸钠和FeCl3在碱性条件下制备新型绿色消毒剂高铁酸钠(Na2FeO4)该反应的离子方程式是:_______ 。
(8)书写离子方程式要注意哪些问题_______
(1)利用FeCl3溶液制备胶体的离子方程式为
(2)Na2O2可以做防毒面具的供氧剂,写出与水反应的离子方程式
(3)FeSO4的酸性溶液与H2O2反应试写出该反应的离子方程式:
(4)Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为
(5)向NaClO溶液中通入少量的CO2离子方程式为
(6)FeBr2溶液中通入等物质的量的Cl2气体,离子方程式为:
(7)工业上用次氯酸钠和FeCl3在碱性条件下制备新型绿色消毒剂高铁酸钠(Na2FeO4)该反应的离子方程式是:
(8)书写离子方程式要注意哪些问题
您最近一年使用:0次
4 . 实验室制备硫化氢往往用稀硫酸或稀盐酸而不能用稀硝酸是因为会发生以下反应: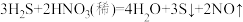
(1)在上述方程式上用单线桥标出电子转移的方向和数目。___________
(2)该反应中被还原的元素是___________ ,还原剂是___________ 。
(3)当有8个NO参加反应,上述反应转移的电子数目为___________ 个。
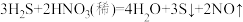
(1)在上述方程式上用单线桥标出电子转移的方向和数目。
(2)该反应中被还原的元素是
(3)当有8个NO参加反应,上述反应转移的电子数目为
您最近一年使用:0次
名校
5 . 固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
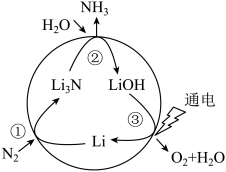
| A.反应①②③均为氧化还原反应 |
| B.转化过程中所涉及的元素均呈现了两种价态 |
C.假设每一步均完全转化,每生成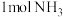 ,同时生成 ,同时生成 |
| D.参与反应的物质中含有的化学键有离子键、共价键和氢键 |
您最近一年使用:0次
2021-09-29更新
|
1479次组卷
|
17卷引用:天津市耀华中学2021-2022学年高三上学期第二次月考化学试题
天津市耀华中学2021-2022学年高三上学期第二次月考化学试题天津市耀华中学2022-2023学年高一下学期期中考试化学试题天津市第八中学2023-2024学年高三上学期第一次大单元教学(9月月考)化学试题天津市第二十中学2023-2024学年高一下学期学情调研(二)(期中)化学试卷广东省深圳大学附属中学2022届高三9月调研考试化学试题河北省河北衡水中学2021届高三下学期第一次调研考试化学试题(已下线)2022年新高考化学时事热点情境化考题---物质循环图河北省石家庄市第二中学2022届高三上学期11月第三次考试化学试题(已下线)第15周 晚练题-备战2022年高考化学周测与晚练(新高考专用)湖北省黄冈市2021-2022学年高三上学期11月联考化学试题福建泉州城东中学、南安华侨中学、惠安高级中学、泉港第二中学2021-2022高三上学期期中考试化学试题安徽省六安市第一中学2022届高三上学期第三次月考化学试题(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)山东省济北中学2021-2022学年高三上学期11月阶段性检测化学试题河北省唐山市开滦第一中学2022-2023学年高三上学期11月期中考试化学试题
真题
6 . CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应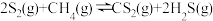 ,回答下列问题:
,回答下列问题:
(1)CH4的电子式为___________ ,CS2分子的立体构型为___________ 。
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________ 。
②当以下数值不变时,能说明该反应达到平衡的是___________ (填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________ 。___________ 。
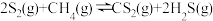 ,回答下列问题:
,回答下列问题:(1)CH4的电子式为
(2)某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
(3)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为

您最近一年使用:0次
2021-09-07更新
|
5964次组卷
|
4卷引用:2021年新高考天津化学高考真题
2021年新高考天津化学高考真题2021年天津高考化学试题变式题13-16(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习陕西省洛南中学2023-2024学年高三下学期第十次模拟考试理综试题-高中化学
7 . 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误 的是
| A.北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 |
| B.奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 |
| C.长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 |
| D.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料 |
您最近一年使用:0次
2021-09-07更新
|
7525次组卷
|
20卷引用:2021年新高考天津化学高考真题
2021年新高考天津化学高考真题天津市第三中学2021-2022学年高三上学期10月阶段性检测化学试题2021年天津高考化学试题变式题1-12天津市西青区杨柳青第一中学2021-2022学年高二下学期期末适应性测试(实验班)化学试题贵州省毕节市威宁第四中学2022届高三第一次月考化学试题山东省菏泽市单县第五中学希望部2021-2022学年高三上学期第一次月考化学试题湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题(已下线)秘籍02 化学与STSE-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷03 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点01 化学与STSE与传统文化-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)易错点02 化学与STSE-备战2023年高考化学考试易错题(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题01 STSE 物质的分类、性质与变化(练)-2023年高考化学二轮复习讲练测(新高考专用)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题湖南省岳阳市第一中学2022-2023高二上学期期末考试化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题(已下线)考点01 物质的分类及转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆阿克苏市实验中学2023-2024学年高三上学期第一次月考化学试题
8 . 用电石(主要成分为CaC2,含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析不正确的是
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析不正确的是
| A.CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O=Ca(OH)2+H2S↑、Ca3P2+6H2O=3Ca(OH)2+2PH3↑ |
| B.不能依据反应①比较硫酸与氢硫酸的酸性强弱 |
| C.反应②中每24 mol CuSO4氧化11 mol PH3 |
| D.用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰 |
您最近一年使用:0次
2021-09-03更新
|
7587次组卷
|
20卷引用:天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题
天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题2021年新高考北京化学高考真题2021年北京高考化学试题变式题1-10黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)上海南汇中学2021-2022学年高三下学期阶段考试化学试题(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题(已下线)热点情景汇编-专题三 氧化还原中的化学(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)河北正定中学2022-2023学年高二下学期第二次月考化学试题(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题北京师范大学第二附属中学2023-2024学年高三上学期10月月考化学试题北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市北京师范大学第二附属中学2021-2022学年高三上学期期中考试化学试题北京市第十三中学2023-2024学年高三上学期开学考化学试卷 北京八中2023-2024学年高二下学期3月月考化学试题(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
名校
9 . 研究氮及其化合物的性质,对有效改善人类的生存环境具有重要意义,请根据题意回答下列问题。
Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。氮及其化合物的转化关系如下图。

(1)路线①~⑤中表示氮的固定的是___________ (填标号)。
(2)完成路线②的转化,从原理上分析,加入下列试剂可行的是___________ (填标号)。
A. B.
B. C.
C. D.
D.
(3)路线④的反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)请用化学方程式说明浓硝酸一般盛放在棕色试剂瓶中的原因___________ 。
Ⅱ.某同学在实验室制备氨气,准备了一些如图装置。
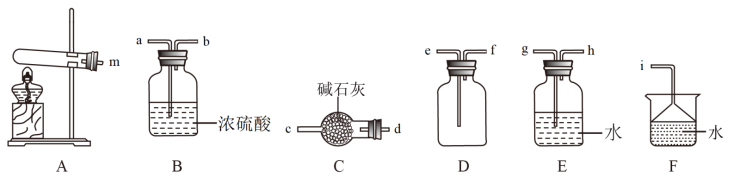
(1) 为实验室制取氨气的发生装置,反应的化学方程式为
为实验室制取氨气的发生装置,反应的化学方程式为___________ 。
(2)装置 中仪器的名称为
中仪器的名称为___________ 。
(3)欲收集一瓶干燥的氨气,挑选出上图中的适当装置,其连接顺序为:发生装置
___________ (按气流方向,用小写字母表示)。
Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个重要维度。氮及其化合物的转化关系如下图。

(1)路线①~⑤中表示氮的固定的是
(2)完成路线②的转化,从原理上分析,加入下列试剂可行的是
A.
 B.
B. C.
C. D.
D.
(3)路线④的反应中氧化剂与还原剂的物质的量之比为
(4)请用化学方程式说明浓硝酸一般盛放在棕色试剂瓶中的原因
Ⅱ.某同学在实验室制备氨气,准备了一些如图装置。

(1)
 为实验室制取氨气的发生装置,反应的化学方程式为
为实验室制取氨气的发生装置,反应的化学方程式为(2)装置
 中仪器的名称为
中仪器的名称为(3)欲收集一瓶干燥的氨气,挑选出上图中的适当装置,其连接顺序为:发生装置

您最近一年使用:0次
2021-07-22更新
|
430次组卷
|
3卷引用:天津市第七中学2022-2023学年高一下学期期中考试化学试题
天津市第七中学2022-2023学年高一下学期期中考试化学试题辽宁省锦州市2020-2021学年高一下学期期末考试化学试题(已下线)第09讲 硝酸-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)
真题
解题方法
10 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
的一种制备方法如下图所示: 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为_______ ,生成的沉淀与硝酸反应,生成_______ 后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为_______ ;若反应物用量比 时,氧化产物为
时,氧化产物为_______ ;当 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是_______ 。
(2)以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为_______ 。
(3) 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成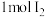 ,消耗的
,消耗的 至少为
至少为_______  。
。 在
在 溶液中可发生反应
溶液中可发生反应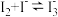 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是_______ 。
(1)
 的一种制备方法如下图所示:
的一种制备方法如下图所示: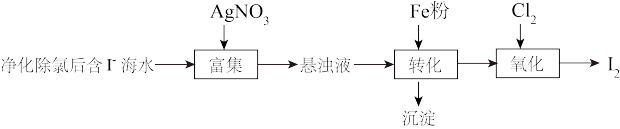
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为②通入
 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为 时,氧化产物为
时,氧化产物为 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是(2)以
 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入过量的
溶液中加入过量的 ,生成碘化物;再向混合溶液中加入
,生成碘化物;再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,上述制备
,上述制备 的总反应的离子方程式为
的总反应的离子方程式为(3)
 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成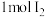 ,消耗的
,消耗的 至少为
至少为 。
。 在
在 溶液中可发生反应
溶液中可发生反应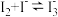 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是
您最近一年使用:0次
2021-06-11更新
|
20342次组卷
|
28卷引用:天津市第一零二中学2022届高三上学期第一次月考化学试题
天津市第一零二中学2022届高三上学期第一次月考化学试题2021年高考全国甲卷化学真题(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题讲座(二)陌生化学方程式书写(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向09 工艺流程初探-备战2022年高考化学一轮复习考点微专题(已下线)2021年高考全国甲卷化学试题变式题(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 氯及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)微专题 陌生情景中反应方程式的书写(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第2讲 卤素及海水提溴、提碘(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省济源英才学校2023-2024学年高三上学期11月月考 化学试卷云南省大理州实验中学2021-2022学年高二上学期化学期末考试题



