名校
解题方法
1 . 叶蛇纹石是一种富镁硅酸盐矿物[主要成分为Mg6(Si4O10)(OH)8,还含有Al2O3、Fe2O3、FeO等杂质],利用该矿物生产铁红(Fe2O3)和碱式碳酸镁的工艺流程如图所示:
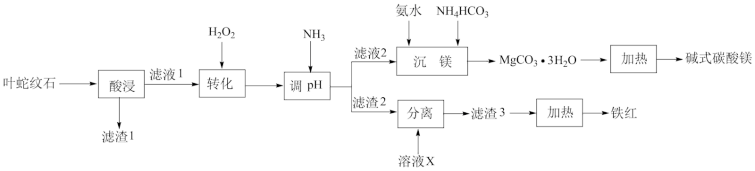
回答下列问题:
(1)“转化”步骤中,温度不能过高的原因是___________ 。
(2)“调pH”时,产生滤渣2的反应离子方程式为___________ 。
(3)X通常选用___________ (填化学式)。
(4)“沉镁”步骤中氨水加入的量不能太多,否则MgCO3·H2O的产率会降低,其原因是___________ 。
(5)取9.1g碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O],高温分解后,测得生成3.3gCO2、4.0gMgO,化学式中z=___________ 写出由MgCO3·3H2O生成产品的化学方程式:___________ 。
(6)碱式碳酸镁常用作新型阻燃剂,试分析碱式碳酸镁能够阻燃的原因:___________ 。(写出一点即可)。

回答下列问题:
(1)“转化”步骤中,温度不能过高的原因是
(2)“调pH”时,产生滤渣2的反应离子方程式为
(3)X通常选用
(4)“沉镁”步骤中氨水加入的量不能太多,否则MgCO3·H2O的产率会降低,其原因是
(5)取9.1g碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O],高温分解后,测得生成3.3gCO2、4.0gMgO,化学式中z=
(6)碱式碳酸镁常用作新型阻燃剂,试分析碱式碳酸镁能够阻燃的原因:
您最近一年使用:0次
2021-09-04更新
|
565次组卷
|
6卷引用:贵州省毕节市威宁第四中学2022届高三第一次月考化学试题
解题方法
2 . 铝热反应装置如下图:
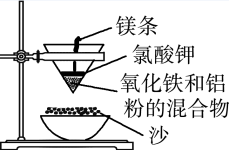
(1)该反应的化学方程式是_______ ;当消耗54g铝时,转移的电子数为_______ NA。
(2)若反应物无剩余,欲将生成物中的铁单质分离出来,采取的方法是:向生成物中加入足量的某种溶液,然后过滤。则这种溶液可以是:_______ (填序号)
①Ba(OH)2溶液 ②HCl溶液 ③NaOH溶液 ④H2SO4溶液
(3)写出反应物(Fe2O3、Al)分别与盐酸反应的离子方程式:_______ ;_______ 。

(1)该反应的化学方程式是
(2)若反应物无剩余,欲将生成物中的铁单质分离出来,采取的方法是:向生成物中加入足量的某种溶液,然后过滤。则这种溶液可以是:
①Ba(OH)2溶液 ②HCl溶液 ③NaOH溶液 ④H2SO4溶液
(3)写出反应物(Fe2O3、Al)分别与盐酸反应的离子方程式:
您最近一年使用:0次
2021-08-24更新
|
376次组卷
|
2卷引用:贵州省黔西南州同源中学2020-2021学年高一下学期期末化学试题
3 . Cl2既是实验室中的一种重要试剂,又是工业生产中的一种重要原料。
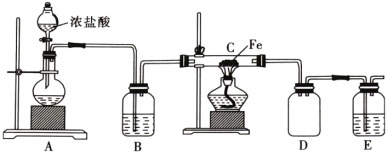
(1)实验室中利用铁屑与氯气反应制备 ,实验装置如图所示。
,实验装置如图所示。
①实验开始前,首先应________________________ 。
②盛浓盐酸的仪器的名称为________ 。
③装置A中观察到溶液紫色变浅,则发生反应的离子方程式为________________ ,还原剂为________ (填化学式,下同),氧化产物为________ 。
④每生成 时,消耗的
时,消耗的 为
为________ L (标准状况下),转移的电子数为________  。
。
(2)E中所盛装的试剂为________ (填“氢氧化钙”或“氢氧化钠”)溶液,原因是________________________ 。

(1)实验室中利用铁屑与氯气反应制备
 ,实验装置如图所示。
,实验装置如图所示。①实验开始前,首先应
②盛浓盐酸的仪器的名称为
③装置A中观察到溶液紫色变浅,则发生反应的离子方程式为
④每生成
 时,消耗的
时,消耗的 为
为 。
。(2)E中所盛装的试剂为
您最近一年使用:0次
解题方法
4 . 铬是一种重要的金属元素,它有很多用途,如镀层、合金、鞣革等。含铬废水有较大的毒性,必须处理达标后才能排放。某工业废水呈较强酸性,主要含Cr3+,同时含有少量的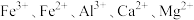 等。处理该废水并制备
等。处理该废水并制备 的主要流程如图所示。
的主要流程如图所示。
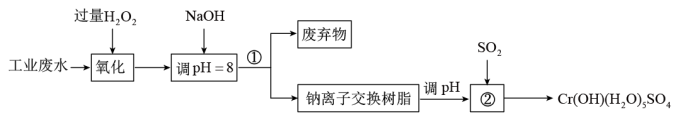
该工艺条件下,几种金属离子完全沉淀时的pH如下表所示:
回答下列问题:
(1)流程图中①的实验操作名称是_______ ,②的名称是_______
(2)加入NaOH调节溶液pH=8,一方面是在碱性条件下将三价铬氧化为 ,另一方面是为了除去
,另一方面是为了除去_______ 等金属离子。
(3)钠离子交换树脂可将溶液中重金属离子和高价阳离子交换吸附,则被交换的杂质离子是_______ (填序号)
(4) 与
与 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为_______ (写离子方程式不给分)。
(5)工业上也常用电解法处理含铬废水,先将 转化成
转化成 ,再利用如下图所示装置处理含铬废水。回答下列问题:
,再利用如下图所示装置处理含铬废水。回答下列问题:
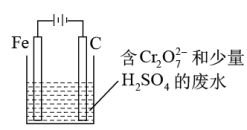
①电解时_______ (填“能”或“不能“)用Cu代替Fe电极。
②阳极附近 转化为
转化为 的离子方程式为
的离子方程式为_______ 。
③金属阳离子在阴极区域最终可沉淀完全,原因是_______ 。
 等。处理该废水并制备
等。处理该废水并制备 的主要流程如图所示。
的主要流程如图所示。
该工艺条件下,几种金属离子完全沉淀时的pH如下表所示:
| 离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 完全沉淀时的pH | 3.2 | 9.0 | 11.1 | 5.0 | 9.0 |
回答下列问题:
(1)流程图中①的实验操作名称是
(2)加入NaOH调节溶液pH=8,一方面是在碱性条件下将三价铬氧化为
 ,另一方面是为了除去
,另一方面是为了除去(3)钠离子交换树脂可将溶液中重金属离子和高价阳离子交换吸附,则被交换的杂质离子是
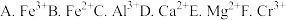
(4)
 与
与 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为(5)工业上也常用电解法处理含铬废水,先将
 转化成
转化成 ,再利用如下图所示装置处理含铬废水。回答下列问题:
,再利用如下图所示装置处理含铬废水。回答下列问题:
①电解时
②阳极附近
 转化为
转化为 的离子方程式为
的离子方程式为③金属阳离子在阴极区域最终可沉淀完全,原因是
您最近一年使用:0次
5 . 实验室中利用固体KMnO4进行如图实验,下列说法错误的是
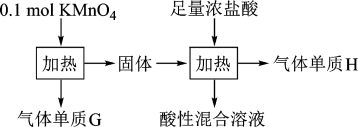

| A.G与H均为氧化产物 | B.实验中KMnO4只作氧化剂 |
| C.Mn元素至少参与了3个氧化还原反应 | D.G与H的物质的量之和可能为0.25mol |
您最近一年使用:0次
2021-06-29更新
|
8447次组卷
|
20卷引用:贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题
贵州省遵义市第一中学2022-2023学年高一上学期期中考试化学试题2021年新高考山东化学高考真题山东省济宁市实验中学2022届高三上学期开学考试化学试题(已下线)专题04 氧化还原反应-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省枣庄市第三中学2022届高三第一次月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题2021年山东高考化学试题变式题11-20(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)河北省邯郸市大名县第一中学2021-2022学年高二下学期期末考试化学试题江西省樟树航天中学高三年级2021-2022学年高三上学期10月调研考试化学试题山东省新泰市第一中学2022—2023学年高一上学期期中考试化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学(已下线)专题04 氧化还原反应及其应用(讲)-2023年高考化学二轮复习讲练测(新高考专用)湖南省株洲市第二中学2023届高三上学期第二次月考化学试题(已下线)专题08 氧化还原反应方程式的书写及计算-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考通用)(已下线)题型16 氧化还原反应基本概念的判断(已下线)第4讲 氧化还原反应的基本概念与规律(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)
6 . 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOX还原成N2,某同学在实验室中,对NH3与NO2反应进行了探究,回答下列问题:
(1)写出NH3和NO2生成N2的化学方程式_______ ,该反应中氧化剂和还原剂的物质的量之比_______ 。生成1molN2转移的电子数为_______ NA.被氧化的物质物质的量为_______ mol
(2)某同学认为铜和浓硝酸在常温下可制得NO2,由此可推测出铁和浓硝酸在常温下也能制得NO2,他的推测正确吗?_______ (“正确”或“不正确”),请说明原因_______ 。
(1)写出NH3和NO2生成N2的化学方程式
(2)某同学认为铜和浓硝酸在常温下可制得NO2,由此可推测出铁和浓硝酸在常温下也能制得NO2,他的推测正确吗?
您最近一年使用:0次
解题方法
7 . 2020年12月,嫦娥五号从月球挖的“土”正式移交了相关科研单位。研究者在月球土壤中发现了辉钼矿,辉铝矿(主要成分为MoS,含少量杂质)可用于制备单质钼和钼酸钠晶体( )。其中一种生产工艺如下(部分产物和条件已省略):
)。其中一种生产工艺如下(部分产物和条件已省略):

回答下列问题:
(1)焙烧时,粉碎后的矿石从炉顶进入,空气从炉底进入,目的是_______ ;该工艺中尾气的主要污染物是_______ (填化学式);新一代清洁生产工艺在增烧时加入 会更环保,其原因是
会更环保,其原因是_______ (用化学方程式解释)。
(2)写出加氨水时所发生反应的离子反应方程式_______ 。
(3)已知钼酸钠在一定温度范围内析出的物质如下表,则操作2中应控制温度的最佳范围为_______ (填字母序号),结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是_______ 。
a.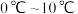 b.
b.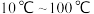 c.
c. d.
d. 以上
以上
(4)在制备钼酸钠晶体过程中需加入 固体除去
固体除去 ,若溶液中
,若溶液中 ,常温下,当
,常温下,当 开始沉淀时,
开始沉淀时, 的物质的量浓度为
的物质的量浓度为_______  。[忽略溶液体积变化,已知:25℃,
。[忽略溶液体积变化,已知:25℃, ,
, ]
]
(5)高纯Mo可用于制造电池级 ,
,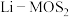 电池是一种性能优异的二次电池,其电池反应为:
电池是一种性能优异的二次电池,其电池反应为: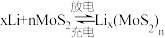 ,该电池放电时正极反应为
,该电池放电时正极反应为_______ ;充电时 移向
移向_______ (填“阳极”或“阴极”)。
 )。其中一种生产工艺如下(部分产物和条件已省略):
)。其中一种生产工艺如下(部分产物和条件已省略):
回答下列问题:
(1)焙烧时,粉碎后的矿石从炉顶进入,空气从炉底进入,目的是
 会更环保,其原因是
会更环保,其原因是(2)写出加氨水时所发生反应的离子反应方程式
(3)已知钼酸钠在一定温度范围内析出的物质如下表,则操作2中应控制温度的最佳范围为
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |  |
| 析出物质 |  |  |  | ||||||
a.
 b.
b.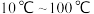 c.
c. d.
d. 以上
以上(4)在制备钼酸钠晶体过程中需加入
 固体除去
固体除去 ,若溶液中
,若溶液中 ,常温下,当
,常温下,当 开始沉淀时,
开始沉淀时, 的物质的量浓度为
的物质的量浓度为 。[忽略溶液体积变化,已知:25℃,
。[忽略溶液体积变化,已知:25℃, ,
, ]
](5)高纯Mo可用于制造电池级
 ,
,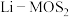 电池是一种性能优异的二次电池,其电池反应为:
电池是一种性能优异的二次电池,其电池反应为: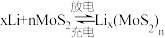 ,该电池放电时正极反应为
,该电池放电时正极反应为 移向
移向
您最近一年使用:0次



