名校
1 . 氧化还原反应在日常生活、工农业生产和科学技术中应用广泛。
(1)氧化还原反应的实质是___________ 。
(2)废钒催化剂回收工艺中涉及的反应为 。
。
已知氯气与亚硫酸根离子会发生反应: ;根据上述两个反应,可推出
;根据上述两个反应,可推出 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ 。
(3)某实验兴趣小组根据氧化还原反应相关知识。探究 、
、 、
、 三者的氧化性强弱,设计实验装置如图:
三者的氧化性强弱,设计实验装置如图:

①实验Ⅰ的现象是___________ ;实验Ⅱ的现象是___________ 。
②实验Ⅱ发生反应的离子方程式为___________ 。
③综合实验Ⅰ和实验Ⅱ的现象及氧化还原反应的理论知识,可推测出 、
、 、
、 三者的氧化性由强到弱的顺序为
三者的氧化性由强到弱的顺序为___________ 。
④当两实验过程中发生的氧化还原反应转移的电子数相同时,铁丝与铜丝增重的质量之比为___________ 。(已知:实验起始时,铁丝与铜丝的质量相同且均足量)
(1)氧化还原反应的实质是
(2)废钒催化剂回收工艺中涉及的反应为
 。
。已知氯气与亚硫酸根离子会发生反应:
 ;根据上述两个反应,可推出
;根据上述两个反应,可推出 、
、 、
、 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为(3)某实验兴趣小组根据氧化还原反应相关知识。探究
 、
、 、
、 三者的氧化性强弱,设计实验装置如图:
三者的氧化性强弱,设计实验装置如图:
①实验Ⅰ的现象是
②实验Ⅱ发生反应的离子方程式为
③综合实验Ⅰ和实验Ⅱ的现象及氧化还原反应的理论知识,可推测出
 、
、 、
、 三者的氧化性由强到弱的顺序为
三者的氧化性由强到弱的顺序为④当两实验过程中发生的氧化还原反应转移的电子数相同时,铁丝与铜丝增重的质量之比为
您最近一年使用:0次
2021-11-15更新
|
207次组卷
|
4卷引用:贵州省遵义市2021-2022学年高一上学期期中联合考试化学试题
2 . 四钼酸铵是钼深加工的重要中间产品具有广泛的用途。一种以钼精矿(主要含 ,还有
,还有 、
、 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。

回答下列问题:
(1)“焙烧”产生的气体用_______ 吸收后可制取氮肥。
(2)“浸出”时, 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有_______ (任写两种)。温度对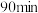 内钼浸出率的影响如图所示。当浸出温度超过
内钼浸出率的影响如图所示。当浸出温度超过 后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致_______ 。

(3)“净化”时,浸出液中残留的 、
、 转化为沉淀除去。研究表明,该溶液中
转化为沉淀除去。研究表明,该溶液中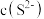 和pH的关系为:
和pH的关系为: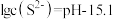 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于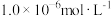 ,应控制溶液的pH不小于
,应控制溶液的pH不小于_______ 。(已知: ;
; 和
和 的
的 分别为35.2和17.2)
分别为35.2和17.2)
(4)“净化”后,溶液中若有低价钼(以 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(5)“沉淀”时,加入 的目的是
的目的是_______ 。
(6)高温下用 还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为
还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为_______ 。【已知:(NH4)2Mo4O13受热分解生成 】
】
 ,还有
,还有 、
、 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。
回答下列问题:
(1)“焙烧”产生的气体用
(2)“浸出”时,
 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有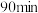 内钼浸出率的影响如图所示。当浸出温度超过
内钼浸出率的影响如图所示。当浸出温度超过 后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
(3)“净化”时,浸出液中残留的
 、
、 转化为沉淀除去。研究表明,该溶液中
转化为沉淀除去。研究表明,该溶液中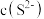 和pH的关系为:
和pH的关系为: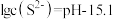 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于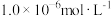 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;
; 和
和 的
的 分别为35.2和17.2)
分别为35.2和17.2)(4)“净化”后,溶液中若有低价钼(以
 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)“沉淀”时,加入
 的目的是
的目的是(6)高温下用
 还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为
还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为 】
】
您最近一年使用:0次
2021-11-09更新
|
8284次组卷
|
12卷引用:贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题
贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题2021年新高考福建化学高考真题(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第55练 无机化工流程题的解题策略(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题
解题方法
3 . 四氧化三锰是一种重要的化工产品,主要用于电子工业,一种以软锰矿(主要成分为MnO2,杂质金属元素为Fe、Mg、Al等)、硫铁矿(主要成分为FeS2,杂质主要为SiO2等)为原料制备Mn3O4的工艺流程如图。
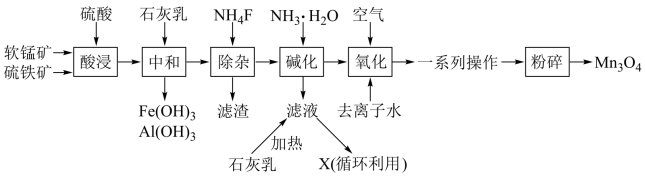
回答下列问题:
(1)流程中多次用到了过滤操作,该操作所用的玻璃仪器有普通漏斗、烧杯、___ 。
(2)为了提高“酸浸”时的浸取速率,可采取的措施有___ (任写一种);“酸浸”时生成Fe2(SO4)3和MnSO4的化学方程式为___ 。
(3)常温时部分金属离子在溶液中完全沉淀时的pH如表所示:
则“中和”时调节溶液pH的最小值为___ (填整数),“除杂”时,滤渣的主要成分为___ (填化学式)。
(4)循环利用的物质X为___ (填化学式),生成该物质的离子方程式为___ ;证明Mn(OH)2已洗涤干净的操作为___ 。
(5)“一系列操作”包括___ 。

回答下列问题:
(1)流程中多次用到了过滤操作,该操作所用的玻璃仪器有普通漏斗、烧杯、
(2)为了提高“酸浸”时的浸取速率,可采取的措施有
(3)常温时部分金属离子在溶液中完全沉淀时的pH如表所示:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 9.7 | 3.2 | 4.7 | 10.4 | 12.4 |
则“中和”时调节溶液pH的最小值为
(4)循环利用的物质X为
(5)“一系列操作”包括
您最近一年使用:0次
4 . 二氟化氧(OF2)的键角为103°,是一种无色的剧毒气体,能发生反应:6OF2+4N2+O2=4NF3+4NO2,下列有关说法正确的是
| A.OF2难溶于CCl4 |
| B.在该反应中氧化剂是N2 |
| C.OF2分子中O与F之间存在的是离子键 |
| D.当有1molNO2生成时,该反应转移的电子数为4×6.02×1023 |
您最近一年使用:0次
2021-10-12更新
|
529次组卷
|
4卷引用:贵州省瓮安中学2022-2023学年高二下学期3月月考化学试题
5 . 在抗击新冠肺炎疫情的战役中,病毒在不断发生变异,现有疫苗对变异病毒的有效性有待进一步的验证,因此民众的防疫意识不能松懈。
(1)口罩作为基础防疫物资,可以有效防止飞沫的传播。最新的研究表明新冠病毒可能通过气溶胶传播。气溶胶属于_______ (填“胶体”或“溶液”);常利用_______ 区分溶液和胶体。
(2)为有效防止新冠病海的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+ 4HCl(浓) = MnCl2 +2H2O+Cl2↑
b. 2KMnO4+16HCl(浓) = 2KCl+2MnCl2 +5Cl2↑+8H2O
c. KClO3 +6HCl(浓) = KCl+3Cl2 ↑+3H2O
①常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是_______ ,属于混合物的是_______ ,属于电解质的是_______ 。
②写出反应b对应的离子方程式:_______ [已知HCl(浓)可拆分为H+和Cl-]
③当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是_______ 反应(填“a”、“b”、“c”下同);当得到等质量的Cl2时,消耗HCl的质量最多的是_______ 反应。
(1)口罩作为基础防疫物资,可以有效防止飞沫的传播。最新的研究表明新冠病毒可能通过气溶胶传播。气溶胶属于
(2)为有效防止新冠病海的传播,除了戴口罩,还需加强对隔离场所的消毒。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂。其中含氯消毒剂的家族最庞大、应用最广泛。实验室制备Cl2有三种常用方法:
a.MnO2+ 4HCl(浓) = MnCl2 +2H2O+Cl2↑
b. 2KMnO4+16HCl(浓) = 2KCl+2MnCl2 +5Cl2↑+8H2O
c. KClO3 +6HCl(浓) = KCl+3Cl2 ↑+3H2O
①常温下,医用酒精、Cl2、KMnO4、MnCl2、浓盐酸中能导电的是
②写出反应b对应的离子方程式:
③当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是
您最近一年使用:0次
2021-10-11更新
|
154次组卷
|
2卷引用:贵州省毕节市2021-2022学年高一上学期第一次联考化学试题
6 . 已知:某含氯元素的粒子M与 发生氧化还原反应的离子方程式为
发生氧化还原反应的离子方程式为 (已配平)。则物质M、N中氯元素的化合价分别为
(已配平)。则物质M、N中氯元素的化合价分别为
 发生氧化还原反应的离子方程式为
发生氧化还原反应的离子方程式为 (已配平)。则物质M、N中氯元素的化合价分别为
(已配平)。则物质M、N中氯元素的化合价分别为A. 价、 价、 价 价 | B. 价、0价 价、0价 | C.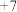 价、 价、 价 价 | D.0价、 价 价 |
您最近一年使用:0次
2021-10-10更新
|
334次组卷
|
6卷引用:贵州省遵义市2021-2022学年高一上学期期中联合考试化学试题
名校
7 . 某危险品仓库中存放了有剧毒的化工原料氰化钠(NaCN,其中N元素的化合价为 价),NaCN潮解或遇酸会反应生成有剧毒的气体氰化氢(HCN)。一旦发生NaCN泄漏,就必须将已经泄漏的NaCN做无害化处理,使
价),NaCN潮解或遇酸会反应生成有剧毒的气体氰化氢(HCN)。一旦发生NaCN泄漏,就必须将已经泄漏的NaCN做无害化处理,使 转化为无毒气体
转化为无毒气体 。下列物质中,可用于处理泄漏的NaCN的是
。下列物质中,可用于处理泄漏的NaCN的是
 价),NaCN潮解或遇酸会反应生成有剧毒的气体氰化氢(HCN)。一旦发生NaCN泄漏,就必须将已经泄漏的NaCN做无害化处理,使
价),NaCN潮解或遇酸会反应生成有剧毒的气体氰化氢(HCN)。一旦发生NaCN泄漏,就必须将已经泄漏的NaCN做无害化处理,使 转化为无毒气体
转化为无毒气体 。下列物质中,可用于处理泄漏的NaCN的是
。下列物质中,可用于处理泄漏的NaCN的是| A.双氧水 | B.NaOH | C.Fe粉 | D.稀硫酸 |
您最近一年使用:0次
2021-10-10更新
|
178次组卷
|
4卷引用:贵州省遵义市2021-2022学年高一上学期期中联合考试化学试题
8 . 高铁酸钠(Na2FeO4)是水处理过程中的一种新型的绿色多功能净水剂。其净水过程中所发生的化学反应主要为4Na2FeO4 + 10H2O = 4Fe(OH)3 (胶体)+3O2↑+8NaOH。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
(1)高铁酸钠(Na2FeO4)属于_______ (“酸”、“碱”、“盐”或“氧化物”),其中铁的化合价为_______ 价;与O2 互为同素异形体的物质的化学式为_______ 。
(2)将上述反应的化学方程式改写成离子方程式:_______
(3)实验室制备Fe(OH)3 胶体的操作:向烧杯中加入40 mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴_______ (填化学式)饱和溶液,继续煮沸至_______ 呈_______ ,停止加热。
(4)当生成48g O2时,至少有_______ g水参与反应,生成的NaOH的质量为_______ g。
(1)高铁酸钠(Na2FeO4)属于
(2)将上述反应的化学方程式改写成离子方程式:
(3)实验室制备Fe(OH)3 胶体的操作:向烧杯中加入40 mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴
(4)当生成48g O2时,至少有
您最近一年使用:0次
2021-10-10更新
|
124次组卷
|
2卷引用:贵州省毕节市2021-2022学年高一上学期第一次联考化学试题
解题方法
9 . 锆产品的主要原料是锆英砂,全球90%的氧氯化锆(ZrOCl2)来源于中国。氧氯化锆可溶于水,微溶于盐酸,工业上以锆英砂(含91.5%ZrSiO4,杂质不与NaOH溶液反应)为原料生产ZrOCl2的一种工艺流程如图所示。
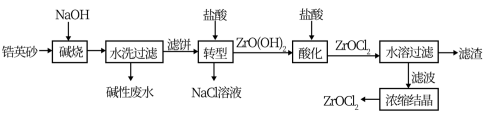
已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是____ ,“碱烧”时ZrSiO4生成了Na2ZrO3和另一种钠盐X,X的化学式为___ ,X的用途是___ (写一种)。
(2)“转型”时发生反应的化学方程式为___ 。
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是___ 。
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是___ 。
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成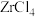 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___ 。
(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为___ t。

已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是
(2)“转型”时发生反应的化学方程式为
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成
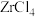 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为
您最近一年使用:0次
2021-10-01更新
|
517次组卷
|
5卷引用:贵州省黔西南州2021~2022学年高二上学期期中考试化学试题
贵州省黔西南州2021~2022学年高二上学期期中考试化学试题河南省偃师市第一高级中学2022届高三阶段性测试化学试题福建省南平市2022届高三10月联考化学试卷重庆市2021-2022学年高二上学期期中考试化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-测试
10 . 近年我国在科学技术领域取得了举世瞩目的成就。对下列成就所涉及的化学知识的判断错误 的是
| A.北斗三号卫星搭载了精密计时的铷原子钟,铷(Rb)是金属元素 |
| B.奋斗者号潜水器载人舱外壳使用了钛合金,钛合金属于无机非金属材料 |
| C.长征五号B遥二火箭把天和核心舱送入太空,火箭动力源于氧化还原反应 |
| D.天问一号探测器着陆火星过程中使用了芳纶制作的降落伞,芳纶是高分子材料 |
您最近一年使用:0次
2021-09-07更新
|
7523次组卷
|
20卷引用:贵州省毕节市威宁第四中学2022届高三第一次月考化学试题
贵州省毕节市威宁第四中学2022届高三第一次月考化学试题2021年新高考天津化学高考真题山东省菏泽市单县第五中学希望部2021-2022学年高三上学期第一次月考化学试题天津市第三中学2021-2022学年高三上学期10月阶段性检测化学试题湖南师范大学附属中学2021-2022学年高三上学期月考(三)化学试题2021年天津高考化学试题变式题1-12(已下线)秘籍02 化学与STSE-备战2022年高考化学抢分秘籍(全国通用)(已下线)卷03 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)回归教材重难点01 化学与STSE与传统文化-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题天津市西青区杨柳青第一中学2021-2022学年高二下学期期末适应性测试(实验班)化学试题山东省临沂市兰陵县第四中学2021-2022学年高三12月月考化学试题(已下线)易错点02 化学与STSE-备战2023年高考化学考试易错题(已下线)易错点08 金属材料-备战2023年高考化学考试易错题(已下线)专题01 STSE 物质的分类、性质与变化(练)-2023年高考化学二轮复习讲练测(新高考专用)山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题湖南省岳阳市第一中学2022-2023高二上学期期末考试化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期期末考试化学试题(已下线)考点01 物质的分类及转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆阿克苏市实验中学2023-2024学年高三上学期第一次月考化学试题



