1 . 新的研究表明,可以将 转化为炭黑进行回收利用,反应原理如图所示。下列有关说法错误的是
转化为炭黑进行回收利用,反应原理如图所示。下列有关说法错误的是
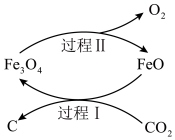
 转化为炭黑进行回收利用,反应原理如图所示。下列有关说法错误的是
转化为炭黑进行回收利用,反应原理如图所示。下列有关说法错误的是
| A.FeO是该反应的催化剂 |
| B.反应过程中有非极性键的形成 |
C.过程Ⅱ中生成的FeO与 的物质的量之比为3∶1 的物质的量之比为3∶1 |
| D.若将该研究大规模应用于工业生产,有利于实现“碳中和” |
您最近一年使用:0次
解题方法
2 . 利用氯元素价类二维图,可以从不同角度研究含氯物质的性质及其转化关系。回答下列问题:
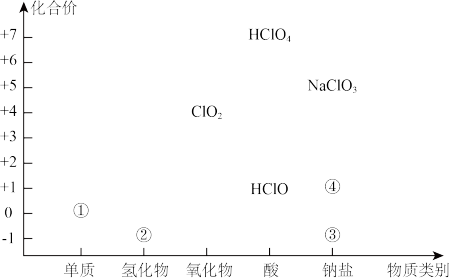
(1)②为_______ (写化学式),写出③的一种用途:_______ 。
(2)常温下,①可与NaOH溶液反应生成③和④,请写出该反应的化学方程式:_______ ,该反应也是漂白液的制备原理,漂白液的有效成分为_______ 。
(3)控制温度,①可与NaOH溶液反应生成 :
: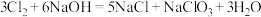 ,被氧化的氯原子与被还原的氯原子的物质的量之比为
,被氧化的氯原子与被还原的氯原子的物质的量之比为_______ 。
(4)已知 是一元强酸,则它与NaOH反应的离子方程式为
是一元强酸,则它与NaOH反应的离子方程式为_______ 。
(5)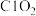 可用于自来水消毒,检验自来水中是否含有
可用于自来水消毒,检验自来水中是否含有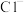 的试剂为
的试剂为_______ , 还可将水中的
还可将水中的 转化为
转化为 ,
, 再生成
再生成 胶体,说明
胶体,说明 具有
具有_______ 性,检验有胶体生成的简便方法为_______ 。

(1)②为
(2)常温下,①可与NaOH溶液反应生成③和④,请写出该反应的化学方程式:
(3)控制温度,①可与NaOH溶液反应生成
 :
: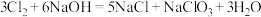 ,被氧化的氯原子与被还原的氯原子的物质的量之比为
,被氧化的氯原子与被还原的氯原子的物质的量之比为(4)已知
 是一元强酸,则它与NaOH反应的离子方程式为
是一元强酸,则它与NaOH反应的离子方程式为(5)
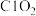 可用于自来水消毒,检验自来水中是否含有
可用于自来水消毒,检验自来水中是否含有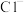 的试剂为
的试剂为 还可将水中的
还可将水中的 转化为
转化为 ,
, 再生成
再生成 胶体,说明
胶体,说明 具有
具有
您最近一年使用:0次
3 . 8.12天津爆炸事故现场中的NaCN会进入水体,造成环境污染。氯氧化法可处理含CN﹣的废水,在碱性条件下,液氯将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐可进一步被液氯氧化为无毒物质。涉及反应如下(化合物中的N均为﹣3价):
①NaCN+2NaOH+Cl2=NaOCN+2NaCl+H2O
②NaOCN+NaOH+Cl2 CO2+N2+NaCl+H2O
CO2+N2+NaCl+H2O
(1)请配平反应②的化学方程式_______ 。
(2)某废水中含NaCN,其浓度为490mg/L,现用氯氧化法处理。若处理该废水20L,使NaCN完全转化为无毒物质,至少需液氯_______ g。
①NaCN+2NaOH+Cl2=NaOCN+2NaCl+H2O
②NaOCN+NaOH+Cl2
 CO2+N2+NaCl+H2O
CO2+N2+NaCl+H2O(1)请配平反应②的化学方程式
(2)某废水中含NaCN,其浓度为490mg/L,现用氯氧化法处理。若处理该废水20L,使NaCN完全转化为无毒物质,至少需液氯
您最近一年使用:0次
名校
解题方法
4 . 下列实验操作、方法和装置均正确的是


| A.图①为制取少量氧气并可以控制反应停止 |
| B.图②为碳酸氢钠受热分解 |
| C.图③为比较高锰酸钾、氯气和硫的氧化性 |
| D.图④为配制100mL2mol/L稀硫酸溶液 |
您最近一年使用:0次
2022-10-12更新
|
515次组卷
|
5卷引用:选择题1-5
名校
解题方法
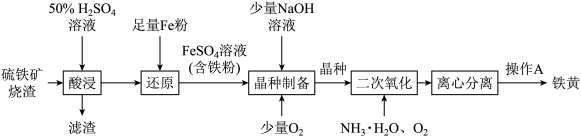
5 . 硫铁矿烧渣主要成分是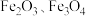 、少量
、少量 和CaO等。铁黄(FeOOH)主要用于涂料、水泥制件等。以硫铁矿烧渣为原料制备铁黄的工艺流程如下:
和CaO等。铁黄(FeOOH)主要用于涂料、水泥制件等。以硫铁矿烧渣为原料制备铁黄的工艺流程如下:
回答下列问题:
(1)“滤渣”的主要成分是_______ (填化学式)。
(2)操作A为_______ 。
(3)晶种制备过程中溶液pH与时间的关系如图:
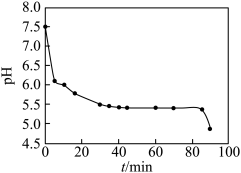
在反应前期(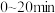 )溶液的pH随时间的延长而直线下降,是因为通入
)溶液的pH随时间的延长而直线下降,是因为通入 后,溶液中
后,溶液中 生成FeOOH晶种时发生反应
生成FeOOH晶种时发生反应_______ (写离子方程式),使溶液pH降低,同时NaOH与 反应生成
反应生成 絮状物。
絮状物。
(4)二次氧化的目的是将 和
和 进一步转化为铁黄,写出
进一步转化为铁黄,写出 转化为铁黄的离子方程式:
转化为铁黄的离子方程式:_______ ,此过程要使溶液的pH控制在3~4比较合适,如果溶液pH大于5,则可能产生的后果是_______ 。
(5)铁黄纯度可以通过产品的耗酸量确定。
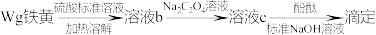
资料: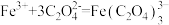 ,
,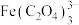 不与稀碱液反应
不与稀碱液反应
①写出铁黄溶解于硫酸溶液的化学方程式:_______ 。
②加入的 ,溶液必须过量,原因是
,溶液必须过量,原因是_______ 。
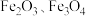 、少量
、少量 和CaO等。铁黄(FeOOH)主要用于涂料、水泥制件等。以硫铁矿烧渣为原料制备铁黄的工艺流程如下:
和CaO等。铁黄(FeOOH)主要用于涂料、水泥制件等。以硫铁矿烧渣为原料制备铁黄的工艺流程如下:
回答下列问题:
(1)“滤渣”的主要成分是
(2)操作A为
(3)晶种制备过程中溶液pH与时间的关系如图:

在反应前期(
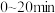 )溶液的pH随时间的延长而直线下降,是因为通入
)溶液的pH随时间的延长而直线下降,是因为通入 后,溶液中
后,溶液中 生成FeOOH晶种时发生反应
生成FeOOH晶种时发生反应 反应生成
反应生成 絮状物。
絮状物。(4)二次氧化的目的是将
 和
和 进一步转化为铁黄,写出
进一步转化为铁黄,写出 转化为铁黄的离子方程式:
转化为铁黄的离子方程式:(5)铁黄纯度可以通过产品的耗酸量确定。
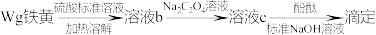
资料:
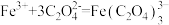 ,
,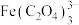 不与稀碱液反应
不与稀碱液反应①写出铁黄溶解于硫酸溶液的化学方程式:
②加入的
 ,溶液必须过量,原因是
,溶液必须过量,原因是
您最近一年使用:0次
2022-10-08更新
|
203次组卷
|
5卷引用:贵州省顶效开发区顶兴学校2023-2024学年高三第三次月考化学试题
贵州省顶效开发区顶兴学校2023-2024学年高三第三次月考化学试题河北省九师联盟2022-2023学年高三上学期10月月考化学试题(已下线)2022年河北省高考真题变式题(14-18)(已下线)T26-工业流程题甘肃省永昌县第一高级中学2023-2024学年高三上学期期中考试化学试题
解题方法
6 . 黄铜矿 是一种较常见的铜矿物,可形成于不同的环境下,产地遍布世界各地。在工业上,它是炼铜的主要原料,其流程如图。
是一种较常见的铜矿物,可形成于不同的环境下,产地遍布世界各地。在工业上,它是炼铜的主要原料,其流程如图。

根据所学知识,回答下列问题:
(1)在“浸取”前,应先对黄铜矿进行粉碎处理,其目的是___________ 。
(2)实验室利用 配制澄清的
配制澄清的 溶液的方法是
溶液的方法是___________ 。
(3)写出“浸取”时 和
和 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
(4)写出 加水“溶解”时反应的化学方程式:
加水“溶解”时反应的化学方程式:___________ 。
(5)为提高废物利用率,可向黄铜矿“浸取”后的滤液中通入(或滴加)___________ 。
(6)工业上也通过黄铜矿进行火法炼铜,其主要反应有:
步骤I: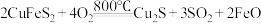 (炉渣);
(炉渣);
步骤II: ;
;
步骤III:……
步骤I的反应中每生成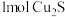 时,反应中转移的电子的物质的量为
时,反应中转移的电子的物质的量为___________ mol;
步骤I、II两步反应生成的铜产物( 、
、 )在1200℃条件下继续反应生成单质铜,请写出步骤III反应的化学方程式:
)在1200℃条件下继续反应生成单质铜,请写出步骤III反应的化学方程式:___________ 。若 生成1mol Cu,则理论上共消耗
生成1mol Cu,则理论上共消耗___________ 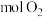 。
。
 是一种较常见的铜矿物,可形成于不同的环境下,产地遍布世界各地。在工业上,它是炼铜的主要原料,其流程如图。
是一种较常见的铜矿物,可形成于不同的环境下,产地遍布世界各地。在工业上,它是炼铜的主要原料,其流程如图。
根据所学知识,回答下列问题:
(1)在“浸取”前,应先对黄铜矿进行粉碎处理,其目的是
(2)实验室利用
 配制澄清的
配制澄清的 溶液的方法是
溶液的方法是(3)写出“浸取”时
 和
和 溶液反应的离子方程式:
溶液反应的离子方程式:(4)写出
 加水“溶解”时反应的化学方程式:
加水“溶解”时反应的化学方程式:(5)为提高废物利用率,可向黄铜矿“浸取”后的滤液中通入(或滴加)
(6)工业上也通过黄铜矿进行火法炼铜,其主要反应有:
步骤I:
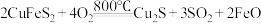 (炉渣);
(炉渣);步骤II:
 ;
;步骤III:……
步骤I的反应中每生成
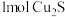 时,反应中转移的电子的物质的量为
时,反应中转移的电子的物质的量为步骤I、II两步反应生成的铜产物(
 、
、 )在1200℃条件下继续反应生成单质铜,请写出步骤III反应的化学方程式:
)在1200℃条件下继续反应生成单质铜,请写出步骤III反应的化学方程式: 生成1mol Cu,则理论上共消耗
生成1mol Cu,则理论上共消耗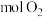 。
。
您最近一年使用:0次
7 . 碘及其化合物广泛用于医药、染料等方面。碘酸是一种强酸,其水溶液有强氧化性。已知氧化性: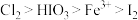 。回答下列问题:
。回答下列问题:
(1)一种以含有少量 的废液为原料制备
的废液为原料制备 的方法如图所示。
的方法如图所示。
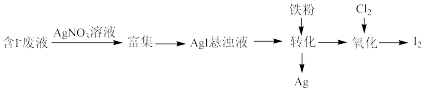
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:___________ 。
②通入 的过程中,若
的过程中,若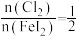 ,则反应中被氧化的元素为
,则反应中被氧化的元素为___________ (填元素符号);当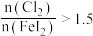 后,单质碘的产率会降低,原因是
后,单质碘的产率会降低,原因是___________ 。
(2)大量的碘由自然界的 与还原剂
与还原剂 反应制得,则该制备
反应制得,则该制备 的反应中的氧化剂和还原剂的物质的量之比为
的反应中的氧化剂和还原剂的物质的量之比为___________ 。
(3)卤素互化物 可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:
可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:___________ 。
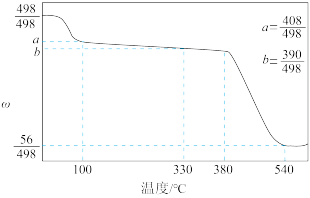
(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。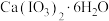 加热升温过程中剩余固体的质量分数w(
加热升温过程中剩余固体的质量分数w( )随温度变化的关系如图所示。为获得无水碘酸钙,可将
)随温度变化的关系如图所示。为获得无水碘酸钙,可将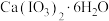 晶体
晶体___________ (填实验操作)。若将加热温度提高至540℃,则此时得到固体的主要成分为___________ (填化学式)。
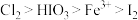 。回答下列问题:
。回答下列问题:(1)一种以含有少量
 的废液为原料制备
的废液为原料制备 的方法如图所示。
的方法如图所示。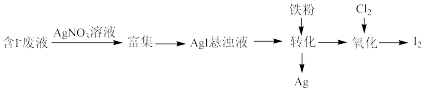
①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:
②通入
 的过程中,若
的过程中,若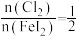 ,则反应中被氧化的元素为
,则反应中被氧化的元素为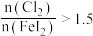 后,单质碘的产率会降低,原因是
后,单质碘的产率会降低,原因是(2)大量的碘由自然界的
 与还原剂
与还原剂 反应制得,则该制备
反应制得,则该制备 的反应中的氧化剂和还原剂的物质的量之比为
的反应中的氧化剂和还原剂的物质的量之比为(3)卤素互化物
 可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:
可发生水解反应,生成卤离子和卤氧离子(为非氧化还原反应),写出反应的离子方程式:(4)碘酸钙是食品及饲料添加剂中补碘补钙的常用试剂,微溶于水。
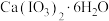 加热升温过程中剩余固体的质量分数w(
加热升温过程中剩余固体的质量分数w( )随温度变化的关系如图所示。为获得无水碘酸钙,可将
)随温度变化的关系如图所示。为获得无水碘酸钙,可将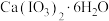 晶体
晶体
您最近一年使用:0次
2022-09-26更新
|
369次组卷
|
4卷引用:贵州省2022-2023学年高三上学期联考化学试题
8 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
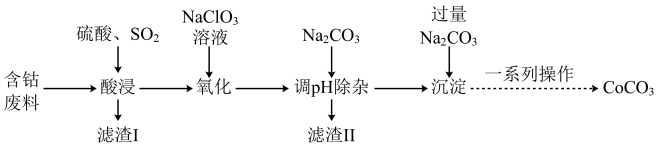
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作_______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:_______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为_______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为_______ 至_______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣Ⅱ”的主要成分为_______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
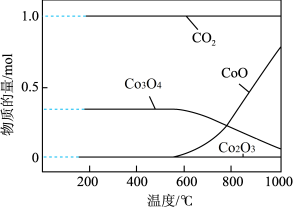
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
回答下列问题:
(1)在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣Ⅱ”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
9 . 2021年,贵阳市空气质量优良率达98.9%,这得益于贵阳市对含硫化合物等排放的有效控制。回答下列问题:
(1)燃煤的烟气中含有 ,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
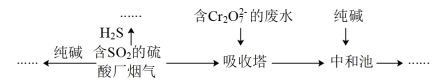
①写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
②用含 的烟气处理含
的烟气处理含 的酸性废水时,所发生的离子反应为
的酸性废水时,所发生的离子反应为___________ :
___________ +___________
+___________ +___________
+___________ =___________
=___________ +___________
+___________ +___________
+___________
配平该离子反应,并判断该处理方式利用了 的
的___________ 性。
(2)实验室提供以下试剂:浓 、稀
、稀 、酸性
、酸性 溶液、
溶液、 溶液、Cu、品红溶液。若要实现
溶液、Cu、品红溶液。若要实现 的转化,可选择的试剂是
的转化,可选择的试剂是___________ ,所发生反应的化学方程式为___________ ;设计实验,证明能实现该转化的操作和现象为___________ 。
(1)燃煤的烟气中含有
 ,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
,为了治理雾霾,工厂采用如图所示多种方法实现烟气脱硫。
①写出
 与
与 反应的化学方程式
反应的化学方程式②用含
 的烟气处理含
的烟气处理含 的酸性废水时,所发生的离子反应为
的酸性废水时,所发生的离子反应为___________
 +___________
+___________ +___________
+___________ =___________
=___________ +___________
+___________ +___________
+___________
配平该离子反应,并判断该处理方式利用了
 的
的(2)实验室提供以下试剂:浓
 、稀
、稀 、酸性
、酸性 溶液、
溶液、 溶液、Cu、品红溶液。若要实现
溶液、Cu、品红溶液。若要实现 的转化,可选择的试剂是
的转化,可选择的试剂是
您最近一年使用:0次
2022-07-14更新
|
380次组卷
|
2卷引用:贵州省贵阳市普通中学2021-2022学年高一下学期期末监测化学试题
名校
解题方法
10 . TiO2可以作为催化剂的载体,也可以用作涂料、光催化剂等其他材料。以废TiO2催化剂为原料,利用氯化法回收钛白粉(TiO2)的工艺流程如图所示:

已知:氯化过程中氯化钠不参与反应。
回答下列问题:
(1)对废TiO2催化剂进行预处理:物理清洗和破碎磨粉,其中破碎磨粉的目的是___________ 。
(2)氯化时将预处理的废催化剂与还原剂(如石油焦,主要是C)和氯化钠混合后进入氯化炉中,通入Cl2并加热到950℃进行反应,生成含有TiCl4(熔点为-25℃,沸点为135℃)的混合物,经过各物料合理的配比及条件的选择,可以得到无毒的气体,则氯化时发生反应的化学方程式为___________ 。
(3)在空气中加热“氧化”时,发生置换反应,反应的化学方程式为___________ 。
(4)氯化法工艺是干法生产,工艺优点为技术先进、流程短、能耗较低、物质循环利用、三废排放少、制得的钛白粉质量优异;但氯化炉设备结构复杂,对设备要求比较高。下列对设备要求的说法正确的是___________(填标号)。
(5)该氯化法工艺生产中经过简单处理可循环使用的物质有___________ (写化学式)。
(6)有科学工作者发现,在FeCl3存在时,可使TiO2的氯化速率有较大提升,是因为FeCl3在该过程中起着___________ 的作用,经研究发现反应过程中有FeCl2生成,最终还是以FeCl3形式存在。写出生成FeCl2的化学方程式:___________ 。

已知:氯化过程中氯化钠不参与反应。
回答下列问题:
(1)对废TiO2催化剂进行预处理:物理清洗和破碎磨粉,其中破碎磨粉的目的是
(2)氯化时将预处理的废催化剂与还原剂(如石油焦,主要是C)和氯化钠混合后进入氯化炉中,通入Cl2并加热到950℃进行反应,生成含有TiCl4(熔点为-25℃,沸点为135℃)的混合物,经过各物料合理的配比及条件的选择,可以得到无毒的气体,则氯化时发生反应的化学方程式为
(3)在空气中加热“氧化”时,发生置换反应,反应的化学方程式为
(4)氯化法工艺是干法生产,工艺优点为技术先进、流程短、能耗较低、物质循环利用、三废排放少、制得的钛白粉质量优异;但氯化炉设备结构复杂,对设备要求比较高。下列对设备要求的说法正确的是___________(填标号)。
| A.抗高温 | B.抗氧化 | C.抗腐蚀 | D.抗高压 |
(6)有科学工作者发现,在FeCl3存在时,可使TiO2的氯化速率有较大提升,是因为FeCl3在该过程中起着
您最近一年使用:0次
2022-07-04更新
|
144次组卷
|
2卷引用:贵州省黔东南苗族侗族自治州)2021-2022学年高二下学期期末联考化学试题



