1 . 新冠肺炎期间,化学消毒剂大显身手。高铁酸钾( )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的流程如下:
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的流程如下:

已知:Cl2与KOH反应,在温度过高时,会生成KClO3。
回答下列问题:
(1)写出可提高反应反应①中化学反应速率的措施:___________ 。
(2)写出反应①中化学反应方程式:___________ 。
(3)检验滤液1中阳离子的方法:___________ 。
(4)写出反应②发生反应的离子方程式:___________ 。
(5)反应②需放在冰水浴中进行的原因:___________ 。
(6)写出反应③发生反应的离子方程式:___________ 。
(7)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。其原理如下图
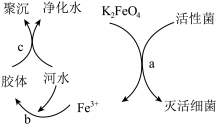
它能消毒杀菌是因为___________ ,它能净水的原因___________ 。
 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的流程如下:
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的流程如下:
已知:Cl2与KOH反应,在温度过高时,会生成KClO3。
回答下列问题:
(1)写出可提高反应反应①中化学反应速率的措施:
(2)写出反应①中化学反应方程式:
(3)检验滤液1中阳离子的方法:
(4)写出反应②发生反应的离子方程式:
(5)反应②需放在冰水浴中进行的原因:
(6)写出反应③发生反应的离子方程式:
(7)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。其原理如下图

它能消毒杀菌是因为
您最近一年使用:0次
名校
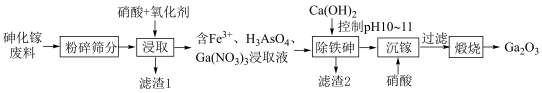
2 . 氧化镓(Ga2O3)可用作有机及无机合成的催化剂及制备高纯镓的原料。以砷化镓废料(主要成分为 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如图所示:
的工艺流程如图所示:
已知:镓(Ga)、铝(Al)是同主族相邻元素,Ga元素在溶液中存在的形式有 、
、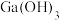 、
、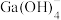 。
。
回答下列问题:
(1)滤渣1为 ,工业上以石英砂(主要成分为
,工业上以石英砂(主要成分为 )、
)、___________ (填化学式)为原料生产普通玻璃。
(2)“浸取”时,不是只用硝酸,而是还用氧化剂 或空气(提供
或空气(提供 ),其优点是不产生污染环境的
),其优点是不产生污染环境的 ,写出
,写出 、空气(O2)和稀硝酸反应的化学方程式:
、空气(O2)和稀硝酸反应的化学方程式:___________ 。
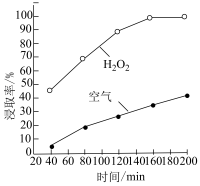
(3)硝酸用量一定时,在相同的浸取时间内,氧化剂不同时,镓浸取率随时间的变化如图所示。用空气作氧化剂的浸取率明显低于过氧化氢,其原因是___________ 。
(4)“浸取”时,温度保持在60℃,其原因是___________ 。
(5)滤渣2是___________ [写化学式,不考虑 和
和 ]。
]。
(6)写出“沉镓”时反应的离子方程式:___________ 。不同 时,镓的沉淀率如下表所示。
时,镓的沉淀率如下表所示。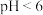 时,镓的沉淀率显著降低的原因是
时,镓的沉淀率显著降低的原因是___________ 。
 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如图所示:
的工艺流程如图所示:
已知:镓(Ga)、铝(Al)是同主族相邻元素,Ga元素在溶液中存在的形式有
 、
、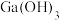 、
、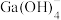 。
。回答下列问题:
(1)滤渣1为
 ,工业上以石英砂(主要成分为
,工业上以石英砂(主要成分为 )、
)、(2)“浸取”时,不是只用硝酸,而是还用氧化剂
 或空气(提供
或空气(提供 ),其优点是不产生污染环境的
),其优点是不产生污染环境的 ,写出
,写出 、空气(O2)和稀硝酸反应的化学方程式:
、空气(O2)和稀硝酸反应的化学方程式:(3)硝酸用量一定时,在相同的浸取时间内,氧化剂不同时,镓浸取率随时间的变化如图所示。用空气作氧化剂的浸取率明显低于过氧化氢,其原因是

(4)“浸取”时,温度保持在60℃,其原因是
(5)滤渣2是
 和
和 ]。
]。(6)写出“沉镓”时反应的离子方程式:
 时,镓的沉淀率如下表所示。
时,镓的沉淀率如下表所示。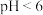 时,镓的沉淀率显著降低的原因是
时,镓的沉淀率显著降低的原因是 | 4 | 5 | 6 | 7 | 8 | 9 |
| 沉淀率% | 23.7 | 79.3 | 98.7 | 95.4 | 46.3 | 19.5 |
您最近一年使用:0次
2024-01-02更新
|
291次组卷
|
4卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
名校
解题方法
3 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量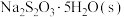 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),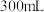 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约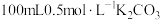 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取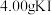 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入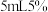 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量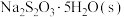 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),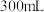 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约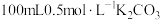 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
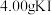 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入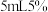 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
211次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
4 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: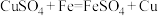 。
。
上述两种方法中,方法2比方法1更好,其原因是___________ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为___________ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为___________ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为___________  。
。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知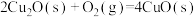
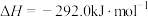 ;则
;则 的
的
___________  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验i中气体减少的原因是___________ 。
②实验i中,推测产生 ,可能发生的反应有
,可能发生的反应有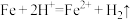 、
、___________ 。
③随着阴极析出 ,实验ii中
,实验ii中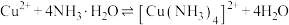 平衡
平衡___________ (填“向左”“向右”或“不”)移动,理由是___________ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
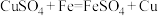 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到
溶液恰好使混合物完全溶解,同时收集到 (标准状况)
(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为 。
。(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知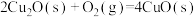
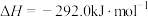 ;则
;则 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| i |  | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| ii |  | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无Fe元素 |
②实验i中,推测产生
 ,可能发生的反应有
,可能发生的反应有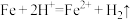 、
、③随着阴极析出
 ,实验ii中
,实验ii中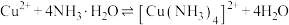 平衡
平衡
您最近一年使用:0次
2024-01-02更新
|
135次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
解题方法
5 . Mg能在 中燃烧,产物为
中燃烧,产物为 、
、 和
和 。下列有关说法正确的是
。下列有关说法正确的是
 中燃烧,产物为
中燃烧,产物为 、
、 和
和 。下列有关说法正确的是
。下列有关说法正确的是| A.该反应为氮的固定 | B. 是还原产物 是还原产物 |
| C.Mg在反应中被还原 | D.氧化性: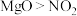 |
您最近一年使用:0次
2023-12-14更新
|
151次组卷
|
2卷引用:贵州省部分学校2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
6 . 化合物 (结构简式为
(结构简式为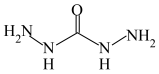 )是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为
)是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为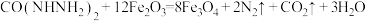 。下列说法正确的是
。下列说法正确的是
 (结构简式为
(结构简式为 )是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为
)是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为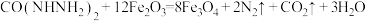 。下列说法正确的是
。下列说法正确的是| A.该反应是熵减过程 |
B. 可写成 可写成 ,属于混合物 ,属于混合物 |
| C.反应中C、N元素均被氧化 |
D.每生成 ,反应中转移 ,反应中转移 电子 电子 |
您最近一年使用:0次
2023-12-02更新
|
261次组卷
|
5卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题湖北省九师联盟2024届高三11月质检化学试题河南省部分名校2023-2024学年高三上学期11月期中化学试题江西省部分地区2023-2024学年高三上学期11月期中化学试题(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
7 . 化学与生产、生活密切相关,下列说法错误的是
| A.小苏打既是制作糕点的膨松剂,又是治疗胃酸过多的一种药剂 |
B.二氧化氯( )臭氧( )臭氧( )具有强氧化性,可以用于自来水消毒 )具有强氧化性,可以用于自来水消毒 |
| C.当火灾现场存放有大量活泼金属时,可以用水来灭火 |
D.维生素C具有还原性,能帮助人体将食物中摄取的 转化为 转化为 而吸收 而吸收 |
您最近一年使用:0次
名校
8 . 1962年,化学家NeilBartlett用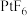 与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙(
与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙( ),实验证明
),实验证明 是一种含有
是一种含有 的离子化合物,常温下很稳定,遇水强烈水解生成
的离子化合物,常温下很稳定,遇水强烈水解生成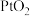 、HF、Xe、
、HF、Xe、 。下列叙述正确的是
。下列叙述正确的是
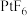 与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙(
与Xe首次合成了Xe的第一种化合物——六氟合铂酸氙( ),实验证明
),实验证明 是一种含有
是一种含有 的离子化合物,常温下很稳定,遇水强烈水解生成
的离子化合物,常温下很稳定,遇水强烈水解生成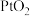 、HF、Xe、
、HF、Xe、 。下列叙述正确的是
。下列叙述正确的是A.在合成 的反应中Xe作氧化剂 的反应中Xe作氧化剂 | B. 水解过程中被还原的元素为Pt和Xe 水解过程中被还原的元素为Pt和Xe |
| C.通常情况下,Xe具有较强的还原性 | D.1 mol  完全水解,转移4 mol电子 完全水解,转移4 mol电子 |
您最近一年使用:0次
2023-10-17更新
|
258次组卷
|
6卷引用:贵州省部分中学2023-2024学年高三上学期第四次月考化学试题
9 . 高铁酸钾(K2FeO4)是一种新型多功能水处理剂,其生产利用了离子反应和氧化还原反应原理,具体生产流程如下:
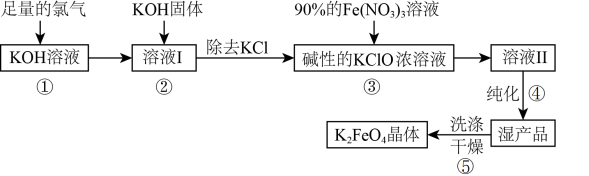
(1)高铁酸钾(K2FeO4)中铁元素的化合价是_______ ,由此推测高铁酸钾具有强_______ 性(填“氧化”或“还原”)。
(2)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,该红褐色胶体的化学式为_______ ,氧化性气体单质的化学式为_______ 。
(3)在溶液Ⅰ中加入KOH固体的目的是_______ (填编号)。
a.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
b.为下一步反应提供碱性的环境
c.与KClO3反应生成KClO
(4)最后产品除得到K2FeO4晶体外,还得到KNO3和KCl两种副产物,请写出第③步的反应离子方程式为:_______ 。

(1)高铁酸钾(K2FeO4)中铁元素的化合价是
(2)高铁酸钾(K2FeO4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,该红褐色胶体的化学式为
(3)在溶液Ⅰ中加入KOH固体的目的是
a.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
b.为下一步反应提供碱性的环境
c.与KClO3反应生成KClO
(4)最后产品除得到K2FeO4晶体外,还得到KNO3和KCl两种副产物,请写出第③步的反应离子方程式为:
您最近一年使用:0次
解题方法
10 . 不同价态的铜化合物用途广泛,性质多变,如 在很多有机反应中常被用作催化剂,该物质为白色固体,具有易被氧化,微溶于水,不溶于乙醇等性质,可用如图所示的装置制备。
在很多有机反应中常被用作催化剂,该物质为白色固体,具有易被氧化,微溶于水,不溶于乙醇等性质,可用如图所示的装置制备。
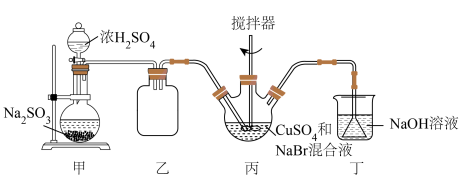
回答下列问题:
(1)制备 的反应在装置乙中进行,向其中加入一定量
的反应在装置乙中进行,向其中加入一定量 和过量
和过量 配制成的
配制成的 溶液,然后通入足量的
溶液,然后通入足量的 (部分夹持及加热装置已略去)。
(部分夹持及加热装置已略去)。
①装置乙用到的容器名称为_____ 。
②请指出上图所示的实验装置中的明显错误:_____ 。
③该反应需保持反应液温度为 ,写出装置乙中发生反应的离子方程式:
,写出装置乙中发生反应的离子方程式:_____ ,能说明装置乙中反应已经完全的实验现象是_____ 。
(2)装置乙中反应完成后,过滤出溴化亚铜沉淀进行洗涤,先用亚硫酸溶液而不直接用蒸馏水洗涤的原因是_____ ,再用乙醇洗涤的目的是_____ (任答两点)。
(3)某研究性学习小组探究不同价态铜的稳定性,进行如下实验:
①向 中加适量稀硫酸,得到蓝色溶液和一种红色固体,由此可知,在酸性溶液中,更稳定的是
中加适量稀硫酸,得到蓝色溶液和一种红色固体,由此可知,在酸性溶液中,更稳定的是_____ 价铜(填“ ”或“
”或“ ”)。
”)。
②将 粉末加热至
粉末加热至 以上完全分解成
以上完全分解成 粉末,该反应的化学方程式为
粉末,该反应的化学方程式为_____ ,该反应说明:在高温条件下,更稳定的是_____ 价铜(填“ ”或“
”或“ ”)。
”)。
 在很多有机反应中常被用作催化剂,该物质为白色固体,具有易被氧化,微溶于水,不溶于乙醇等性质,可用如图所示的装置制备。
在很多有机反应中常被用作催化剂,该物质为白色固体,具有易被氧化,微溶于水,不溶于乙醇等性质,可用如图所示的装置制备。
回答下列问题:
(1)制备
 的反应在装置乙中进行,向其中加入一定量
的反应在装置乙中进行,向其中加入一定量 和过量
和过量 配制成的
配制成的 溶液,然后通入足量的
溶液,然后通入足量的 (部分夹持及加热装置已略去)。
(部分夹持及加热装置已略去)。①装置乙用到的容器名称为
②请指出上图所示的实验装置中的明显错误:
③该反应需保持反应液温度为
 ,写出装置乙中发生反应的离子方程式:
,写出装置乙中发生反应的离子方程式:(2)装置乙中反应完成后,过滤出溴化亚铜沉淀进行洗涤,先用亚硫酸溶液而不直接用蒸馏水洗涤的原因是
(3)某研究性学习小组探究不同价态铜的稳定性,进行如下实验:
①向
 中加适量稀硫酸,得到蓝色溶液和一种红色固体,由此可知,在酸性溶液中,更稳定的是
中加适量稀硫酸,得到蓝色溶液和一种红色固体,由此可知,在酸性溶液中,更稳定的是 ”或“
”或“ ”)。
”)。②将
 粉末加热至
粉末加热至 以上完全分解成
以上完全分解成 粉末,该反应的化学方程式为
粉末,该反应的化学方程式为 ”或“
”或“ ”)。
”)。
您最近一年使用:0次



