名校
解题方法
1 . 以废旧锌锰干电池的炭包(含炭粉、 、
、 和少量
和少量 、
、 等物质)为原料,从中回收
等物质)为原料,从中回收 的工艺流程如下:
的工艺流程如下:
(1)“酸浸”时需将结块的炭包粉碎,目的是_______ 。
(2)“酸浸”过程中, 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为_______ ,该反应中氧化剂和还原剂的物质的量之比为_______ 。
(3)“溶解”时加入 的作用是
的作用是_______ , 的实际消耗量比理论值高的原因
的实际消耗量比理论值高的原因_______ 。
(4)写出“焙烧”过程的化学反应方程式为_______ 。
(5)碱性锌锰干电池是一种使用广泛的便携式电源,结构如图所示。其电池总反应为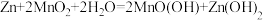 。
。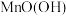 中
中 的化合价为
的化合价为_______ 。
②该电池工作时,负极的反应式为_______ 。
 、
、 和少量
和少量 、
、 等物质)为原料,从中回收
等物质)为原料,从中回收 的工艺流程如下:
的工艺流程如下: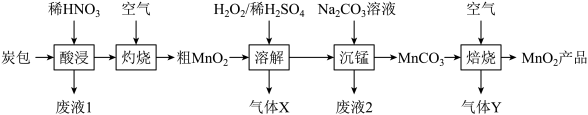
(1)“酸浸”时需将结块的炭包粉碎,目的是
(2)“酸浸”过程中,
 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为(3)“溶解”时加入
 的作用是
的作用是 的实际消耗量比理论值高的原因
的实际消耗量比理论值高的原因(4)写出“焙烧”过程的化学反应方程式为
(5)碱性锌锰干电池是一种使用广泛的便携式电源,结构如图所示。其电池总反应为
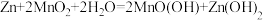 。
。
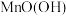 中
中 的化合价为
的化合价为②该电池工作时,负极的反应式为
您最近一年使用:0次
名校
2 . 已知:① ,②
,②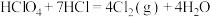 。
。 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 ,②
,②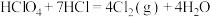 。
。 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.反应①中物质的氧化性: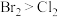 |
B.标准状况下,11.2L 参与反应时转移的电子数为5NA 参与反应时转移的电子数为5NA |
C.1L0.5  溶液含有的 溶液含有的 分子数为0.5 分子数为0.5 |
D.反应②生成28.4g 时,还原产物分子数为0.05 时,还原产物分子数为0.05 |
您最近一年使用:0次
2024-04-16更新
|
706次组卷
|
5卷引用:贵州省安顺市部分学校2024届高三下学期二模考试化学试题
贵州省安顺市部分学校2024届高三下学期二模考试化学试题辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)选择题1-5
解题方法
3 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①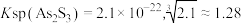 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有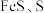 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ; 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当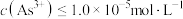 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: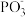
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
 时:①
时:①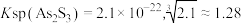 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
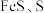 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当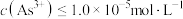 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: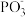
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
2024-04-15更新
|
252次组卷
|
3卷引用:2024届贵州省高三下学期二模化学试题
4 . 工业上可用反应 制备
制备 粗品,进而制取高纯硅。下列说法正确的是
粗品,进而制取高纯硅。下列说法正确的是 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 制备
制备 粗品,进而制取高纯硅。下列说法正确的是
粗品,进而制取高纯硅。下列说法正确的是 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)| A.晶体硅属于分子晶体 |
B.用原子轨道描述氢原子形成氢分子的过程示意图: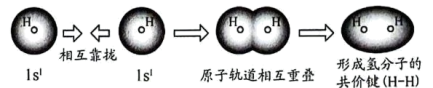 |
C.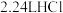 中含有分子的数目为 中含有分子的数目为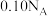 |
D.每生成 转移电子数目为 转移电子数目为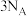 |
您最近一年使用:0次
2024-04-15更新
|
142次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
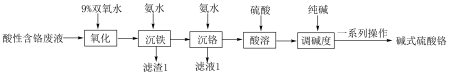
5 . 碱式硫酸铬[ ]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有
]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有 、
、 ,还含有少量
,还含有少量 、
、 、
、 )为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
)为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于或等于 )时的pH如下表。
)时的pH如下表。
(1)Cr在元素周期表中的位置为_______ 。
(2)加入9%双氧水的作用是_______ (用离子方程式表示)。
(3)“沉铁”时调pH的范围为_______ ~_______ 。
(4)“沉铬”过程发生反应的离子方程式是_______ ,从滤液1中可回收一种氮肥,该物质是_______ (填化学式)。
(5)金属铬的晶胞结构如图,已知晶胞参数为anm。
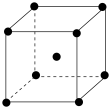
①该晶胞中含铬原子的个数为_______ 。
②铬原子的配位数为_______ 。
③铬原子之间的最短距离为_______ nm(用含a的代数式表示)。
 ]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有
]主要用于鞣制皮革、作媒染剂及生产氢氧化铬和活性黑染料。以酸性含铬废液(主要含有 、
、 ,还含有少量
,还含有少量 、
、 、
、 )为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
)为原料制备碱式硫酸铬的工艺流程如图所示,回答下列问题:
已知:常温下,部分金属阳离子开始沉淀和完全沉淀(离子浓度小于或等于
 )时的pH如下表。
)时的pH如下表。| 离子 |  |  |  |
| 开始沉淀的pH | 7.6 | 1.9 | 4.4 |
| 完全沉淀的pH | 9.6 | 3.1 | 5.6 |
(1)Cr在元素周期表中的位置为
(2)加入9%双氧水的作用是
(3)“沉铁”时调pH的范围为
(4)“沉铬”过程发生反应的离子方程式是
(5)金属铬的晶胞结构如图,已知晶胞参数为anm。

①该晶胞中含铬原子的个数为
②铬原子的配位数为
③铬原子之间的最短距离为
您最近一年使用:0次
名校
解题方法
6 . 由煤矸石(主要成分为 及铁铝的氧化物,还含有少量
及铁铝的氧化物,还含有少量 )制备铁红的工艺流程如图,下列说法错误的是
)制备铁红的工艺流程如图,下列说法错误的是
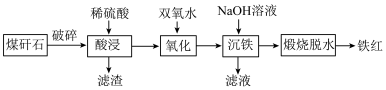
 及铁铝的氧化物,还含有少量
及铁铝的氧化物,还含有少量 )制备铁红的工艺流程如图,下列说法错误的是
)制备铁红的工艺流程如图,下列说法错误的是
| A.使用硝酸酸浸会产生污染环境的气体 |
B.氧化过程的反应为 |
C. 溶液中存在的化学键有离子键、共价键、氢键 溶液中存在的化学键有离子键、共价键、氢键 |
| D.煅烧氢氧化铁前,需洗去表面吸附的杂质 |
您最近一年使用:0次
2024-04-01更新
|
371次组卷
|
2卷引用:贵州省安顺市部分学校2024届高三下学期二模考试化学试题
名校
解题方法
7 . 零价铝是一种应用于环境修复的极有潜力的两性金属材料。构建微观腐蚀原电池体系(如图),实现了零价铝在近中性溶液中处理硝酸盐。下列叙述正确的是
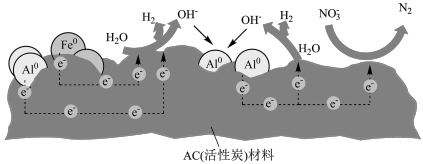
A. 在 在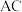 电极上发生氧化反应 电极上发生氧化反应 |
B.生成 的电极反应式: 的电极反应式: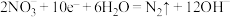 |
C.若 表面生成了致密的 表面生成了致密的 ,能提高去除率 ,能提高去除率 |
D.生成等物质的量的 和 和 ,转移的电子数之比为1∶5 ,转移的电子数之比为1∶5 |
您最近一年使用:0次
2024-03-30更新
|
615次组卷
|
5卷引用:贵州省安顺市部分学校2024届高三下学期二模考试化学试题
贵州省安顺市部分学校2024届高三下学期二模考试化学试题辽宁省锦州市渤海大学附属高级中学2023-2024学年高三下学期3月摸底考试化学试题河北省邢台市五岳联盟2024届高三下学期模拟预测化学试题(已下线)通关练01 化学基本概念再回归-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省部分省示范高中2023-2024学年高三下学期3月联考理科综合试卷-高中化学
8 . 根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向盛有银氨溶液的试管中,加入几滴乙醛,振荡后将试管放在热水浴中温热,产生银镜 | 乙醛具有还原性 |
B | 室温下,用pH计测量0.1 | 室温下,HClO的电离常数约为 |
C | 向 | 氧化性: |
D | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体 | 原溶液中有大量的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 高铁酸钾 具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及
具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及 为原料制备高铁酸钾和
为原料制备高铁酸钾和 的流程如图所示。
的流程如图所示。
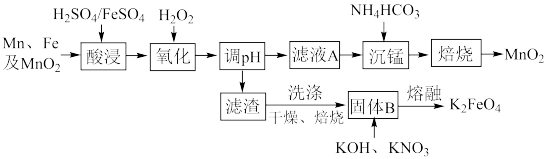
回答下列问题:
(1) 中Fe的化合价为
中Fe的化合价为___________ 。
(2)高铁酸钾溶液中存在反应: ,已知该反应的
,已知该反应的 ,则该反应在
,则该反应在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
(3)用惰性电极电解 酸性溶液可制得
酸性溶液可制得 ,写出电解法制备
,写出电解法制备 时的阳极反应式:
时的阳极反应式:___________ 。
(4)已知固体B制取 的过程中会生成两种盐,写出该反应的化学方程式:
的过程中会生成两种盐,写出该反应的化学方程式:___________ 。
(5) 可作为新型多功能水处理剂的原因:
可作为新型多功能水处理剂的原因:___________ 。
(6) 的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
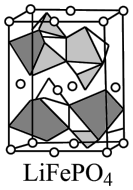
①下列状态锂中,失去一个电子所需能量最大的是___________ (填序号)。
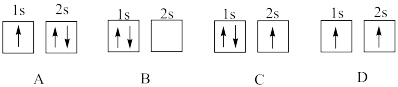
②该晶胞呈长方体,晶胞边长分别为apm、bpm、cpm,阿伏加德罗常数的值为 ,该晶体的密度可表示为
,该晶体的密度可表示为___________  。
。
 具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及
具有强氧化性,是一种新型、绿色、高效的多功能饮用水处理剂,一种以Mn、Fe及 为原料制备高铁酸钾和
为原料制备高铁酸钾和 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)
 中Fe的化合价为
中Fe的化合价为(2)高铁酸钾溶液中存在反应:
 ,已知该反应的
,已知该反应的 ,则该反应在
,则该反应在(3)用惰性电极电解
 酸性溶液可制得
酸性溶液可制得 ,写出电解法制备
,写出电解法制备 时的阳极反应式:
时的阳极反应式:(4)已知固体B制取
 的过程中会生成两种盐,写出该反应的化学方程式:
的过程中会生成两种盐,写出该反应的化学方程式:(5)
 可作为新型多功能水处理剂的原因:
可作为新型多功能水处理剂的原因:(6)
 的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
的晶胞结构示意图如图所示。其中O围绕Fe和P分别形成正八面体和正四面体空隙,它们通过共顶点、共棱形成空间链状结构。
①下列状态锂中,失去一个电子所需能量最大的是
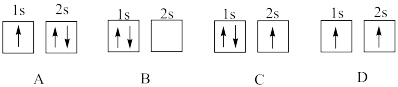
②该晶胞呈长方体,晶胞边长分别为apm、bpm、cpm,阿伏加德罗常数的值为
 ,该晶体的密度可表示为
,该晶体的密度可表示为 。
。
您最近一年使用:0次
名校
解题方法
10 . 镍电池是最早应用于手机、超科等设备的电池种类,它具有良好的大电流放电特性耐过充放电能力强、维护简单。某废旧镍镉电池的回收再生工艺流程如图所示:

部分物质的溶度积常数如下表所示:
回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)已知镍镉电池的工作原理为 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为___________ 。
(3)“沉隔”操作选用的沉淀剂为 ,而不选用
,而不选用 的原因为
的原因为___________ 。
(4)“沉镍”过程中为确保滤液中 不超过
不超过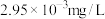 ,需要调节液的
,需要调节液的
___________ 。
(5)“转化I”发生反应的离子方程式为___________ 。
(6)“转化Ⅱ”发生反应的化学方程式为___________ 。
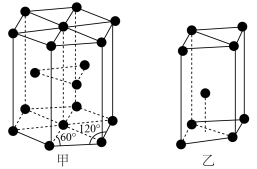
(7)金属镉晶体中原子的堆积方式为六方最密堆积,如图甲所示,晶胞可用图乙表示,则该晶胞中含有的原子个数为___________ ,已知该晶胞的底边长为 ,高为
,高为 ,则该晶体的密度为
,则该晶体的密度为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。

部分物质的溶度积常数如下表所示:
| 物质 |  |  |  |  |
 | 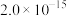 | 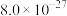 | 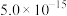 | 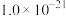 |
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)已知镍镉电池的工作原理为
 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为(3)“沉隔”操作选用的沉淀剂为
 ,而不选用
,而不选用 的原因为
的原因为(4)“沉镍”过程中为确保滤液中
 不超过
不超过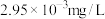 ,需要调节液的
,需要调节液的
(5)“转化I”发生反应的离子方程式为
(6)“转化Ⅱ”发生反应的化学方程式为
(7)金属镉晶体中原子的堆积方式为六方最密堆积,如图甲所示,晶胞可用图乙表示,则该晶胞中含有的原子个数为
 ,高为
,高为 ,则该晶体的密度为
,则该晶体的密度为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
您最近一年使用:0次


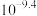
 、KBr的混合溶液中滴入少量氯水,充分反应后再加入一定量的
、KBr的混合溶液中滴入少量氯水,充分反应后再加入一定量的 ,振荡、静置分层;下层溶液呈无色;再向上层溶液中滴加KSCN溶液,溶液变为血红色
,振荡、静置分层;下层溶液呈无色;再向上层溶液中滴加KSCN溶液,溶液变为血红色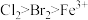
 存在
存在

