1 . 钠离子电池有望代替锂离子电池,其正极材料可再生利用。某钠离子电池正极材料有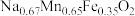 、石墨烯和少量镁等。充电时,钠离子从正极脱嵌经盐离子导体向负极移动。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
、石墨烯和少量镁等。充电时,钠离子从正极脱嵌经盐离子导体向负极移动。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
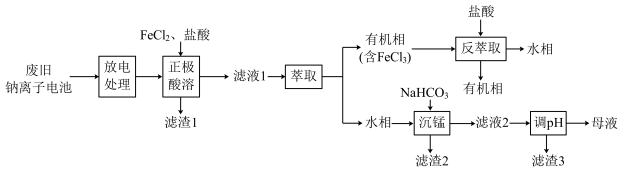
已知:溶液中离子浓度小于等于 时,认为该离子沉淀完全;部分物质的溶度积常数如表所示。
时,认为该离子沉淀完全;部分物质的溶度积常数如表所示。
回答下列问题:
(1)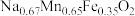 中
中 为+4价,则其中Fe(Ⅱ)与Fe(Ⅲ)的数目之比为
为+4价,则其中Fe(Ⅱ)与Fe(Ⅲ)的数目之比为___________ (其中的Ⅱ、Ⅲ表示化合价的数值)
(2)“放电处理”的主要目的为___________ ;“正极酸溶”反应的离子方程式为___________ 。
(3)“萃取”时,几种萃取剂对铁的萃取率与盐酸浓度的关系如图所示。则适合选用的萃取剂为___________ (填字母),理由为___________ 。

(4)由“反萃取”所得水相制备 的操作为
的操作为___________ 。
(5)“沉锰”时,若 沉淀完全而
沉淀完全而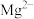 不形成沉淀,则“萃取”所得水相中
不形成沉淀,则“萃取”所得水相中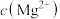 不超过
不超过___________ (保留2位有效数字);该工序不采用调 的方法的原因为
的方法的原因为___________ 。
(6)母液中提取所得晶体的部分立方结构如图所示。
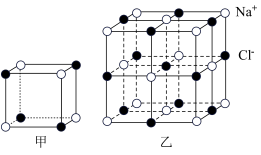
①图甲所示单元结构不是 的晶胞单元的理由为
的晶胞单元的理由为___________ 。
② 晶体中,由最近
晶体中,由最近 围成的正八面体与最近
围成的正八面体与最近 围成的正四面体的数目之比为
围成的正四面体的数目之比为___________ 。
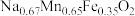 、石墨烯和少量镁等。充电时,钠离子从正极脱嵌经盐离子导体向负极移动。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
、石墨烯和少量镁等。充电时,钠离子从正极脱嵌经盐离子导体向负极移动。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
已知:溶液中离子浓度小于等于
 时,认为该离子沉淀完全;部分物质的溶度积常数如表所示。
时,认为该离子沉淀完全;部分物质的溶度积常数如表所示。| 物质 |  | 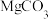 |  |  |
溶度积常数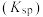 | 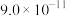 |  | 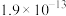 | 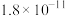 |
(1)
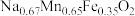 中
中 为+4价,则其中Fe(Ⅱ)与Fe(Ⅲ)的数目之比为
为+4价,则其中Fe(Ⅱ)与Fe(Ⅲ)的数目之比为(2)“放电处理”的主要目的为
(3)“萃取”时,几种萃取剂对铁的萃取率与盐酸浓度的关系如图所示。则适合选用的萃取剂为

(4)由“反萃取”所得水相制备
 的操作为
的操作为(5)“沉锰”时,若
 沉淀完全而
沉淀完全而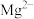 不形成沉淀,则“萃取”所得水相中
不形成沉淀,则“萃取”所得水相中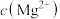 不超过
不超过 的方法的原因为
的方法的原因为(6)母液中提取所得晶体的部分立方结构如图所示。

①图甲所示单元结构不是
 的晶胞单元的理由为
的晶胞单元的理由为②
 晶体中,由最近
晶体中,由最近 围成的正八面体与最近
围成的正八面体与最近 围成的正四面体的数目之比为
围成的正四面体的数目之比为
您最近一年使用:0次
解题方法
2 . 回答下列问题
(1)以下物质:① 晶体;②
晶体;② 固体;③
固体;③ 溶液;④熔融
溶液;④熔融 ;⑤蔗糖;⑥液氯;⑦
;⑤蔗糖;⑥液氯;⑦ 。能导电的是
。能导电的是___________ (填序号,下同);属于电解质的是___________ 。
(2) 溶液与
溶液与 溶液混合产生
溶液混合产生 白色沉淀。生成
白色沉淀。生成 的反应过程:
的反应过程: 、
、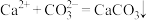 。某同学设计了如下实验方案,验证上述反应过程,请将方案补充完整:
。某同学设计了如下实验方案,验证上述反应过程,请将方案补充完整:
(3)在两份相同体积相同浓度的 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如图所示:
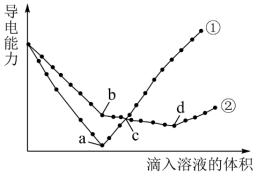
其中曲线②的b点之前发生反应的离子方程式为___________ ,该反应与曲线①a点之前发生的离子反应是否相同___________ (填“相同”或“不同”);曲线②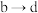 反应的离子方程式为
反应的离子方程式为___________ 。
(4)氧化还原反应是一类重要化学反应。已知反应: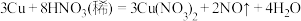 ,当有
,当有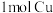 发生反应时,转移电子的个数为
发生反应时,转移电子的个数为___________  ;当有
;当有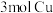 发生反应时被还原的
发生反应时被还原的 的物质的量为
的物质的量为___________ 。
(1)以下物质:①
 晶体;②
晶体;② 固体;③
固体;③ 溶液;④熔融
溶液;④熔融 ;⑤蔗糖;⑥液氯;⑦
;⑤蔗糖;⑥液氯;⑦ 。能导电的是
。能导电的是(2)
 溶液与
溶液与 溶液混合产生
溶液混合产生 白色沉淀。生成
白色沉淀。生成 的反应过程:
的反应过程: 、
、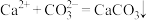 。某同学设计了如下实验方案,验证上述反应过程,请将方案补充完整:
。某同学设计了如下实验方案,验证上述反应过程,请将方案补充完整:| 实验步骤 | 无明显现象 |
i.取少量 溶液,向其中加入适量 溶液,向其中加入适量 溶液 溶液 | 无明显现象 |
| ⅱ.向上述溶液中滴加 |
 溶液中,分别逐滴滴入物质的量浓度相等的
溶液中,分别逐滴滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示:
溶液,其导电能力随滴入溶液体积变化的曲线如图所示:
其中曲线②的b点之前发生反应的离子方程式为
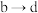 反应的离子方程式为
反应的离子方程式为(4)氧化还原反应是一类重要化学反应。已知反应:
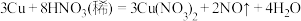 ,当有
,当有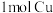 发生反应时,转移电子的个数为
发生反应时,转移电子的个数为 ;当有
;当有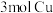 发生反应时被还原的
发生反应时被还原的 的物质的量为
的物质的量为
您最近一年使用:0次
3 . 下列有关说法错误的是
A. 在空气中加热可迅速生成 在空气中加热可迅速生成 | B. 、 、 等被用作新的自来水消毒剂 等被用作新的自来水消毒剂 |
| C.氢气在氯气中燃烧发出苍白色火焰 | D.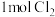 参加反应,不一定转移 参加反应,不一定转移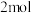 电子 电子 |
您最近一年使用:0次
名校
4 . 高效率和高选择性将CO2转化为CH4是CO2资源化利用的途径之一,我国科研工作者开发了一种空腔串联反应器,为电催化还原CO2提供了一种可行的转化方案,其原理如图所示。
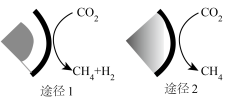
| A.22gCO2中所含共用电子对数目为4NA |
| B.1molCH4中所含质子数和中子数均为10NA |
| C.途径2生成标准状况下22.4LCH4,反应转移电子数为8NA |
| D.途径1所得产物物质的量之比为l:1,形成共价键数目为6NA |
您最近一年使用:0次
2023-03-19更新
|
1287次组卷
|
9卷引用:贵州省毕节市2023届高三诊断性考试(一模)理科综合化学试题
贵州省毕节市2023届高三诊断性考试(一模)理科综合化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题1-5)(已下线)专题03 阿伏伽德罗常数的应用福建省莆田第一中学2022-2023学年高二下学期第二学段(期中)考试化学试题辽宁省大连市育明高级中学2023届高三下学期第1次模拟考试化学试题广东省茂名市第一中学2022-2023学年高三下学期5月月考化学试题四川省成都市树德中学2022-2023学年高二下学期5月月考化学试题广东省潮州市2022-2023学年高二下学期期末考试化学试题湖南省岳阳市汨罗市第一中学2023-2024学年高二下学期5月月考化学试题
解题方法
5 . 高铁酸钠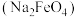 是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备
是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备 溶液,再用制得的
溶液,再用制得的 溶液在碱性条件下与
溶液在碱性条件下与 溶液反应制备
溶液反应制备 ,原理
,原理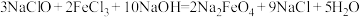 。
。
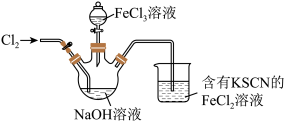
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ ,其杀菌作用是基于它具有_______ 性。
(2)用双线桥法标出反应 的电子转移方向及数目
的电子转移方向及数目_______ ,根据该制备原理可知氧化性
_______  (填“>”或“<”)。
(填“>”或“<”)。
(3)当烧杯中出现_______ 现象时,说明通入的氯气已经过量。
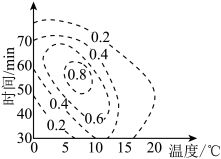
(4) 的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示
的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示 的理论产率),则制备
的理论产率),则制备 的最适宜的条件范围是
的最适宜的条件范围是_______ 。
(5)制备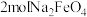 ,至少需要标准状况下的氯气
,至少需要标准状况下的氯气_______ L。
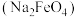 是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备
是一种绿色杀菌消毒剂,可用于饮用水处理。某实验小组用如图装置(夹持仪器略)制备 溶液,再用制得的
溶液,再用制得的 溶液在碱性条件下与
溶液在碱性条件下与 溶液反应制备
溶液反应制备 ,原理
,原理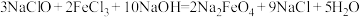 。
。
回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)用双线桥法标出反应
 的电子转移方向及数目
的电子转移方向及数目
 (填“>”或“<”)。
(填“>”或“<”)。(3)当烧杯中出现
(4)
 的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示
的理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示 的理论产率),则制备
的理论产率),则制备 的最适宜的条件范围是
的最适宜的条件范围是
(5)制备
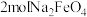 ,至少需要标准状况下的氯气
,至少需要标准状况下的氯气
您最近一年使用:0次
解题方法
6 . 化学与生活紧密相关,下列与化学知识有关的描述正确的是
| A.小苏打可用作食品膨松剂,利用其水溶液呈碱性 |
B. 可用于饮用水消毒,利用了其强氧化性 可用于饮用水消毒,利用了其强氧化性 |
C. 用于制作光导纤维,利用了其半导体的特性 用于制作光导纤维,利用了其半导体的特性 |
| D.镁铝合金用于制作航天器外壳,利用了其强还原性 |
您最近一年使用:0次
名校
7 . 向仅含有 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。

提示:①不考虑 、
、 与水的反应;
与水的反应;
②不考虑气体的逸出;
③不考虑水电离出的 和
和 。
。
④产物只有 、
、 和
和 。
。
回答下列问题:
(1)
_______ ,曲线I对应的离子方程式为_______ 。
(2)b点溶液中,共含有_______ 种离子,分别为_______ (填离子符号)。
(3)
_______ ,曲线II对应的离子方程式为_______ 。
(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为_______ 。
 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
提示:①不考虑
 、
、 与水的反应;
与水的反应;②不考虑气体的逸出;
③不考虑水电离出的
 和
和 。
。④产物只有
 、
、 和
和 。
。回答下列问题:
(1)

(2)b点溶液中,共含有
(3)
(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为
您最近一年使用:0次
2023-02-08更新
|
521次组卷
|
4卷引用:贵州省黔东南州2023-2024学年高一上学期期末考试化学试题
8 . 白色固体A是由四种元素组成的化合物,为探究其组成和性质,进行了如下实验:
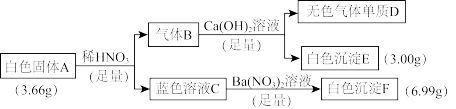
已知:在标准状况下,气体单质D的密度为1.25 g·L-1;蓝色溶液C仅含一种溶质。
请回答:
(1)组成A的四种元素是_________ (填元素符号),A的化学式是_________ 。
(2)写出过量的气体B通入Ca(OH)2溶液的离子方程式:_________ 。
(3)向溶液C中通入过量氨气后颜色变深,简述其原因:_________ 。
(4)固体A与稀硝酸反应的化学方程式是_________ 。
(5)收集将固体A在空气中加强热分解产生的混合气体,请设计实验验证混合气体中除单质D以外的其他成分:_________ 。
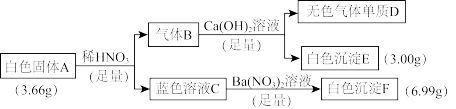
已知:在标准状况下,气体单质D的密度为1.25 g·L-1;蓝色溶液C仅含一种溶质。
请回答:
(1)组成A的四种元素是
(2)写出过量的气体B通入Ca(OH)2溶液的离子方程式:
(3)向溶液C中通入过量氨气后颜色变深,简述其原因:
(4)固体A与稀硝酸反应的化学方程式是
(5)收集将固体A在空气中加强热分解产生的混合气体,请设计实验验证混合气体中除单质D以外的其他成分:
您最近一年使用:0次
名校
9 . 如图横坐标、纵坐标分别表示一定条件下氧化剂的氧化性、还原剂的还原性由弱到强的变化,1、2、3点表示了横纵坐标对应微粒在水溶液中反应的产物。下列说法正确的是


| A.反应1中SO2的O失电子表现还原性 |
| B.反应2的离子方程式为:Fe3++2I-=Fe2++I2 |
| C.反应3的产物a是ClO- |
| D.从图可推得Cl2能氧化I-、SO2 |
您最近一年使用:0次
2022-11-28更新
|
267次组卷
|
3卷引用:贵州省遵义市南白中学2022-2023学年高一下学期第一次联考化学试题
名校
解题方法
10 . 氯气是一种重要的化工原料,大量用于制造盐酸、有机溶剂、农药、染料和药品等。
(1)氯离子结构示意图是___________ 。
(2)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为 混合加热,发现了氯气。右图为实验室制取
混合加热,发现了氯气。右图为实验室制取 的装置,请回答:
的装置,请回答:
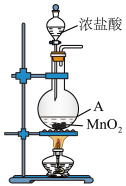
盛放浓盐酸的仪器名称是___________ ,A中反应的化学方程式为___________ ,其中,被氧化的 与参加反应的
与参加反应的 两者的物质的量之比为
两者的物质的量之比为___________ 。
(3)制取氯气时,实验室通常选用浓硫酸、饱和食盐水净化 。饱和食盐水的作用是
。饱和食盐水的作用是___________ ;浓硫酸的作用是___________ 。
(4)下列制取氯气的净化、收集、尾气处理的装置不能达到实验目的的是___________ 。
A净化
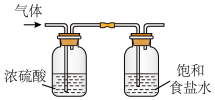 B.收集
B.收集
 C.尾气处理
C.尾气处理
(5)1867年,英国化学家Deacon用空气中的 在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将
在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将 氧化制备得到
氧化制备得到 ,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式
,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式___________ ,并用双线桥标明电子转移的方向和数目___________ 。
(6)已知:常温下用 和市售浓盐酸
和市售浓盐酸 反应制取
反应制取 难以进行,理论上盐酸的浓度需达到
难以进行,理论上盐酸的浓度需达到 。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取
。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取 。
。
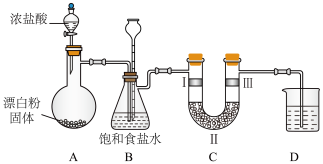
①已知,上图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式:___________ 。
②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是___________ (填“干燥的有色布条”或“湿润的有色布条”)。装置C的Ⅱ处的试剂是___________ (填序号)。
a、碱石灰(氢氧化钠和氧化钙的混合物) b、无水氯化钙 c、浓硫酸
③装置D中若用澄清石灰水吸收多余的氯气,是否可行?___________ (填“可行”或“不可行”)。理由是___________ 。
④以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为___________ 。写出电解饱和食盐水的化学方程式,并用单线桥标明电子转移的方向和数目:___________ 。
⑤若电解饱和食盐水时有 被电解,理论上最多可生成氯气多少升(标准状况)
被电解,理论上最多可生成氯气多少升(标准状况)___________ ?(写出根据化学方程式计算的过程)
(1)氯离子结构示意图是
(2)1774年,瑞典化学家舍勒将浓盐酸与软锰矿(主要成分为
 混合加热,发现了氯气。右图为实验室制取
混合加热,发现了氯气。右图为实验室制取 的装置,请回答:
的装置,请回答:
盛放浓盐酸的仪器名称是
 与参加反应的
与参加反应的 两者的物质的量之比为
两者的物质的量之比为(3)制取氯气时,实验室通常选用浓硫酸、饱和食盐水净化
 。饱和食盐水的作用是
。饱和食盐水的作用是(4)下列制取氯气的净化、收集、尾气处理的装置不能达到实验目的的是
A净化

 B.收集
B.收集
 C.尾气处理
C.尾气处理
(5)1867年,英国化学家Deacon用空气中的
 在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将
在锰盐或铜盐(氯化铜)催化和430~475℃条件下,将 氧化制备得到
氧化制备得到 ,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式
,这种催化氧化法制取氯气的方法称为Deacon法。写出其化学方程式(6)已知:常温下用
 和市售浓盐酸
和市售浓盐酸 反应制取
反应制取 难以进行,理论上盐酸的浓度需达到
难以进行,理论上盐酸的浓度需达到 。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取
。但若用漂白粉、高锰酸钾等与浓盐酸反应,常温下很容易制取 。
。
①已知,上图装置A是氯气的发生装置。加入适量的浓盐酸充分反应有黄绿色气体生成,写出发生反应的化学方程式:
②装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅲ处应放入的是
a、碱石灰(氢氧化钠和氧化钙的混合物) b、无水氯化钙 c、浓硫酸
③装置D中若用澄清石灰水吸收多余的氯气,是否可行?
④以电解饱和食盐水为基础制取氯气、烧碱等产品的工业称为
⑤若电解饱和食盐水时有
 被电解,理论上最多可生成氯气多少升(标准状况)
被电解,理论上最多可生成氯气多少升(标准状况)
您最近一年使用:0次
2022-11-18更新
|
178次组卷
|
2卷引用:贵州省遵义市第二教育集团2023-2024学年高一上学期期末化学模拟试卷



