解题方法
1 . 生物地球氮化学循环模式图的一部分如图,请根据所学知识回答问题。
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。

(1)属于氮的固定的是_______ (填标号)。
(2)利用如图装置可以制备、检验和收集NO。
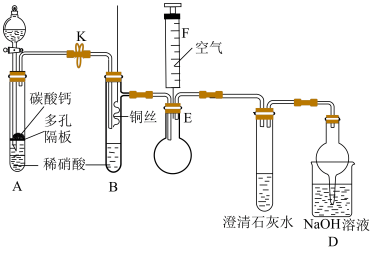
①实验前先打开开关K通入 一段时间,其目的是
一段时间,其目的是_______ 。采用抽拉铜丝与稀硝酸反应的优点为_______ 。
②检验生成的气体为NO的操作是_______ 。
③装置D的作用是_______ 。
(3)NO与 反应生成
反应生成 的离子方程式为
的离子方程式为_______ ,该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)写出铵根经硝化作用直接转化为硝酸根的离子方程式:_______ ,铵根浓度或pH过大,都会使硝化作用减弱的可能原因为_______ 。
已知:硝化作用是在有氧的条件下,氨或铵根经亚硝酸细菌和硝酸细菌的作用转化为硝酸的过程。铵根浓度或pH过大,都会使硝化作用减弱。

(1)属于氮的固定的是
(2)利用如图装置可以制备、检验和收集NO。

①实验前先打开开关K通入
 一段时间,其目的是
一段时间,其目的是②检验生成的气体为NO的操作是
③装置D的作用是
(3)NO与
 反应生成
反应生成 的离子方程式为
的离子方程式为(4)写出铵根经硝化作用直接转化为硝酸根的离子方程式:
您最近一年使用:0次
2023-09-24更新
|
194次组卷
|
4卷引用:贵州省普通高中部分学校2023-2024学年高二上学期第一次联考化学试题
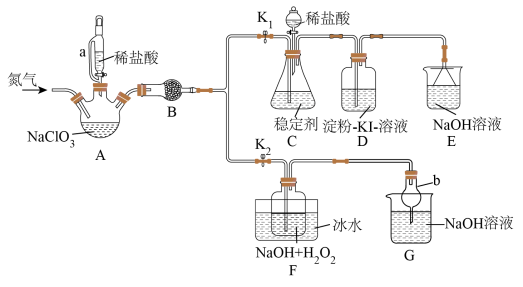
2 . 二氧化氯( )是目前国际上公认的第四代高效、无毒的广谱消毒剂,用如图所示装置(夹持装置已省略)制备、吸收、释放
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,用如图所示装置(夹持装置已省略)制备、吸收、释放 ,并探究其性质。(已知
,并探究其性质。(已知 ,实验室可用稳定剂吸收
,实验室可用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体)。
一种气体)。
已知:① 沸点为9.9℃,可溶于水,浓度较高时易发生爆炸;
沸点为9.9℃,可溶于水,浓度较高时易发生爆炸;
② 饱和溶液低于38℃时析出
饱和溶液低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 ,高于60℃时
,高于60℃时 分解为
分解为 和NaCl。回答下列问题:
和NaCl。回答下列问题:
(1)仪器a的名称是______ ;仪器b的作用是______ 。
(2)按图组装好仪器后,首先应该进行的操作是______ ,实验过程中需持续通入一定量的氮气,其目的是将装置A产生的气体赶入吸收装置被充分吸收,还有______ 。
(3)打开仪器a的活塞,装置A中发生反应,生成 、
、 、NaCl等,写出装置A中发生反应的化学方程式:
、NaCl等,写出装置A中发生反应的化学方程式:_____________ ,关闭仪器a的活塞, 在装置C中被稳定剂完全吸收,此时观察到装置D中溶液的颜色不变,其中的原因可能是
在装置C中被稳定剂完全吸收,此时观察到装置D中溶液的颜色不变,其中的原因可能是__________________ 。
(4)向装置C中滴加稀盐酸,反应剧烈,若将稀盐酸换成等pH的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因可能是____________ 。
(5)装置F的目的是制备 ,装置F中加入NaOH溶液的目的有两个,其一为用作反应物,其二为
,装置F中加入NaOH溶液的目的有两个,其一为用作反应物,其二为______ ,从装置F广口瓶内的溶液中获得晶体 的操作步骤是蒸发浓缩、
的操作步骤是蒸发浓缩、______ 、洗涤、干燥。
(6)城市饮用水处理新技术用 替代
替代 ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率:
______ 。
 )是目前国际上公认的第四代高效、无毒的广谱消毒剂,用如图所示装置(夹持装置已省略)制备、吸收、释放
)是目前国际上公认的第四代高效、无毒的广谱消毒剂,用如图所示装置(夹持装置已省略)制备、吸收、释放 ,并探究其性质。(已知
,并探究其性质。(已知 ,实验室可用稳定剂吸收
,实验室可用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体)。
一种气体)。
已知:①
 沸点为9.9℃,可溶于水,浓度较高时易发生爆炸;
沸点为9.9℃,可溶于水,浓度较高时易发生爆炸;②
 饱和溶液低于38℃时析出
饱和溶液低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 ,高于60℃时
,高于60℃时 分解为
分解为 和NaCl。回答下列问题:
和NaCl。回答下列问题:(1)仪器a的名称是
(2)按图组装好仪器后,首先应该进行的操作是
(3)打开仪器a的活塞,装置A中发生反应,生成
 、
、 、NaCl等,写出装置A中发生反应的化学方程式:
、NaCl等,写出装置A中发生反应的化学方程式: 在装置C中被稳定剂完全吸收,此时观察到装置D中溶液的颜色不变,其中的原因可能是
在装置C中被稳定剂完全吸收,此时观察到装置D中溶液的颜色不变,其中的原因可能是(4)向装置C中滴加稀盐酸,反应剧烈,若将稀盐酸换成等pH的硫酸,开始反应缓慢,稍后一段时间产生气体速率迅速加快,产生气体速率迅速加快的原因可能是
(5)装置F的目的是制备
 ,装置F中加入NaOH溶液的目的有两个,其一为用作反应物,其二为
,装置F中加入NaOH溶液的目的有两个,其一为用作反应物,其二为 的操作步骤是蒸发浓缩、
的操作步骤是蒸发浓缩、(6)城市饮用水处理新技术用
 替代
替代 ,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率:
您最近一年使用:0次
2023-08-31更新
|
142次组卷
|
3卷引用:贵州省部分中学2023-2024学年高三上学期第四次月考化学试题
解题方法
3 . “84”消毒液的主要成分为NaClO,在疫情期间发挥着重要作用。实验探究发现,在不同的温度下, 通入NaOH溶液中主要发生以下两个歧化反应,如图所示,下列说法正确的是
通入NaOH溶液中主要发生以下两个歧化反应,如图所示,下列说法正确的是

 通入NaOH溶液中主要发生以下两个歧化反应,如图所示,下列说法正确的是
通入NaOH溶液中主要发生以下两个歧化反应,如图所示,下列说法正确的是
| A.反应Ⅰ和Ⅱ都有NaCl生成 |
B. 的空间结构为正四面体形 的空间结构为正四面体形 |
C.反应Ⅰ和Ⅱ中,参加反应的 与NaOH的物质的量之比:Ⅰ<Ⅱ 与NaOH的物质的量之比:Ⅰ<Ⅱ |
D.反应Ⅰ和Ⅱ中,每1mol  参与反应转移的电子数之比为5:3 参与反应转移的电子数之比为5:3 |
您最近一年使用:0次
2023-08-14更新
|
220次组卷
|
2卷引用:贵州省六校联盟2024届高三开学实用性联考(一)化学试题
名校
解题方法
4 . 实验室从含I-的溶液中提取I2的流程如下:
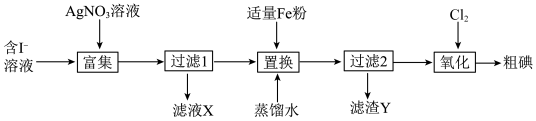
已知2Fe3+ + 2I-= 2Fe2+ + I2。下列说法不正确的是

已知2Fe3+ + 2I-= 2Fe2+ + I2。下列说法不正确的是
| A.“过滤1”所得沉淀为AgI |
| B.“过滤2”所得滤液中铁元素主要以Fe3+的形式存在 |
| C.用稀HNO3溶解滤渣Y得到的溶液可循环利用 |
D.氧化时,理论上通入Cl2的物质的量为I-物质的量的 |
您最近一年使用:0次
2023-07-29更新
|
428次组卷
|
5卷引用:贵州省黔西南州金成实验学校2023-2024学年高二上学期第三次质量检测化学试题
解题方法
5 . 七水合硫酸亚铁 在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为
在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为 、含少量
、含少量 等杂质)制备
等杂质)制备 的一种流程如下:
的一种流程如下:

已知:
(1)“滤渣Ⅰ”的主要成分是___________ (填名称);“酸浸”前粉碎硫铁矿烧渣的目的是___________ 。
(2)“滤液Ⅰ”加入过量的 溶液,发生反应的离子方程式有
溶液,发生反应的离子方程式有___________ 、___________ 和___________ ,检验 离子沉淀完全的实验操作是
离子沉淀完全的实验操作是___________ 。
(3)“滤液Ⅱ”中主要的阴离子有___________ (填离子符号)。
(4)为得到纯净的产物,加入“试剂Ⅰ”是___________ (填序号,下同),“试剂Ⅱ”是___________ 。
① ②
② ③
③ ④
④
⑤ ⑥
⑥
(5)“滤液Ⅲ”经___________ 、___________ 、过滤、洗涤,得到 晶体。
晶体。
(6)某同学用酸性 测定某补血剂
测定某补血剂 中铁的含量:取
中铁的含量:取 补血药片,加硫酸酸化后,滴加
补血药片,加硫酸酸化后,滴加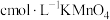 溶液
溶液 恰好完全反应(假定药片中其他成分与
恰好完全反应(假定药片中其他成分与 不反应),则该补血剂中铁元素的质量分数为
不反应),则该补血剂中铁元素的质量分数为___________  。
。
 在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为
在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为 、含少量
、含少量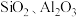 等杂质)制备
等杂质)制备 的一种流程如下:
的一种流程如下:
已知:

(1)“滤渣Ⅰ”的主要成分是
(2)“滤液Ⅰ”加入过量的
 溶液,发生反应的离子方程式有
溶液,发生反应的离子方程式有 离子沉淀完全的实验操作是
离子沉淀完全的实验操作是(3)“滤液Ⅱ”中主要的阴离子有
(4)为得到纯净的产物,加入“试剂Ⅰ”是
①
 ②
② ③
③ ④
④
⑤
 ⑥
⑥
(5)“滤液Ⅲ”经
 晶体。
晶体。(6)某同学用酸性
 测定某补血剂
测定某补血剂 中铁的含量:取
中铁的含量:取 补血药片,加硫酸酸化后,滴加
补血药片,加硫酸酸化后,滴加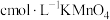 溶液
溶液 恰好完全反应(假定药片中其他成分与
恰好完全反应(假定药片中其他成分与 不反应),则该补血剂中铁元素的质量分数为
不反应),则该补血剂中铁元素的质量分数为 。
。
您最近一年使用:0次
6 . 交警查酒驾所用仪器中橙红色的重铬酸钾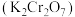 变为蓝绿色的铬离子,原理为:
变为蓝绿色的铬离子,原理为: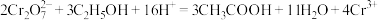 ,下列说法正确的是
,下列说法正确的是
 变为蓝绿色的铬离子,原理为:
变为蓝绿色的铬离子,原理为: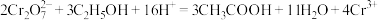 ,下列说法正确的是
,下列说法正确的是A.还原剂是 ,还原产物是 ,还原产物是 |
B. 发生氧化反应, 发生氧化反应, 发生还原反应 发生还原反应 |
C. 的氧化性小于 的氧化性小于 的氧化性 的氧化性 |
D.反应消耗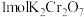 时转移电子数 时转移电子数 |
您最近一年使用:0次
2023-07-19更新
|
256次组卷
|
2卷引用:贵州省毕节市2022-2023学年高一下学期期末联考化学试题
7 . 石青[ ]和石绿[
]和石绿[ ]是两种重要的矿物颜料。某颜料厂利用废铜矿渣(主要成分为
]是两种重要的矿物颜料。某颜料厂利用废铜矿渣(主要成分为 ,含少量
,含少量 、
、 )和废铜刻蚀液(主要含
)和废铜刻蚀液(主要含 、
、 、
、 、
、 、
、 )为原料,综合制备石青和石绿的工艺流程如下:
)为原料,综合制备石青和石绿的工艺流程如下:

已知: 的沸点为46.2℃;常温下,
的沸点为46.2℃;常温下,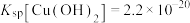 。
。
(1)①对于基态Cu原子,下列叙述正确的是_______ (填字母)。
a.核外电子排布式为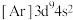
b.3d能级上的电子能量比4s的高,因此铜原子首先失去的是3d能级上的电子
c.第三电离能比第二电离能大
d.价层电子有11种不同的运动状态
② 的晶胞参数及部分原子的分数坐标如图所示。晶体中Cu的配位数为
的晶胞参数及部分原子的分数坐标如图所示。晶体中Cu的配位数为_______ ,A原子的分数坐标为_______ ; 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为_______  (列出计算式,用含a、b、
(列出计算式,用含a、b、 的代数式表示)。
的代数式表示)。

(2)“滤渣Ⅰ”中含有某种非金属单质,该非金属单质可用 提取并回收,回收过程中温度应控制在40~45℃之间,不宜过高的原因是
提取并回收,回收过程中温度应控制在40~45℃之间,不宜过高的原因是_______ ;“浸取”步骤中,废铜矿渣发生的主要化学反应方程式为_______ 。
(3)常温下,“调pH”步骤中,需调节 ,则溶液中
,则溶液中 最大不超过
最大不超过_______  。
。
(4)“沉铜”步骤中,可通过调节 和
和 的比例调控生成的产物,则生产石绿时,理论上投料比
的比例调控生成的产物,则生产石绿时,理论上投料比
_______ 。
 ]和石绿[
]和石绿[ ]是两种重要的矿物颜料。某颜料厂利用废铜矿渣(主要成分为
]是两种重要的矿物颜料。某颜料厂利用废铜矿渣(主要成分为 ,含少量
,含少量 、
、 )和废铜刻蚀液(主要含
)和废铜刻蚀液(主要含 、
、 、
、 、
、 、
、 )为原料,综合制备石青和石绿的工艺流程如下:
)为原料,综合制备石青和石绿的工艺流程如下:
已知:
 的沸点为46.2℃;常温下,
的沸点为46.2℃;常温下,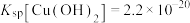 。
。(1)①对于基态Cu原子,下列叙述正确的是
a.核外电子排布式为
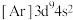
b.3d能级上的电子能量比4s的高,因此铜原子首先失去的是3d能级上的电子
c.第三电离能比第二电离能大
d.价层电子有11种不同的运动状态
②
 的晶胞参数及部分原子的分数坐标如图所示。晶体中Cu的配位数为
的晶胞参数及部分原子的分数坐标如图所示。晶体中Cu的配位数为 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (列出计算式,用含a、b、
(列出计算式,用含a、b、 的代数式表示)。
的代数式表示)。
(2)“滤渣Ⅰ”中含有某种非金属单质,该非金属单质可用
 提取并回收,回收过程中温度应控制在40~45℃之间,不宜过高的原因是
提取并回收,回收过程中温度应控制在40~45℃之间,不宜过高的原因是(3)常温下,“调pH”步骤中,需调节
 ,则溶液中
,则溶液中 最大不超过
最大不超过 。
。(4)“沉铜”步骤中,可通过调节
 和
和 的比例调控生成的产物,则生产石绿时,理论上投料比
的比例调控生成的产物,则生产石绿时,理论上投料比
您最近一年使用:0次
名校
解题方法
8 . “刀片电池”通过结构创新,大大提升了磷酸铁锂电池的能量密度。以下是以磷矿石(主要成分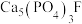 ,还有
,还有 、
、 ,等杂质)为原料生产白磷(
,等杂质)为原料生产白磷( )同时制得刀片电池正极材料
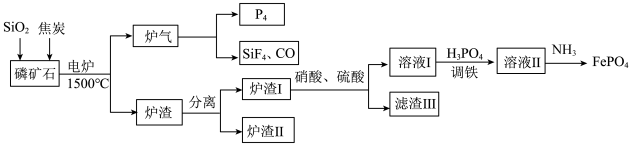
)同时制得刀片电池正极材料 的工艺流程:
的工艺流程:
已知: 可溶于强酸性溶液。
可溶于强酸性溶液。
回答下列问题:
(1)白磷( )不溶于水但易溶于二硫化碳,说明
)不溶于水但易溶于二硫化碳,说明 是
是___________ (填“极性分子”或“非极性分子”)。
(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中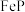 溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:
溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:___________ 。
(3)炉渣Ⅱ的主要成分是___________ 。
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是___________ 。若此条件下 恰好完全转化为
恰好完全转化为 沉淀(当溶液中某离子浓度
沉淀(当溶液中某离子浓度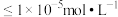 时,可视为该离子沉淀完全),求此时溶液中
时,可视为该离子沉淀完全),求此时溶液中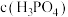 =
=___________ 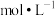 (已知
(已知 的
的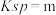 ;
; 的电离平衡常数为:
的电离平衡常数为: ,
,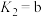 ,
,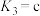 )。
)。
(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:
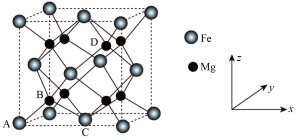
其中A的原子坐标参数为(0,0,0),B为( ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为___________ 。该晶胞沿体对角线方向的投影图为___________ 。
A.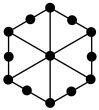 B.
B.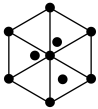 C.
C.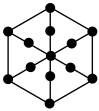 D.
D.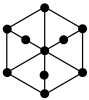
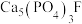 ,还有
,还有 、
、 ,等杂质)为原料生产白磷(
,等杂质)为原料生产白磷( )同时制得刀片电池正极材料
)同时制得刀片电池正极材料 的工艺流程:
的工艺流程:
已知:
 可溶于强酸性溶液。
可溶于强酸性溶液。回答下列问题:
(1)白磷(
 )不溶于水但易溶于二硫化碳,说明
)不溶于水但易溶于二硫化碳,说明 是
是(2)炉渣Ⅰ主要含有铁单质及铁的磷化物,写出其中
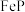 溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:
溶于硝酸和硫酸的混合溶液并放出NO气体的离子方程式:(3)炉渣Ⅱ的主要成分是
(4)“调铁”后须向“溶液Ⅱ”中通入氨气调节溶液的pH,将pH值控制在2.0的原因是
 恰好完全转化为
恰好完全转化为 沉淀(当溶液中某离子浓度
沉淀(当溶液中某离子浓度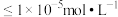 时,可视为该离子沉淀完全),求此时溶液中
时,可视为该离子沉淀完全),求此时溶液中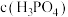 =
=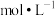 (已知
(已知 的
的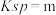 ;
; 的电离平衡常数为:
的电离平衡常数为: ,
,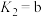 ,
,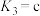 )。
)。(5)储氢技术是目前化学家研究的热点之一;铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:

其中A的原子坐标参数为(0,0,0),B为(
 ,
, ,
, ),C为(
),C为( ,
, ,0),则D点的坐标参数为
,0),则D点的坐标参数为A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
名校
解题方法
9 . 铍及其化合物用途广泛,以绿柱石(主要组成是3BeO·Al2O3·6SiO2, 还含少量铁元素)和方解石(主要成分是CaCO3)为原料生产铍的工艺流程如图所示:

已知:①铝铵矾[NH4Al(SO4 )2·12H2O]在不同温度下的溶解度如下表:
②Be(OH)2性质和Al(OH)3相似,是两性氢氧化物。
回答下列问题:
(1)绿柱石中Be的化合价为___________ 。“熔炼”中生成气体的电子式为 ___________ 。
(2)滤渣1中除SiO2及难溶性硅酸盐外,还含有___________ (填化学式); “转化”后,要得到铝铵矾晶体,在中学实验室中可采取的操作是___________ 、___________ 、过滤、 洗涤、干燥。
(3)加H2O2时,溶液中发生反应的离子方程式是___________ 。
(4)“沉铍”时,若选用氢氧化钠溶液可能造成的影响是___________ ,所得母液中的主要溶质可返回到___________ 工序循环利用。
(5)“沉铍”时加入氨水调节pH至7.5,列式并计算说明此时溶液中的铍离子是否沉淀完全___________ 。(已知:该条件下,Ksp[Be(OH)2]=1.6×10-22; 离子浓度≤1×10-5mol·L-1时,可认为离子沉淀完全。)

已知:①铝铵矾[NH4Al(SO4 )2·12H2O]在不同温度下的溶解度如下表:
| 温度/°C | 0 | 10 | 20 | 30 | 40 | 60 |
| 溶解度/g | 2.10 | 5.00 | 7.74 | 10.9 | 14.9 | 26.7 |
回答下列问题:
(1)绿柱石中Be的化合价为
(2)滤渣1中除SiO2及难溶性硅酸盐外,还含有
(3)加H2O2时,溶液中发生反应的离子方程式是
(4)“沉铍”时,若选用氢氧化钠溶液可能造成的影响是
(5)“沉铍”时加入氨水调节pH至7.5,列式并计算说明此时溶液中的铍离子是否沉淀完全
您最近一年使用:0次
2023-05-20更新
|
279次组卷
|
2卷引用:贵州省贵阳市2023届高三下学期适应性考试(二)理综化学试题
名校
解题方法
10 . Cl2O是一种高效消毒剂,易溶于水且会与水反应,与有机物接触时会爆炸。制备原理: HgO+2Cl2 HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。
HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。

已知:
回答下列问题:
(1)仪器a的名称是___________ ,装置A中所发生反应的离子反应方程式为____________ 。
(2)装置B中的试剂是饱和食盐水,其作用是___________ ;装置C中盛放的是__________ 。
(3)制取Cl2O是“气-固”反应,反应柱D中不利于该反应的措施是___________ 。
a.将HgO粉末化并加热去除水分,加玻璃珠与之混合填入反应柱D
b.为使Cl2与HgO充分接触,让混合气从下口进入反应柱D并调控流速
c.为提高Cl2O的生成速率,将加热带缠绕于反应柱D并加热到45°C
(4)装置E中的液态冷却剂可选用___________ (液氨、冰盐水、液氮) ;装置A、B、C间连接器的材质与反应柱D、装置E、F间连接器的材质有明显差别,原因是___________ 。
(5)若将装置组装完整,虚框F中可选用___________ (填字母序号)。

(6)ClO2和Cl2O在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2O的___________ 倍(结果保留两位小数)。
 HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。
HgCl2+Cl2O, 装置如图(部分夹持仪器已省略)。
已知:
| Cl2O | N2 | NH3 | Cl2 | |
| 熔点/°C | -120.6 | -209.86 | -77.3 | -101 |
| 沸点/°C | 2.0 | -195.8 | -33.35 | -34.6 |
(1)仪器a的名称是
(2)装置B中的试剂是饱和食盐水,其作用是
(3)制取Cl2O是“气-固”反应,反应柱D中不利于该反应的措施是
a.将HgO粉末化并加热去除水分,加玻璃珠与之混合填入反应柱D
b.为使Cl2与HgO充分接触,让混合气从下口进入反应柱D并调控流速
c.为提高Cl2O的生成速率,将加热带缠绕于反应柱D并加热到45°C
(4)装置E中的液态冷却剂可选用
(5)若将装置组装完整,虚框F中可选用

(6)ClO2和Cl2O在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2O的
您最近一年使用:0次
2023-05-20更新
|
321次组卷
|
4卷引用:贵州省贵阳市2023届高三下学期适应性考试(二)理综化学试题



