名校
1 .  与
与 在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法
在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法错误 的是
 与
与 在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法
在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法| A.NO为极性分子 |
| B.H2S的VSEPR模型为三角锥形 |
C.HSNO的结构式为 |
| D.NO与H2S反应生成的两种单质为S、N2 |
您最近一年使用:0次
2024-03-14更新
|
288次组卷
|
3卷引用:贵州省贵阳市第六中学2024届高三下学期一模考试化学试题
2 . 某化学兴趣小组,利用NaHSO3溶液和酸性KMnO4溶液(使用稀H2SO4酸化)反应探究外界因素对化学反应速率的影响。
Ⅰ.原理分析:
(1)反应过程中 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式_______________ 。
(2)实验过程中,NaHSO3的用量要保证足量,通过比较________ (填“实验现象”)所需时间的长短来判断反应的快慢。
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
(3)对比实验①②,使用探究________ 对化学反应速率的影响;若实验②③是用来探究温度对化学反应速率的影响,则V1=________ mL。
(4)若t1=25s,则用HSO 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= ________ 。
Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
(5)为了实验结论的可靠性,试剂X应该选择________。
(6)实验后,若t4_____ t1(填“大于”、“小于”或 “等于”),说明猜想2成立。
Ⅰ.原理分析:
(1)反应过程中
 被氧化为
被氧化为 ,
, 被还原为Mn2+,请写出实验过程中的离子方程式
被还原为Mn2+,请写出实验过程中的离子方程式(2)实验过程中,NaHSO3的用量要保证足量,通过比较
Ⅱ.实验过程
该化学兴趣小组设计如下实验方案:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.6mol/L NaHSO3溶液 | 0.2mol/L酸性KMnO4溶液 | 水 | |||
| ① | 25 | 20 | 20 | 10 | t1 |
| ② | 25 | 25 | 20 | 5 | t2 |
| ③ | 50 | V1 | 20 | 5 | t3 |
(3)对比实验①②,使用探究
(4)若t1=25s,则用HSO
 表示实验①的化学反应速率v(
表示实验①的化学反应速率v( )=
)= Ⅲ.实验分析和探究
该化学兴趣小组通过反复实验发现,该反应的化学反应速率总是先增大后减小,该化学兴趣小组猜想可能有两个原因,并作出了猜想:
猜想1:该反应放热,使溶液温度升高,化学反应速率加快
猜想2:新生成的微粒Mn2+对该反应有催化的作用
该化学兴趣小组,通过监测实验①反应过程的温度变化情况,数据显示反应过程中混合溶液的温度基本保持不变,排除猜想1的可能性。并设计第④组实验验证猜想2。设计如下:
| 编号 | 实验温度/℃ | 所用试剂的体积/mL | 达到(2)中现象所需时间/min | ||
| 0.5mol/L NaHSO3溶液 | 0.2mol/L 酸性KMnO4溶液 | 试剂X | |||
| ④ | 25 | 20 | 20 | 10 | t4 |
(5)为了实验结论的可靠性,试剂X应该选择________。
| A.MnCl2溶液 | B.MnSO4溶液 |
| C.Mn(NO3)2溶液 | D.Mn(HSO3)2溶液 |
(6)实验后,若t4
您最近一年使用:0次
解题方法
3 . Na2S2O4(保险粉)是一种强还原剂,锌粉法制备Na2S2O4.所发生的化学方程式如下:2SO2+Zn+2NaOH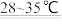 Na2S2O4+Zn(OH)2↓,下列有关该反应的说法
Na2S2O4+Zn(OH)2↓,下列有关该反应的说法不正确 的是
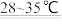 Na2S2O4+Zn(OH)2↓,下列有关该反应的说法
Na2S2O4+Zn(OH)2↓,下列有关该反应的说法| A.保险粉(Na2S2O4)中,S的化合价为+3价 |
| B.控制温度在28~35℃应该采用水浴加热 |
| C.在该反应中SO2做氧化剂,Zn(OH)2作氧化产物 |
| D.消耗标况下22.4L的SO2,转移的电子数为2NA |
您最近一年使用:0次
解题方法
4 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近一年使用:0次
5 . 钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为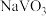 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。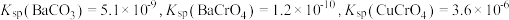 。
。
回答下列问题:
(1)基态铬原子价电子轨道表示式为_______ 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有_______ (任写一点)。
(3)“沉钒”的含钒产物为钒酸钙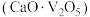 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是_______ 。
(4)“沉铬”时,铬转化为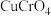 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为_______ 。
(5)向“沉钒后液”中加入足量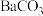 ,可将其中的铬转化为
,可将其中的铬转化为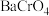 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为_______ (保留三位有效数字) 。
。
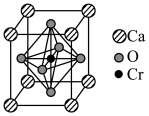
(6)复合材料氧铬酸钙的立方晶胞如下图所示。_______ 。
②已知该晶体的密度为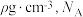 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与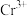 之间的最短距离为
之间的最短距离为_______ 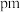 (列出计算式即可)。
(列出计算式即可)。
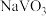 和
和 ,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。
,还含有其他难溶物)分离回收钒、铬的工艺流程如下图所示。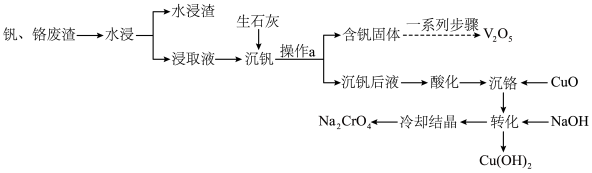
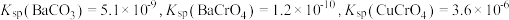 。
。回答下列问题:
(1)基态铬原子价电子轨道表示式为
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有
(3)“沉钒”的含钒产物为钒酸钙
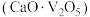 ,该过程中发生反应的化学方程式是
,该过程中发生反应的化学方程式是(4)“沉铬”时,铬转化为
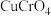 沉淀,“转化”过程中发生反应的离子方程式为
沉淀,“转化”过程中发生反应的离子方程式为(5)向“沉钒后液”中加入足量
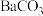 ,可将其中的铬转化为
,可将其中的铬转化为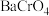 沉淀,铬的理论转化率为
沉淀,铬的理论转化率为 。
。(6)复合材料氧铬酸钙的立方晶胞如下图所示。
②已知该晶体的密度为
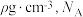 为阿伏加德罗常数的值,则相邻
为阿伏加德罗常数的值,则相邻 与
与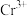 之间的最短距离为
之间的最短距离为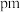 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2024-02-27更新
|
658次组卷
|
4卷引用:贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题
贵州省黔东南苗族侗族自治州黔东南州九校联考2023-2024学年高三下学期开学化学试题广东省湛江市2024届高三下学期第二次模拟测试化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)2024届河南省中原名校高三下学期考前全真模拟考试理科综合试题-高中化学
6 . 漂白液、漂粉精既可用作漂白棉、麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂,下列说法正确的是
A.漂粉精的主要成分仅为 |
| B.漂白液在浓盐酸中能大量存在 |
C.漂粉精暴露在空气中易变质的原因为 |
| D.漂白液可用于漂白棉、麻、纸张的原因为漂白液具有还原性 |
您最近一年使用:0次
7 . 钠及其化合物在生活生产中应用广泛,下面是一些它们的具体应用及反应原理。
①碳酸氢钠作食品膨松剂: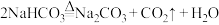
②氢化钠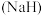 可用作野外生氢剂:
可用作野外生氢剂: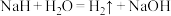
③钠单质组成“可呼吸”的 充电电池:
充电电池: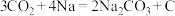
④饱和食盐水作侯氏制碱原料: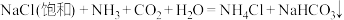
⑤电解饱和食盐水制备氯气和氢氧化钠(氯碱工业):
⑥高铁酸钠 可同时消毒和净水:
可同时消毒和净水: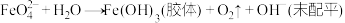
回答下列问题:
(1)以上反应中不属于氧化还原反应的是___________ (填标号)。
(2)钠是一种很活泼的金属,可用石蜡封存,实验室少量 保存于
保存于___________ 中(填字母)。
A.细沙 B.水 C.煤油
(3)野外生氢剂 中氢元素的化合价为
中氢元素的化合价为___________ 价,常用作___________ (填“氧化剂”或“还原剂”)。
(4)“可呼吸” 充电电池消耗
充电电池消耗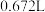 (标准状况)
(标准状况) 气体时,转移电子数为
气体时,转移电子数为_____  。
。
(5)氯碱工业生产中会使用阳离子交换膜,目的之一是将 溶液和
溶液和 分隔开,若未分隔开,两者会发生反应,该反应的化学反应方程式为
分隔开,若未分隔开,两者会发生反应,该反应的化学反应方程式为___________ 。
(6)请配平高铁酸钠 (
( 为
为 价)在水中发生反应的离子反应方程式:
价)在水中发生反应的离子反应方程式:___________ 。
并比较氧化性强弱:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
①碳酸氢钠作食品膨松剂:
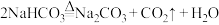
②氢化钠
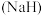 可用作野外生氢剂:
可用作野外生氢剂: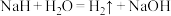
③钠单质组成“可呼吸”的
 充电电池:
充电电池: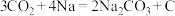
④饱和食盐水作侯氏制碱原料:
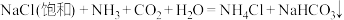
⑤电解饱和食盐水制备氯气和氢氧化钠(氯碱工业):

⑥高铁酸钠
 可同时消毒和净水:
可同时消毒和净水: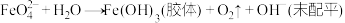
回答下列问题:
(1)以上反应中不属于氧化还原反应的是
(2)钠是一种很活泼的金属,可用石蜡封存,实验室少量
 保存于
保存于A.细沙 B.水 C.煤油
(3)野外生氢剂
 中氢元素的化合价为
中氢元素的化合价为(4)“可呼吸”
 充电电池消耗
充电电池消耗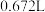 (标准状况)
(标准状况) 气体时,转移电子数为
气体时,转移电子数为 。
。(5)氯碱工业生产中会使用阳离子交换膜,目的之一是将
 溶液和
溶液和 分隔开,若未分隔开,两者会发生反应,该反应的化学反应方程式为
分隔开,若未分隔开,两者会发生反应,该反应的化学反应方程式为(6)请配平高铁酸钠
 (
( 为
为 价)在水中发生反应的离子反应方程式:
价)在水中发生反应的离子反应方程式:
并比较氧化性强弱:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
8 . 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下: 是一种铵盐;
是一种铵盐;
② 在溶液中常以
在溶液中常以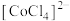 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;
③ 时,
时, 。
。
回答下列问题:
(1) 中
中 的化合价为
的化合价为_______ 。
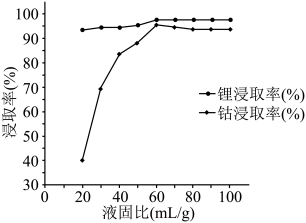
(2)下图为“微波共熔”中氯化胆碱-草酸和 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为_______  。
。_______ 。
(4) 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时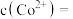
_______  。
。
(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是_______ 。
(6)“高温烧结”中需要通入空气,其作用是_______ 。
(7)锂离子电池正极材料 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。
① 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为_______ (用离子符号表示)。
②使用 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为_______ 。
 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下:
 是一种铵盐;
是一种铵盐;②
 在溶液中常以
在溶液中常以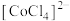 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;③
 时,
时, 。
。回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)下图为“微波共熔”中氯化胆碱-草酸和
 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为 。
。
(4)
 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时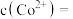
 。
。(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是
(6)“高温烧结”中需要通入空气,其作用是
(7)锂离子电池正极材料
 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。①
 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为②使用
 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为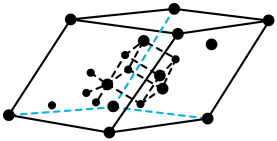
您最近一年使用:0次
2024-01-22更新
|
1119次组卷
|
5卷引用:2024年1月贵州普通高等学校招生考试适应性测试化学试题
2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)T16-工业流程题辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
9 . 高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为
是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 ,杂质有
,杂质有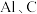 及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是
及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是

 是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为
是一种新型绿色消毒剂,主要用于饮用水处理。某化学兴趣小组用废铁屑(主要成分为 ,杂质有
,杂质有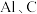 及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是
及油脂)制备高铁酸钠的主要流程如下。下列说法错误的是
| A.“碱浸”可以除去废铁屑中的油脂 |
B.“滤渣”的主要成分是 和 和 |
C.“操作Ⅰ”通入的空气可以用 溶液代替 溶液代替 |
D.若流程改为先“氧化”后“调 ”,可能会生成 ”,可能会生成 |
您最近一年使用:0次
2024-01-22更新
|
769次组卷
|
5卷引用:2024年1月贵州普通高等学校招生考试适应性测试化学试题
2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)选择题11-14(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升江苏省扬州中学2023-2024学年高二下学期3月考试化学试题
名校
解题方法
10 . 贵州磷矿储量丰富。磷酸氢钙( )是一种磷肥,某工厂利用磷矿(含
)是一种磷肥,某工厂利用磷矿(含 等元素)进行综合生产的部分流程如图所示:
等元素)进行综合生产的部分流程如图所示: 。
。
回答下列问题:
(1) 的分子空间结构为
的分子空间结构为___________ 。
(2)为提高浸出效率,可采取的措施有___________ (任写一条),用离子方程式说明酸浸时通入 的目的:
的目的:___________ ,滤渣1的主要成分是___________ 。
(3)常温下,酸浸后滤液1中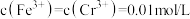 、
、 ,调节
,调节 将
将 完全沉淀,滤液2调节
完全沉淀,滤液2调节 的范围为
的范围为___________ 。
(4)为使 与
与 完全反应生成
完全反应生成 ,二者质量之比为
,二者质量之比为___________ 。
(5)利用 可制得
可制得 ,一定条件下,
,一定条件下, 可与
可与 、过量C反应,生成可用于制作锂电池的
、过量C反应,生成可用于制作锂电池的 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
(6)氧化镁熔沸点高,可制造耐火、耐高温器材,其晶胞结构如图所示。该晶体中每个 周围与它最近且距离相等的
周围与它最近且距离相等的 数为
数为___________ ;若该立方晶胞参数为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 )是一种磷肥,某工厂利用磷矿(含
)是一种磷肥,某工厂利用磷矿(含 等元素)进行综合生产的部分流程如图所示:
等元素)进行综合生产的部分流程如图所示: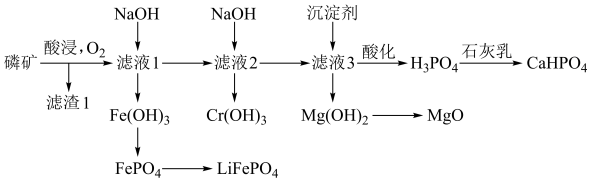
 。
。回答下列问题:
(1)
 的分子空间结构为
的分子空间结构为(2)为提高浸出效率,可采取的措施有
 的目的:
的目的:(3)常温下,酸浸后滤液1中
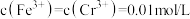 、
、 ,调节
,调节 将
将 完全沉淀,滤液2调节
完全沉淀,滤液2调节 的范围为
的范围为(4)为使
 与
与 完全反应生成
完全反应生成 ,二者质量之比为
,二者质量之比为(5)利用
 可制得
可制得 ,一定条件下,
,一定条件下, 可与
可与 、过量C反应,生成可用于制作锂电池的
、过量C反应,生成可用于制作锂电池的 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(6)氧化镁熔沸点高,可制造耐火、耐高温器材,其晶胞结构如图所示。该晶体中每个
 周围与它最近且距离相等的
周围与它最近且距离相等的 数为
数为 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。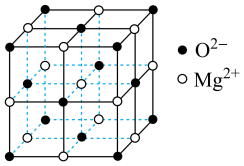
您最近一年使用:0次



