名校
1 . 下列关于氧化还原反应的叙述中,正确的说法只有
①有一种元素被氧化,肯定有其它元素被还原
②阳离子只有氧化性,阴离子只有还原性
③氧化还原反应中,失电子越多,还原性越强
④反应Co2O3+6HCl=2CoCl2+Cl2↑+3H2O中,HCl只表现出还原性
⑤有单质参加的分解反应一定是氧化还原反应
⑥必须加氧化剂才能实现H2O2→O2
⑦重铬酸铵[(NH4)2Cr2O7]分解产物不可能只有Cr2O3、NH3和H2O
⑧用分解H2O2和KClO3固体的方法分别制氧气,若生成等量O2时,转移电子数为1∶1
⑨向等浓度的AgNO3和Cu(NO3)2混合溶液中加入少量锌粉,Ag+优先被氧化
①有一种元素被氧化,肯定有其它元素被还原
②阳离子只有氧化性,阴离子只有还原性
③氧化还原反应中,失电子越多,还原性越强
④反应Co2O3+6HCl=2CoCl2+Cl2↑+3H2O中,HCl只表现出还原性
⑤有单质参加的分解反应一定是氧化还原反应
⑥必须加氧化剂才能实现H2O2→O2
⑦重铬酸铵[(NH4)2Cr2O7]分解产物不可能只有Cr2O3、NH3和H2O
⑧用分解H2O2和KClO3固体的方法分别制氧气,若生成等量O2时,转移电子数为1∶1
⑨向等浓度的AgNO3和Cu(NO3)2混合溶液中加入少量锌粉,Ag+优先被氧化
| A.2个 | B.3个 | C.4个 | D.5个 |
您最近一年使用:0次
2023-11-14更新
|
105次组卷
|
2卷引用:新疆乌鲁木齐八一中学2023-2024学年高一上学期1月月考化学试卷
名校
2 . Ⅰ.现有下列10种物质:①铜 ②熔融 ③
③ ④
④ ⑤
⑤ 晶体 ⑥
晶体 ⑥ ⑦盐酸 ⑧酒精
⑦盐酸 ⑧酒精
(1)上述物质中属于电解质的有__________ ,能导电的有__________ 。(填序号)
(2)写出⑤在水溶液中的电离方程式:________________________________________
(3)向 溶液逐滴加入
溶液逐滴加入 溶液至
溶液至 恰好完全沉淀,然后继续滴加
恰好完全沉淀,然后继续滴加 溶液。请写出“继续滴加
溶液。请写出“继续滴加 溶液”此步发生的离子反应方程式为
溶液”此步发生的离子反应方程式为_____________________________ 。
Ⅱ.高铁酸钾( )是生活中饮用水的绿色消毒剂、净水剂。以赤铁矿为原料制备高铁酸钾的简易流程如下:
)是生活中饮用水的绿色消毒剂、净水剂。以赤铁矿为原料制备高铁酸钾的简易流程如下:
赤铁矿粉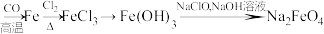 溶液
溶液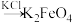
(4) 处理饮用水的原理如下:它具有强氧化性,能夺取细菌体内电子达到杀菌目的。它本身被
处理饮用水的原理如下:它具有强氧化性,能夺取细菌体内电子达到杀菌目的。它本身被______ (填“氧化”或“还原”)成 ,
, 水解生成胶体粒子,胶体聚沉水中杂质。欲分离氢氧化铁胶体与氯化钠的混合液应用
水解生成胶体粒子,胶体聚沉水中杂质。欲分离氢氧化铁胶体与氯化钠的混合液应用___________ 的操作方法。
(5) 与
与 在碱性环境能生成
在碱性环境能生成 ,配平以下离子方程式:
,配平以下离子方程式:
____  ____
____ _____
_____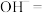 _____
_____ _____
_____ ______
______
(6) 在碱性条件下能稳定存在,在酸性条件下不稳定。在稀硫酸中加入适量
在碱性条件下能稳定存在,在酸性条件下不稳定。在稀硫酸中加入适量 ,迅速反应,放出气体,溶液变成黄色,该气体是
,迅速反应,放出气体,溶液变成黄色,该气体是_________ ,该反应的离子方程式为_______________________________
 ③
③ ④
④ ⑤
⑤ 晶体 ⑥
晶体 ⑥ ⑦盐酸 ⑧酒精
⑦盐酸 ⑧酒精(1)上述物质中属于电解质的有
(2)写出⑤在水溶液中的电离方程式:
(3)向
 溶液逐滴加入
溶液逐滴加入 溶液至
溶液至 恰好完全沉淀,然后继续滴加
恰好完全沉淀,然后继续滴加 溶液。请写出“继续滴加
溶液。请写出“继续滴加 溶液”此步发生的离子反应方程式为
溶液”此步发生的离子反应方程式为Ⅱ.高铁酸钾(
 )是生活中饮用水的绿色消毒剂、净水剂。以赤铁矿为原料制备高铁酸钾的简易流程如下:
)是生活中饮用水的绿色消毒剂、净水剂。以赤铁矿为原料制备高铁酸钾的简易流程如下:赤铁矿粉
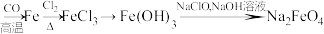 溶液
溶液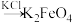
(4)
 处理饮用水的原理如下:它具有强氧化性,能夺取细菌体内电子达到杀菌目的。它本身被
处理饮用水的原理如下:它具有强氧化性,能夺取细菌体内电子达到杀菌目的。它本身被 ,
, 水解生成胶体粒子,胶体聚沉水中杂质。欲分离氢氧化铁胶体与氯化钠的混合液应用
水解生成胶体粒子,胶体聚沉水中杂质。欲分离氢氧化铁胶体与氯化钠的混合液应用(5)
 与
与 在碱性环境能生成
在碱性环境能生成 ,配平以下离子方程式:
,配平以下离子方程式: ____
____ _____
_____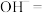 _____
_____ _____
_____ ______
______(6)
 在碱性条件下能稳定存在,在酸性条件下不稳定。在稀硫酸中加入适量
在碱性条件下能稳定存在,在酸性条件下不稳定。在稀硫酸中加入适量 ,迅速反应,放出气体,溶液变成黄色,该气体是
,迅速反应,放出气体,溶液变成黄色,该气体是
您最近一年使用:0次
3 . 海洋中蕴藏着丰富的资源,利用海水化学资源可制备多种物质。海水综合利用的部分过程如图。请按要求回答下列问题:

(1)请按要求将NaCl溶液、H2、Cl2、NaOH、HCl、NaClO进行分类:
单质:___________ ;碱___________ ;盐:___________ 。
(2)粗盐中含有Ca2+、Mg2+和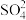 ,需加入Na2CO3溶液、BaCl2溶液、NaOH溶液和盐酸除去。步骤①中除去这三种离子加入试剂的顺序依次为
,需加入Na2CO3溶液、BaCl2溶液、NaOH溶液和盐酸除去。步骤①中除去这三种离子加入试剂的顺序依次为___________ (填标号)、稀盐酸。
A.NaOH、Na2CO3、BaCl2 B.BaCl2、NaOH、Na2CO3 C.BaCl2、Na2CO3、NaOH
(3)步骤③中反应的离子方程式为___________ 。
(4)漂白液(有效成分为NaClO)可用于泳池水的消毒。空气中的CO2与之反应生成一种漂白性物质和碳酸氢盐,反应的离子方程式为___________ 。
(5)已知还原性: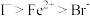 。向含1.55gFel2和1.08gFeBr2的混合溶液中,通入0.71gCl2,则被氧化的离子是
。向含1.55gFel2和1.08gFeBr2的混合溶液中,通入0.71gCl2,则被氧化的离子是___________ 。

(1)请按要求将NaCl溶液、H2、Cl2、NaOH、HCl、NaClO进行分类:
单质:
(2)粗盐中含有Ca2+、Mg2+和
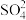 ,需加入Na2CO3溶液、BaCl2溶液、NaOH溶液和盐酸除去。步骤①中除去这三种离子加入试剂的顺序依次为
,需加入Na2CO3溶液、BaCl2溶液、NaOH溶液和盐酸除去。步骤①中除去这三种离子加入试剂的顺序依次为A.NaOH、Na2CO3、BaCl2 B.BaCl2、NaOH、Na2CO3 C.BaCl2、Na2CO3、NaOH
(3)步骤③中反应的离子方程式为
(4)漂白液(有效成分为NaClO)可用于泳池水的消毒。空气中的CO2与之反应生成一种漂白性物质和碳酸氢盐,反应的离子方程式为
(5)已知还原性:
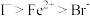 。向含1.55gFel2和1.08gFeBr2的混合溶液中,通入0.71gCl2,则被氧化的离子是
。向含1.55gFel2和1.08gFeBr2的混合溶液中,通入0.71gCl2,则被氧化的离子是
您最近一年使用:0次
名校
4 . 吸入氧气、排出二氧化碳,这看似再简单不过的新陈代谢,在遥远的太空中却并不容易,因为在航天服、航天器、空间站等密闭系统中,CO2浓度会高得多,而超过一定浓度会导致呼吸急促、头晕头痛、昏迷甚至死亡,因此必须通过一定方法将CO2清除。
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为___________ 。采用LiOH而不用NaOH的原因是___________ 。
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是___________ 变化。
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
Ⅳ.富集CO2的原电池模拟装置如图:
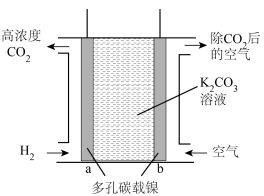
(4)b极为___________ 极,a电极上发生的电极反应为___________ 。
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(6)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:
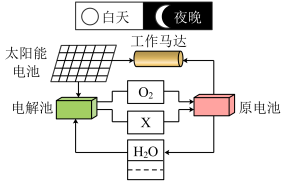
关于该循环系统下列说法正确的是
I.非再生式氢氧化锂(LiOH)除碳技术
(1)我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附时发生反应的化学方程式为
Ⅱ.再生式快速循环胺技术
(2)以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2,从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是
Ⅲ.萨巴蒂尔(Sabatier)除碳生氧技术
(3)利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。

下列说法错误的是___________。
| A.CO2的最终产物为CH4和O2 |
| B.电解水装置中,反应物的能量高于生成物的能量 |
| C.萨巴蒂尔反应器中反应的氧化剂与还原剂物质的量之比为1∶4 |
| D.物质转化中O、H原子的利用率均为100% |
Ⅳ.富集CO2的原电池模拟装置如图:

(4)b极为
(5)上述电极材料采用多孔碳载镍,“多孔”的优点是
(6)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
V.能量存储与循环技术
(7)将电解水装置与燃料电池配合使用,可实现充放电的循环过程,应用于长寿命的航天器中,工作原理如图:

关于该循环系统下列说法正确的是
| A.该系统中存在着太阳能、电能、化学能和机械能之间的相互转化 |
| B.电解池中可选用CuSO4来增强水的导电性 |
| C.太阳能电池帆板的主要成分为SiO2 |
| D.利用太阳能代替化石能源符合“低碳经济” |
您最近一年使用:0次
2023-10-24更新
|
462次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
名校
5 . 镓的化合物
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式_____ 。
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态_____ ,画出C和D的结构_____ 。
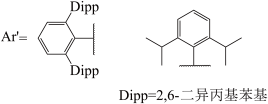
(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式_____ 。
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态

(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式
您最近一年使用:0次
2023-09-07更新
|
320次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高三下学期开学化学试题
6 . 三氯化铬( )是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
)是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。

已知: 沸点为8.2℃,有毒,易水解
沸点为8.2℃,有毒,易水解
回答下列问题:
(1)基态铬原子核外电子排布式为_____ ,三氯化铬固体的晶体类型为_____
(2)“热分解”发生反应的化学方程式为_____
(3)“热反应”制无水 的实验装置如图所示(AD中加热装置略)。
的实验装置如图所示(AD中加热装置略)。

①实验装置连接顺序为_____ 。
b→_____,_____→_____,_____→_____,_____→_____(填仪器接口字母)
②加热反应前通 的目的是
的目的是_____ 。
③A中仪器x的名称是_____ ,其作用是_____ 。
④E中收集的物质含有_____ (写化学式)。
⑤尾气经_____ 处理后可循环使用。
(4)已知 配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.87g白色沉淀。
溶液,得到2.87g白色沉淀。
① 中存在的化学键有
中存在的化学键有_____ (填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为_____ 。
 )是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
)是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
已知:
 沸点为8.2℃,有毒,易水解
沸点为8.2℃,有毒,易水解回答下列问题:
(1)基态铬原子核外电子排布式为
(2)“热分解”发生反应的化学方程式为
(3)“热反应”制无水
 的实验装置如图所示(AD中加热装置略)。
的实验装置如图所示(AD中加热装置略)。
①实验装置连接顺序为
b→_____,_____→_____,_____→_____,_____→_____(填仪器接口字母)
②加热反应前通
 的目的是
的目的是③A中仪器x的名称是
④E中收集的物质含有
⑤尾气经
(4)已知
 配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
配合物(Mr=266.5,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
溶于水,一定条件下结晶析出暗绿色晶体。称取5.33g该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.87g白色沉淀。
溶液,得到2.87g白色沉淀。①
 中存在的化学键有
中存在的化学键有a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为
您最近一年使用:0次
2023-08-30更新
|
671次组卷
|
4卷引用:新疆阿克苏市实验中学2023-2024学年高三上学期第二次月考化学试题
新疆阿克苏市实验中学2023-2024学年高三上学期第二次月考化学试题福建省泉州市普通高中毕业班2024届高三质量检测(一)(8月)化学试题(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
7 . 研究氮及其化合物的性质,可以有效改善人类的生存环境。氮及其化合物的“价—类二维图”如下,B是红棕色气体。下列有关说法中不正确的是


| A.工业上以A、空气和水为原料生产硝酸 |
| B.由B→NO,必须加入还原剂才能实现转化 |
| C.由A→N2,从原理上看,A可与NO反应实现 |
| D.氮的固定是将大气中的氮气转化成氮的化合物 |
您最近一年使用:0次
8 . 下列说法不正确的是
| A.某溶液焰色试验为黄色,说明溶液中肯定含钠元素,可能含钾元素 |
| B.重铬酸钾溶液中滴入某液体,颜色由橙变绿,说明液体中肯定含乙醇,可能含乙醛 |
| C.可用紫外可见分光光度法测定废水中苯酚的含量 |
| D.浓硝酸可检测蛋白质分子中是否含苯环结构 |
您最近一年使用:0次
2023-08-20更新
|
202次组卷
|
2卷引用:新疆阿克苏市第四高级中学2023-2024学年高三上学期第二次月考化学试卷
名校
9 . NSR技术是一种汽车尾气处理技术,也称储存还原法,其原理如下图所示。下列说法错误的是
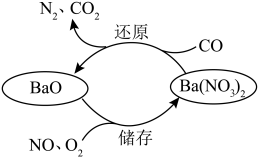

A.“储存”时, 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
| B.“还原”时,氧化剂与还原剂物质的量之比为2︰5 |
C.氧化性: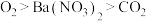 |
D.该技术可将CO、NO转化为 和 和 |
您最近一年使用:0次
2023-07-17更新
|
122次组卷
|
2卷引用:新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题
名校
解题方法
10 . 硫酸铵是一种无机物,化学式为(NH4)2SO4,白色颗粒,无气味,受热易分解。某化学研究小组拟探究其在400℃时的分解产物。实验装置如图所示(部分夹持装置已略去):
(1)仪器a的名称是_______ 。
(2)先关闭止水夹n,打开止水夹m,400℃加热装置C,装置E中品红溶液褪色,证明分解产物中含有_______ (填化学式),品红溶液褪色说明其具有_______ 。然后打开n,关闭m,装置A中的现象是_______ ,说明分解产物有氨气生成,碱石灰的作用是_______ ,400℃加热装置C至(NH4)2SO4完全分解无残留物,停止加热,进一步研究发现,气体产物中有N2生成。
(3)装置D内稀盐酸吸收的气体是_______ (填化学式)。
(4)检验装置 内溶液中有
内溶液中有 、无
、无 的实验操作和现象是
的实验操作和现象是_______ 。
(5)(NH4)2SO4在400℃分解的化学方程式是_______ 。

(1)仪器a的名称是
(2)先关闭止水夹n,打开止水夹m,400℃加热装置C,装置E中品红溶液褪色,证明分解产物中含有
(3)装置D内稀盐酸吸收的气体是
(4)检验装置
 内溶液中有
内溶液中有 、无
、无 的实验操作和现象是
的实验操作和现象是(5)(NH4)2SO4在400℃分解的化学方程式是
您最近一年使用:0次
2023-07-15更新
|
193次组卷
|
4卷引用:新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题
新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题河北省张家口市2022-2023学年高一下学期期末考试化学试题(已下线)猜想03 气体的制取、无机实验探究、无机综合应用(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)重难点02 常见物质的制取与性质探究-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)



