名校
1 . 用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.高温条件下,5.6g铁与足量水蒸气充分反应转移的电子数为0.3NA |
| B.7.1gCl2溶于足量的水充分反应生成HClO分子数目为0.1NA |
| C.标准状况下,22.4L由N2和H2组成的混合气体所含原子数为2NA |
| D.常温下,2.7gAl片与足量稀硫酸充分反应转移电子数为0.2NA |
您最近一年使用:0次
2024-02-16更新
|
233次组卷
|
2卷引用:安徽省灵璧中学名校联考2023-2024学年高一上学期1月阶段性考试化学试题
2 . 微生物法炼铜是在反应釜中加入黄铜矿( ,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是
,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是
 ,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是
,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是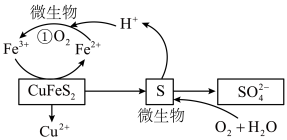
| A.反应釜中保持高温不利于反应进行 |
B.整个转化过程中,可以循环利用的物质有 和 和 |
C.反应①的离子方程式为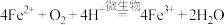 |
D.当黄铜矿中的铁元素全部转化为 时,生成 时,生成 共消耗 共消耗 |
您最近一年使用:0次
2024-02-14更新
|
504次组卷
|
3卷引用:安徽省合肥市第一中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
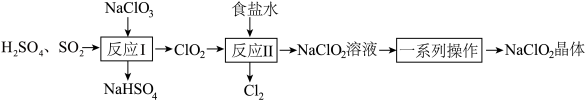
3 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等。已知:饱和NaClO2溶液在温度低于38℃时析出NaCO2•3H2O晶体,温度高于38℃时析出NaClO2晶体,温度高于60℃时,NaClO2分解生成NaClO3和NaCl。其生产工艺如图所示。
(1)NaClO2中氯元素的化合价为___________ 。
(2)“反应I”中氧化剂与还原剂的物质的量之比为___________ 。
(3)“反应Ⅱ”的离子方程式为___________ 。
(4)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和 ,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
(5)“一系列操作”为蒸发浓缩、趁热过滤、___________ 、干燥,其中“趁热过滤”应控制的温度范围是___________ 。
(6)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与 的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为___________ 。
(1)NaClO2中氯元素的化合价为
(2)“反应I”中氧化剂与还原剂的物质的量之比为
(3)“反应Ⅱ”的离子方程式为
(4)“反应”所用“食盐水”由粗盐水精制而成。精制时,为除去粗盐水中的Ca2+、Mg2+和
 ,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)
,需要用到试剂:①NaOH溶液②Na2CO3溶液③BaCl2溶液④稀盐酸,所用试剂的加入顺序正确的是___________。(填标号)| A.①②③④ | B.②①③④ | C.③①②④ | D.③②①④ |
(5)“一系列操作”为蒸发浓缩、趁热过滤、
(6)“反应Ⅱ”产生的Cl2可用于制备含氯消毒剂。将Cl2通入足量NaOH溶液中,加热后得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与
 的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素的物质的量之比为
您最近一年使用:0次
2024-02-11更新
|
588次组卷
|
5卷引用:安徽省六安市叶集皖西当代中学2023-2024学年高一下学期3月月考化学试题
安徽省六安市叶集皖西当代中学2023-2024学年高一下学期3月月考化学试题2024届河南省南阳市方城县第一高级中学高一上学期1月期末模拟预测化学试题湖南省宁乡市第一高级中学2021届高三第三次模拟考试化学试卷(已下线)通关练04 化工微流程-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省长沙市第一中学2023-2024学年高一下学期第一次阶段性检测(月考)化学试题
名校
4 . ClO2是广泛使用的漂白剂、消毒剂。某工厂生产ClO2的反应为: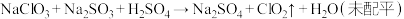
下列有关该反应的说法中,正确的是
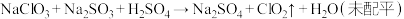
下列有关该反应的说法中,正确的是
| A.反应中Na2SO3是氧化剂 | B.每生成1 mol ClO2转移1 mol电子 |
| C.反应中ClO2是氧化产物 | D.参加反应的NaClO3和Na2SO3的物质的量之比为1∶1 |
您最近一年使用:0次
名校
5 . 现有下列10种物质:
① ②
② 溶液 ③液态
溶液 ③液态 ④
④ ⑤
⑤ ⑥
⑥ 固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩
固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩ 溶液
溶液

(1)上述物质中能导电的有___________ (填序号,下同),属于电解质的有___________ 。
(2)向⑧中逐滴加入③的水溶液,该过程中可观察到的现象为___________ 。
(3)向一定浓度的②中滴加⑩,溶液的电导率随滴入溶液体积变化的曲线如图所示。则ab段发生反应的离子方程式为___________ ,c点溶液中大量存在的离子是___________ 。
(4)⑤与⑥在高温下反应生成一种高效绿色消毒剂高铁酸钠,反应方程式为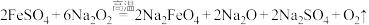 ,若每生成
,若每生成 ,理论上被还原的
,理论上被还原的 的物质的量为
的物质的量为___________ mol。
①
 ②
② 溶液 ③液态
溶液 ③液态 ④
④ ⑤
⑤ ⑥
⑥ 固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩
固体 ⑦纯醋酸 ⑧氢氧化铁胶体 ⑨乙醇 ⑩ 溶液
溶液
(1)上述物质中能导电的有
(2)向⑧中逐滴加入③的水溶液,该过程中可观察到的现象为
(3)向一定浓度的②中滴加⑩,溶液的电导率随滴入溶液体积变化的曲线如图所示。则ab段发生反应的离子方程式为
(4)⑤与⑥在高温下反应生成一种高效绿色消毒剂高铁酸钠,反应方程式为
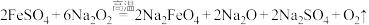 ,若每生成
,若每生成 ,理论上被还原的
,理论上被还原的 的物质的量为
的物质的量为
您最近一年使用:0次
2024-02-07更新
|
124次组卷
|
2卷引用:安徽师范大学附属中学2023-2024学年高一下学期3月阶段性教学质量监测化学试题
6 . “环境就是民生,青山就是美丽、蓝天也是幸福”。回答下列问题:
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是___________ 。
②某团队设计处理流程如下:
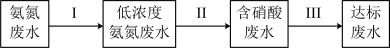
过程Ⅱ为硝化过程,在微生物的作用下实现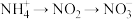 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为___________ ;
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现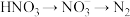 的转化,反应的化学方程式为
的转化,反应的化学方程式为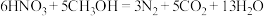 ,氧化产物是
,氧化产物是___________ ,当有1mol硝酸完全转化时,转移的电子数目为___________ 。
(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为___________ 。也可用NaClO2在酸性条件下氧化处理SO2,反应的离子方程式是___________ 。
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
引起雨水pH变化的主要原因是___________ (用化学方程式表示)。
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为___________ 。
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是②某团队设计处理流程如下:

过程Ⅱ为硝化过程,在微生物的作用下实现
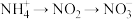 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现
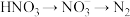 的转化,反应的化学方程式为
的转化,反应的化学方程式为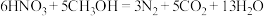 ,氧化产物是
,氧化产物是(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为
您最近一年使用:0次
7 . 亚氯酸钠( )是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊
)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊
(Mathieson)法制备亚氯酸钠的流程如下:
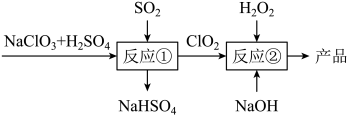
下列说法不正确的是
 )是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊
)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:

下列说法不正确的是
A.反应①中, 只体现酸性 只体现酸性 |
B.反应①中,参加反应的 和 和 的物质的量之比为2∶1 的物质的量之比为2∶1 |
C.反应②中, 可用 可用 代替 代替 |
D.反应②中, 的氧化性大于 的氧化性大于 |
您最近一年使用:0次
名校
8 . 中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成 的原理示意图如图。下列说法不正确的是
的原理示意图如图。下列说法不正确的是

 的原理示意图如图。下列说法不正确的是
的原理示意图如图。下列说法不正确的是
A.该过程可表示为 |
B.该过程中每转移1.2 mol  时,断裂0.6 mol 时,断裂0.6 mol  键 键 |
| C.该过程中,涉及离子键和共价键的断裂与形成 |
D.原料气 可通过分离液态空气获得 可通过分离液态空气获得 |
您最近一年使用:0次
2024-02-04更新
|
58次组卷
|
2卷引用:安徽省安庆市2023-2024学年高一上学期1月期末联考化学试题
名校
解题方法
9 . 下图是自然界中的氮循环过程,下列有关叙述错误的是


| A.反应①、②及工业合成氨均属于氮的固定 |
B.反应③的反应方程式为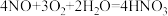 |
C.反应④中,生成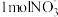 ,至少需要提供 ,至少需要提供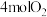 |
| D.过程中参与循环的元素有氮元素,还有氢和氧元素 |
您最近一年使用:0次
2024-02-03更新
|
563次组卷
|
4卷引用:安徽省蚌埠市2023-2024学年高一上学期期末考试化学试题
安徽省蚌埠市2023-2024学年高一上学期期末考试化学试题(已下线)5.2.1氮气和氮的氧化物课后作业提高篇(已下线)5.2.1 氮气和氮的氧化物江西省南昌市第十九中学2023-2024学年高一下学期3月月考化学试题
解题方法
10 . 现有以下物质:ⅰ. 、ⅱ.酒精、ⅲ.
、ⅱ.酒精、ⅲ. 、ⅳ.
、ⅳ. 、ⅴ.
、ⅴ. 溶液、ⅵ.食醋、ⅶ.
溶液、ⅵ.食醋、ⅶ. 、ⅷ.
、ⅷ. 、ⅸ.烧碱溶液、ⅹ.液氯。
、ⅸ.烧碱溶液、ⅹ.液氯。
回答下列问题:
(1)以上物质属于电解质的有_______ (填编号,下同),能导电的有_______ 。
(2)写出物质ⅷ的电离方程式:________ 。
(3)物质ⅴ和物质ⅸ混合后发生反应的离子方程式为________ 。
(4)向 物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入
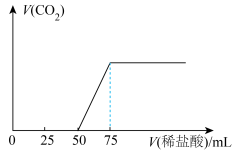
物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是
的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是_______ (填化学式),原 物质ix的浓度为
物质ix的浓度为______ 。
(5)物质ⅳ是一种新型净水剂。制取物质ⅳ时所发生的反应如下: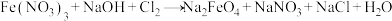
①配平上述反应的化学方程式并用“双线桥”表示电子转移情况:________ 。
②该反应中 是
是________ (填“氧化剂”“还原剂”“氧化产物”或“还原产物”)。
③生成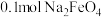 时,转移电子的数自为
时,转移电子的数自为____  (
( 表示阿伏加德罗常数的值),消耗
表示阿伏加德罗常数的值),消耗___ 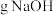 。
。
 、ⅱ.酒精、ⅲ.
、ⅱ.酒精、ⅲ. 、ⅳ.
、ⅳ. 、ⅴ.
、ⅴ. 溶液、ⅵ.食醋、ⅶ.
溶液、ⅵ.食醋、ⅶ. 、ⅷ.
、ⅷ. 、ⅸ.烧碱溶液、ⅹ.液氯。
、ⅸ.烧碱溶液、ⅹ.液氯。回答下列问题:
(1)以上物质属于电解质的有
(2)写出物质ⅷ的电离方程式:
(3)物质ⅴ和物质ⅸ混合后发生反应的离子方程式为
(4)向
 物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入
物质ⅸ中通入一定量的物质ⅲ,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是
的稀盐酸,产生气体体积(标准状况下)与所加稀盐酸体积之间的关系如图所示,通入物质ⅲ后形成溶液的溶质成分是 物质ix的浓度为
物质ix的浓度为
(5)物质ⅳ是一种新型净水剂。制取物质ⅳ时所发生的反应如下:
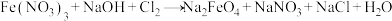
①配平上述反应的化学方程式并用“双线桥”表示电子转移情况:
②该反应中
 是
是③生成
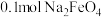 时,转移电子的数自为
时,转移电子的数自为 (
( 表示阿伏加德罗常数的值),消耗
表示阿伏加德罗常数的值),消耗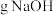 。
。
您最近一年使用:0次
2024-01-30更新
|
58次组卷
|
2卷引用:安徽省阜阳市2023-2024学年高一上学期期末联考化学试卷



