名校
1 . 锰白( )是生产锰盐的初始原料,工业上合成锰白的流程如图所示,下列说法中不正确的是(
)是生产锰盐的初始原料,工业上合成锰白的流程如图所示,下列说法中不正确的是( 是酸性氧化物;
是酸性氧化物; 是两性氧化物,可与强酸、强碱反应)
是两性氧化物,可与强酸、强碱反应)
 )是生产锰盐的初始原料,工业上合成锰白的流程如图所示,下列说法中不正确的是(
)是生产锰盐的初始原料,工业上合成锰白的流程如图所示,下列说法中不正确的是( 是酸性氧化物;
是酸性氧化物; 是两性氧化物,可与强酸、强碱反应)
是两性氧化物,可与强酸、强碱反应)
A.“还原”步骤中氧化剂和还原剂的物质的量之比为 |
B.“沉锰”步骤发生反应为 |
| C.“洗涤”步骤可用盐酸酸化的氯化钡溶液检验锰白是否洗涤干净 |
D.“低温烘干”可避免温度过高导致 分解,提高产率 分解,提高产率 |
您最近一年使用:0次
2024-01-13更新
|
193次组卷
|
5卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
2 . 在“天宫课堂”中航天员王亚平介绍了空间站中的生活,在轨演示了水球变气球等一系列炫酷又好玩的实验。
I.“天宫”中水和氧气最大化利用是保障生活的重要措施。如图是空间站常用资源再利用模拟图。

(1)“水电解系统”中产生氧气发生反应的化学方程式为___________ ,每转移4mol电子,生成的O2在标况下的体积为___________ 。
(2)在水净化系统中,用臭氧(O3)消毒。氧气在放电条件下转化为臭氧的化学方程式为___________ ,该反应___________ (填“是”或“否”)氧化还原反应,原因是___________ 。
(3)一定条件 “萨巴蒂尔反应器”可除去CO2,该反应化学方程式为___________ 。
Ⅱ.王亚平将蓝色颜料注入水球中,整个水球变成蓝色,将泡腾片放入水球中,产生大量气泡向四面八方扩散,充满整个水球。气体并不逸出,使水球越来越大。
(4)泡腾片在水中发生了如下反应:
H3C6H5O7+3NaHCO3=Na3C6H5O7+3CO2↑+3___________ (补全化学方程式)。
I.“天宫”中水和氧气最大化利用是保障生活的重要措施。如图是空间站常用资源再利用模拟图。

(1)“水电解系统”中产生氧气发生反应的化学方程式为
(2)在水净化系统中,用臭氧(O3)消毒。氧气在放电条件下转化为臭氧的化学方程式为
(3)一定条件 “萨巴蒂尔反应器”可除去CO2,该反应化学方程式为
Ⅱ.王亚平将蓝色颜料注入水球中,整个水球变成蓝色,将泡腾片放入水球中,产生大量气泡向四面八方扩散,充满整个水球。气体并不逸出,使水球越来越大。
(4)泡腾片在水中发生了如下反应:
H3C6H5O7+3NaHCO3=Na3C6H5O7+3CO2↑+3
您最近一年使用:0次
2024-01-12更新
|
19次组卷
|
2卷引用:福建省连城县第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
3 . 对于反应SO2+ 2H2S = 3S+ 2H2O中,下列说法正确的是
| A.SO2是氧化剂,在反应中失去电子 |
| B.H2S是还原剂,在反应中得到电子 |
| C.当生成3mol硫时,转移了4mol电子 |
| D.被氧化的硫和被还原的硫的质量比是1:1 |
您最近一年使用:0次
4 . 回答下列问题:
素材Ⅰ.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为: ,结合素材回答问题(1)~(3):
,结合素材回答问题(1)~(3):
(1)该反应中 的摩尔质量是
的摩尔质量是________ 。
(2)28g铁粉中含有的Fe原子数是_______ 。
(3)若28g铁粉完全反应,析出Cu单质的物质的量为_______ 。
素材Ⅱ.宋代《洗冤集录》中记载有“银针探毒”,其原理是: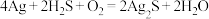 ,结合素材回答问题(4)~(5):
,结合素材回答问题(4)~(5):
(4)在相同条件下体积相同的 和
和 两种气体含有的原子数之比为
两种气体含有的原子数之比为_______ 。
(5)在0℃、101kPa条件下,11.2L氧气完全反应,消耗的 的体积是
的体积是_______ 。
素材Ⅲ.向空气中排放 会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
(6)该雨水中氢离子的浓度
________ 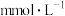 。
。
素材Ⅰ.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:
 ,结合素材回答问题(1)~(3):
,结合素材回答问题(1)~(3):(1)该反应中
 的摩尔质量是
的摩尔质量是(2)28g铁粉中含有的Fe原子数是
(3)若28g铁粉完全反应,析出Cu单质的物质的量为
素材Ⅱ.宋代《洗冤集录》中记载有“银针探毒”,其原理是:
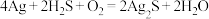 ,结合素材回答问题(4)~(5):
,结合素材回答问题(4)~(5):(4)在相同条件下体积相同的
 和
和 两种气体含有的原子数之比为
两种气体含有的原子数之比为(5)在0℃、101kPa条件下,11.2L氧气完全反应,消耗的
 的体积是
的体积是素材Ⅲ.向空气中排放
 会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:离子 |
|
|
|
|
|
浓度( | 0.06 | 0.08 | 0.02 | 0.04 | a |

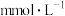 。
。
您最近一年使用:0次
名校
解题方法
5 . Operando光谱和DFT计算明确了在负载 的
的 上
上 选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是
选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是
 的
的 上
上 选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是
选择性催化还原NO的还原氧化半循环的过程如下。下列说法正确的是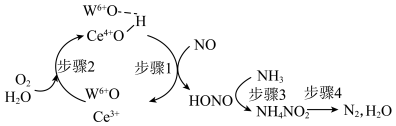
| A.步骤3、4都是氧化还原反应 |
B.步骤2中氧化剂与还原剂的物质的量之比为 |
C.每生成 理论上消耗 理论上消耗 |
D.上述过程的总反应方程式: |
您最近一年使用:0次
2024-01-12更新
|
323次组卷
|
4卷引用:福建省宁德市福古霞三校2024届高三3月份适应性检测化学试题
福建省宁德市福古霞三校2024届高三3月份适应性检测化学试题浙江省宁波市镇海中学2023-2024学年高三上学期首考12月模拟卷化学试题(已下线)压轴题02 氧化还原反应的概念及规律(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
6 . 电子工业常用过量的 FeCl3 溶液腐蚀绝缘板上的铜箔来制造电路板。利用腐蚀废液 可制铁红,过程如图:
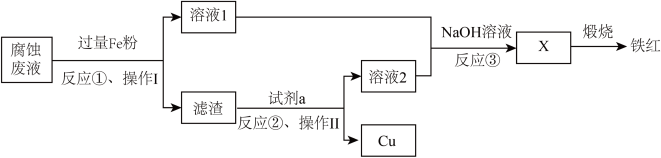
(1)反应①的离子方程式有___________ 。
(2)试剂 a 可以是___________。
(3)操作Ⅱ为___________ 。
(4)检验溶液 1 中是否含有 Fe3+ 的试剂是___________ 。
(5)经检验铁红中有 Fe3O4,取 100 g 产品,用足量稀硫酸溶解,逐滴加入 0.100 mol·L-1高锰酸钾溶液 40.0 mL 至恰好反应完全,反应的离子方程式为___________ , 则 Fe3O4 的物质的量为___________ mol。

(1)反应①的离子方程式有
(2)试剂 a 可以是___________。
| A.HCl | B.H2SO4 | C.KOH 溶液 | D.Na2CO3 溶液 |
(3)操作Ⅱ为
(4)检验溶液 1 中是否含有 Fe3+ 的试剂是
(5)经检验铁红中有 Fe3O4,取 100 g 产品,用足量稀硫酸溶解,逐滴加入 0.100 mol·L-1高锰酸钾溶液 40.0 mL 至恰好反应完全,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . SCR和NSR技术可有效降低柴油发动机在空气过量条件下的 排放。
排放。
(1)SCR(选择性催化还原)工作原理:

①尿素 水溶液热分解为
水溶液热分解为 和
和 ,该反应的化学方程式:
,该反应的化学方程式:__________ 。
②反应器中 还原
还原 的化学方程式:
的化学方程式:__________ 。
③当燃油中含硫量较高时,尾气中 在
在 作用下会形成
作用下会形成 ,使催化剂中毒。用化学方程式表示
,使催化剂中毒。用化学方程式表示 的形成:
的形成:__________ 。
④尿素溶液浓度影响 的转化,测定溶液中尿素
的转化,测定溶液中尿素 含量的方法如下:取a g尿素溶液,将所含氮完全转化为
含量的方法如下:取a g尿素溶液,将所含氮完全转化为 ,所得
,所得 用
用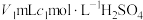 溶液恰好完全吸收,则尿素溶液中溶质的质量分数是
溶液恰好完全吸收,则尿素溶液中溶质的质量分数是__________ 。
(2)NSR( 储存还原)工作原理:
储存还原)工作原理: 的储存和还原在不同时段交替进行,如下图所示。
的储存和还原在不同时段交替进行,如下图所示。

①通过 和
和 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是__________ 。
②用 模拟尾气中还原性气体研究了
模拟尾气中还原性气体研究了 的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。
的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步 反应消耗的 与
与 的物质的量之比是
的物质的量之比是__________ 。
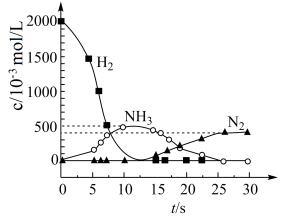
③还原过程中,有时会产生笑气 。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下,
。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下,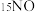 与
与 以一定比例反应时,得到的笑气几乎都是
以一定比例反应时,得到的笑气几乎都是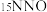 。将该反应的化学方程式补充完整:
。将该反应的化学方程式补充完整:____________________ 

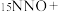


 排放。
排放。(1)SCR(选择性催化还原)工作原理:

①尿素
 水溶液热分解为
水溶液热分解为 和
和 ,该反应的化学方程式:
,该反应的化学方程式:②反应器中
 还原
还原 的化学方程式:
的化学方程式:③当燃油中含硫量较高时,尾气中
 在
在 作用下会形成
作用下会形成 ,使催化剂中毒。用化学方程式表示
,使催化剂中毒。用化学方程式表示 的形成:
的形成:④尿素溶液浓度影响
 的转化,测定溶液中尿素
的转化,测定溶液中尿素 含量的方法如下:取a g尿素溶液,将所含氮完全转化为
含量的方法如下:取a g尿素溶液,将所含氮完全转化为 ,所得
,所得 用
用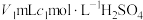 溶液恰好完全吸收,则尿素溶液中溶质的质量分数是
溶液恰好完全吸收,则尿素溶液中溶质的质量分数是(2)NSR(
 储存还原)工作原理:
储存还原)工作原理: 的储存和还原在不同时段交替进行,如下图所示。
的储存和还原在不同时段交替进行,如下图所示。
①通过
 和
和 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是②用
 模拟尾气中还原性气体研究了
模拟尾气中还原性气体研究了 的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。
的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。 与
与 的物质的量之比是
的物质的量之比是
③还原过程中,有时会产生笑气
 。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下,
。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下,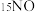 与
与 以一定比例反应时,得到的笑气几乎都是
以一定比例反应时,得到的笑气几乎都是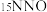 。将该反应的化学方程式补充完整:
。将该反应的化学方程式补充完整:

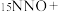


您最近一年使用:0次
名校
8 . 随着科学技术的发展,许多新材料、新技术广泛应用于各个领域。
I.图1是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:
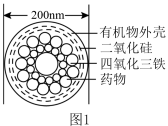
(1)“纳米药物分子车”分散于水中所得的分散系__________ (填“属于”或“不属于”)胶体。
(2)“纳米药物分子车”的外壳属于有机物。①酒精②蔗糖③冰醋酸中这三种有机物中,属于电解质的是__________ (填序号)。
(3)从元素组成的角度分析, 和
和 可归为同一类物质,其类别属于化合物中的
可归为同一类物质,其类别属于化合物中的__________ 。
Ⅱ.无土栽培技术的成功推广,营养液的准确配制是重要环节。某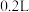 营养液中含有
营养液中含有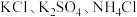 三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中
三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中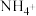 的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
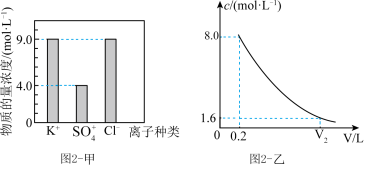
(4)该营养液中 的物质的量浓度为
的物质的量浓度为__________ 。
(5)写出一种与 含相同电子数的分子的化学式
含相同电子数的分子的化学式______________ ;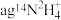 含有的中子的物质的量为
含有的中子的物质的量为__________ 。
Ⅲ.近年来,我国储氢材料的研制取得重大发展。其中电弧法合成储氢碳纳米管时,常伴有大量碳纳米颗粒杂质,这种碳纳米颗粒可用氧化气化法提纯,其反应原理如下:
_____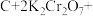 _____
_____ (稀)
(稀) ____
____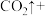 _____
_____ _____
_____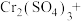 _____
_____
回答下列问题:
(6)完成上述反应的配平_________ 。
(7)某学生欲配制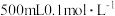 的稀硫酸,用量筒量取需要的浓硫酸,则需量取
的稀硫酸,用量筒量取需要的浓硫酸,则需量取 的浓硫酸
的浓硫酸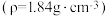 的体积为
的体积为__________ 。
(8)标准状况下,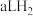 和
和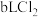 的混合气体,经强光充分照射后,所得气体恰好使含
的混合气体,经强光充分照射后,所得气体恰好使含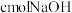 的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是
的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是____________________ 。
I.图1是一种“纳米药物分子运输车”,该技术可提高肿瘤的治疗效果。回答下列问题:

(1)“纳米药物分子车”分散于水中所得的分散系
(2)“纳米药物分子车”的外壳属于有机物。①酒精②蔗糖③冰醋酸中这三种有机物中,属于电解质的是
(3)从元素组成的角度分析,
 和
和 可归为同一类物质,其类别属于化合物中的
可归为同一类物质,其类别属于化合物中的Ⅱ.无土栽培技术的成功推广,营养液的准确配制是重要环节。某
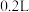 营养液中含有
营养液中含有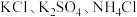 三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中
三种溶质,测得该营养液中部分离子的浓度柱状图如图2-甲所示,稀释过程中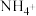 的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
的浓度(c)随溶液体积(V)变化的曲线如图2-乙所示。
(4)该营养液中
 的物质的量浓度为
的物质的量浓度为(5)写出一种与
 含相同电子数的分子的化学式
含相同电子数的分子的化学式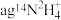 含有的中子的物质的量为
含有的中子的物质的量为Ⅲ.近年来,我国储氢材料的研制取得重大发展。其中电弧法合成储氢碳纳米管时,常伴有大量碳纳米颗粒杂质,这种碳纳米颗粒可用氧化气化法提纯,其反应原理如下:
_____
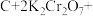 _____
_____ (稀)
(稀) ____
____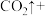 _____
_____ _____
_____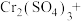 _____
_____
回答下列问题:
(6)完成上述反应的配平
(7)某学生欲配制
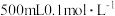 的稀硫酸,用量筒量取需要的浓硫酸,则需量取
的稀硫酸,用量筒量取需要的浓硫酸,则需量取 的浓硫酸
的浓硫酸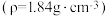 的体积为
的体积为(8)标准状况下,
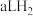 和
和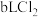 的混合气体,经强光充分照射后,所得气体恰好使含
的混合气体,经强光充分照射后,所得气体恰好使含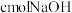 的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是
的氢氧化钠溶液完全转变为盐,则a、b、c应满足的关系是
您最近一年使用:0次
9 . 用 表示阿伏加德罗常数。某容器中发生一个化学反应,反应过程中存在
表示阿伏加德罗常数。某容器中发生一个化学反应,反应过程中存在 六种粒子。在反应过程中测得
六种粒子。在反应过程中测得 和
和 的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是
的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

 表示阿伏加德罗常数。某容器中发生一个化学反应,反应过程中存在
表示阿伏加德罗常数。某容器中发生一个化学反应,反应过程中存在 六种粒子。在反应过程中测得
六种粒子。在反应过程中测得 和
和 的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是
的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是
A.还原剂是含 的物质,氧化产物只有 的物质,氧化产物只有 |
B.氧化剂是 是氧化产物 是氧化产物 |
C.还原性: |
D.常温下,若有 参加反应,则转移 参加反应,则转移 个电子 个电子 |
您最近一年使用:0次
名校
10 . 根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:_____ 。
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是_____ ;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂_____ mol,有_____ mol电子发生转移,相当于测出含钙元素的质量是_____ g。
(1)用单线桥表示下列反应中电子转移方向和数目:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素。测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C2O4+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是
您最近一年使用:0次







