名校
1 . 现有12 mL浓度为0.1 mol·L-1的 溶液恰好与4 mL浓度为0.1 mol·L-1的
溶液恰好与4 mL浓度为0.1 mol·L-1的 溶液完全反应,已知
溶液完全反应,已知 可被
可被 氧化为
氧化为 ,则元素Cr在还原产物中的化合价为
,则元素Cr在还原产物中的化合价为
 溶液恰好与4 mL浓度为0.1 mol·L-1的
溶液恰好与4 mL浓度为0.1 mol·L-1的 溶液完全反应,已知
溶液完全反应,已知 可被
可被 氧化为
氧化为 ,则元素Cr在还原产物中的化合价为
,则元素Cr在还原产物中的化合价为| A.+2 | B.+3 | C.+4 | D.+5 |
您最近一年使用:0次
名校
解题方法
2 . 三氟化氮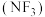 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应: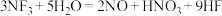 。下列有关说法正确的是
。下列有关说法正确的是
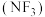 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应: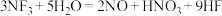 。下列有关说法正确的是
。下列有关说法正确的是A. 是氧化剂, 是氧化剂, 是还原剂 是还原剂 |
B.还原剂与氧化剂的物质的量之比为 |
C.若生成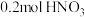 ,则转移 ,则转移 电子 电子 |
D. 在潮湿的空气中泄漏会产生白雾 在潮湿的空气中泄漏会产生白雾 |
您最近一年使用:0次
3 . Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图是硫元素的价类二维图,回答下列问题:

(1) 为
为______ (填物质的类别); 的化学式为
的化学式为______ ;
(2)某同学欲选用如图的部分装置和药品探究: 的性质。
的性质。
上述装置中能体现 具有氧化性的化学反应方程式为
具有氧化性的化学反应方程式为______________________________________ 。
(3)下图是工业上用黄铁矿(主要成分 )为原料制取绿矾(
)为原料制取绿矾(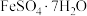 )的工艺流程,已知炉渣的主要成分是
)的工艺流程,已知炉渣的主要成分是 。请写出沸腾炉中发生的化学方程式:
。请写出沸腾炉中发生的化学方程式:______ 以及反应室中发生的化学方程式:______ ;实验小组在实验室模拟该工艺流程,用75g的黄铁矿制备出了139g绿矾,黄铁矿中 的质量分数约为
的质量分数约为______ 。

Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(4)二氧化氯是一种高效消毒剂。工业制备 的反应为:
的反应为:
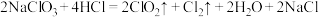
①氧化性:
______ (填“>”或“<”) 。
。
② 和
和 是常见的消毒剂,且还原产物均为
是常见的消毒剂,且还原产物均为 。现将二者的混合气体用足量的
。现将二者的混合气体用足量的 溶液吸收后得到1L的吸收液,并取10mL吸收液检验出
溶液吸收后得到1L的吸收液,并取10mL吸收液检验出 浓度为
浓度为 、
、 的浓度为
的浓度为 ,则原混合气体的物质的量为
,则原混合气体的物质的量为______ 。
(5)将下述氧化还原反应配平___________
______ +______
+______ +______
+______
 ______
______ +______
+______ +______
+______

(1)
 为
为 的化学式为
的化学式为(2)某同学欲选用如图的部分装置和药品探究:
 的性质。
的性质。
|
|
|
|
|
A | B | C | D | E |
 具有氧化性的化学反应方程式为
具有氧化性的化学反应方程式为(3)下图是工业上用黄铁矿(主要成分
 )为原料制取绿矾(
)为原料制取绿矾(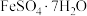 )的工艺流程,已知炉渣的主要成分是
)的工艺流程,已知炉渣的主要成分是 。请写出沸腾炉中发生的化学方程式:
。请写出沸腾炉中发生的化学方程式: 的质量分数约为
的质量分数约为
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(4)二氧化氯是一种高效消毒剂。工业制备
 的反应为:
的反应为: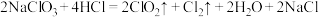
①氧化性:

 。
。②
 和
和 是常见的消毒剂,且还原产物均为
是常见的消毒剂,且还原产物均为 。现将二者的混合气体用足量的
。现将二者的混合气体用足量的 溶液吸收后得到1L的吸收液,并取10mL吸收液检验出
溶液吸收后得到1L的吸收液,并取10mL吸收液检验出 浓度为
浓度为 、
、 的浓度为
的浓度为 ,则原混合气体的物质的量为
,则原混合气体的物质的量为(5)将下述氧化还原反应配平
______
 +______
+______ +______
+______
 ______
______ +______
+______ +______
+______
您最近一年使用:0次
名校
解题方法
4 . 认识和利用SO2的性质可有效防治SO2对环境的污染,并实现SO2的综合利用。某研究团队提出的SO2烟气脱硫工艺流程如图,该流程中脱硫剂反复循环,可实现对烟气中SO2的持续脱除。已知:脱硫塔中发生的主要反应为2CaS+3SO2=2CaSO3+3S、2CaSO3+O2=2CaSO4。下列有关说法错误的是


| A.脱硫塔中生成的S既是氧化产物又是还原产物 |
| B.再生塔中生成CO2和X的比例为1:1 |
| C.将CaSO4和煤粉碎混合,再投入再生塔有利反应充分进行 |
| D.经冷凝器得到的几种单质(S2、S4、S6和S8)互为同素异形体 |
您最近一年使用:0次
2024-01-24更新
|
129次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高一上学期12月月考化学试卷
名校
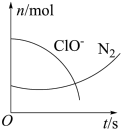
5 . 某离子反应中涉及 、
、 、
、 、
、 、
、 、
、 六种微粒,其中
六种微粒,其中 和
和 的物质的量随时间变化的曲线如图所示,下列判断不正确的是
的物质的量随时间变化的曲线如图所示,下列判断不正确的是
 、
、 、
、 、
、 、
、 、
、 六种微粒,其中
六种微粒,其中 和
和 的物质的量随时间变化的曲线如图所示,下列判断不正确的是
的物质的量随时间变化的曲线如图所示,下列判断不正确的是
A.该反应的氧化产物 ,还原产物是 ,还原产物是 |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为3∶2 |
D.当生成14 g  时,消耗的 时,消耗的 为1.5 mol 为1.5 mol |
您最近一年使用:0次
2024-01-21更新
|
91次组卷
|
2卷引用:福建省南平市浦城第一中学2023-2024学年高一上学期期中考试化学试卷
名校
解题方法
6 . 下图是自然界中不同价态硫元素之间的转化关系图,按要求回答问题:

(1)写出图中两种物质混合生成S,且S既是氧化产物又是还原产物的化学方程式___________ 。
(2)工业生产硫酸的方法之一是:
① ,配平该反应方程式;
,配平该反应方程式;________
②___________ ,写出该反应的方程式;
③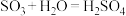 。
。
(3) 可用于焊接钢轨,写出该反应的化学方程式
可用于焊接钢轨,写出该反应的化学方程式___________ 。
(4)硫酸是重要的化工原料,写出加热时铜和浓硫酸反应的化学方程式:___________ ,生成标准状况下22.4L的还原性气体,转移的电子数为___________ 。

(1)写出图中两种物质混合生成S,且S既是氧化产物又是还原产物的化学方程式
(2)工业生产硫酸的方法之一是:
①
 ,配平该反应方程式;
,配平该反应方程式;②
③
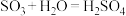 。
。(3)
 可用于焊接钢轨,写出该反应的化学方程式
可用于焊接钢轨,写出该反应的化学方程式(4)硫酸是重要的化工原料,写出加热时铜和浓硫酸反应的化学方程式:
您最近一年使用:0次
名校
7 . 按要求填空:
(1)①将 溶液蒸干灼烧得到的物质是
溶液蒸干灼烧得到的物质是___________ (填化学式);
②泡沫灭火器常用硫酸铝作为原料之一,其灭火原理为___________ (用离子方程式表示);
③在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式___________ 。
(2)已知25℃时有关弱酸的电离常数如下:
HCN: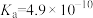 ,
, :
: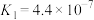 ,
, ,则:
,则:
①同物质的量浓度的 、
、 、NaCN溶液,pH
、NaCN溶液,pH由小到大 的顺序是:___________ 。
②少量CO2通入足量NaCN溶液中,反应的离子方程式为___________ 。
(3)含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含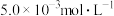 的
的 。为了使废水的排放达标,进行如下处理:(已知
。为了使废水的排放达标,进行如下处理:(已知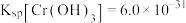 )
)

①绿矾为 ,反应(Ⅰ)中氧化剂与还原剂的物质的量之比为
,反应(Ⅰ)中氧化剂与还原剂的物质的量之比为___________ ;
②常温下若处理后的废水中 ,则处理后的废水的
,则处理后的废水的
___________ 。
(1)①将
 溶液蒸干灼烧得到的物质是
溶液蒸干灼烧得到的物质是②泡沫灭火器常用硫酸铝作为原料之一,其灭火原理为
③在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式
(2)已知25℃时有关弱酸的电离常数如下:
HCN:
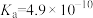 ,
, :
: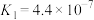 ,
, ,则:
,则:①同物质的量浓度的
 、
、 、NaCN溶液,pH
、NaCN溶液,pH②少量CO2通入足量NaCN溶液中,反应的离子方程式为
(3)含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含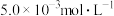 的
的 。为了使废水的排放达标,进行如下处理:(已知
。为了使废水的排放达标,进行如下处理:(已知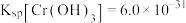 )
)
①绿矾为
 ,反应(Ⅰ)中氧化剂与还原剂的物质的量之比为
,反应(Ⅰ)中氧化剂与还原剂的物质的量之比为②常温下若处理后的废水中
 ,则处理后的废水的
,则处理后的废水的
您最近一年使用:0次
名校
解题方法
8 . 向100ml0.2 mol/l Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量
| A.1.44g | B.1.6g | C.2.82g | D.4.36g |
您最近一年使用:0次
名校
9 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。
(1)某同学购买了一瓶“威露士”牌“84"消毒液,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
①该“84”消毒液的物质的量浓度约为___________ (保留小数点后一位)。
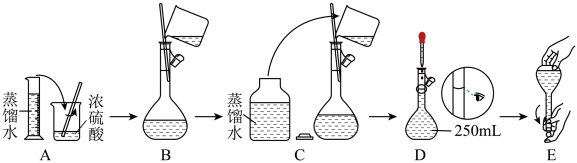
②某消毒小组人员用98%、浓度为18.4mol/L的浓硫酸配制250mL 的稀硫酸用于增强“84”消毒液的消毒能力,需用量筒量取体积为
的稀硫酸用于增强“84”消毒液的消毒能力,需用量筒量取体积为___________ mL的浓硫酸来稀释。在下列配制250mL 的稀硫酸过程示意图中,错误的是
的稀硫酸过程示意图中,错误的是___________ (填选项字母)。
对所配制的稀硫酸进行标定,发现其浓度小于 ,引起误差的原因可能为
,引起误差的原因可能为___________ (填选项字母)。
A.定容时,俯视刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.容量瓶在使用前未干燥,里面有少量蒸馏水
D.定容摇匀后,发现液面低于容量瓶的刻度线,再加水至刻度线
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:NaClO+2HCl=NaCl+Cl2↑+H2O。
①该反应中起氧化作用的物质是___________ (填化学式)。
②若反应中生成了0.01 mol ,转移电子的物质的量为
,转移电子的物质的量为___________ mol。
(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ、在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ、在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色
实验Ⅰ、Ⅱ现象不同的原因是为___________ 。
(1)某同学购买了一瓶“威露士”牌“84"消毒液,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
| 资料:人们常用“84”消毒液进行消毒。“84”消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。“84”消毒液呈无色或淡黄色,可由Cl2与NaOH溶液反应制得,其主要成分为NaClO、NaCl。 |
| “84”消毒液 有效成分:NaClO (NaClO的摩尔质量74.5g·mol-1) 规格:1000mL 质量分数:25% 密度: 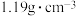 |
②某消毒小组人员用98%、浓度为18.4mol/L的浓硫酸配制250mL
 的稀硫酸用于增强“84”消毒液的消毒能力,需用量筒量取体积为
的稀硫酸用于增强“84”消毒液的消毒能力,需用量筒量取体积为 的稀硫酸过程示意图中,错误的是
的稀硫酸过程示意图中,错误的是
对所配制的稀硫酸进行标定,发现其浓度小于
 ,引起误差的原因可能为
,引起误差的原因可能为A.定容时,俯视刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.容量瓶在使用前未干燥,里面有少量蒸馏水
D.定容摇匀后,发现液面低于容量瓶的刻度线,再加水至刻度线
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:NaClO+2HCl=NaCl+Cl2↑+H2O。
①该反应中起氧化作用的物质是
②若反应中生成了0.01 mol
 ,转移电子的物质的量为
,转移电子的物质的量为(3)某同学设计实验探究84消毒液的漂白性。
Ⅰ、在2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ、在2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色
实验Ⅰ、Ⅱ现象不同的原因是为
您最近一年使用:0次
10 . 铋酸钠( )是一种可测定锰的强氧化剂。由辉铋矿(主要成分为
)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
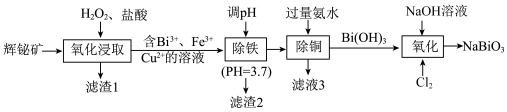
已知:① 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。
②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的 如表:
如表:
回答下列问题:
(1)基态 的
的 电子轨道表示式为
电子轨道表示式为____________ 。“滤渣1”的主要成分为_____________ (填化学式)。
(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是____________ , 发生反应的化学方程式为
发生反应的化学方程式为____________ 。
(3)已知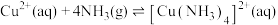 ,
, 中配体的空间结构为
中配体的空间结构为_____________ ,键角:
______  (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是_____________ 。
(4)“氧化”过程发生反应的离子方程式为____________ 。
(5)取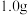 制得的
制得的 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应:
稀溶液,发生反应: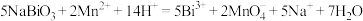 ,完全反应后再用
,完全反应后再用 的
的 标准溶液滴定生成的
标准溶液滴定生成的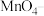 ,当溶液紫红色恰好褪去时,消耗
,当溶液紫红色恰好褪去时,消耗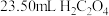 标准溶液,则产品的纯度为
标准溶液,则产品的纯度为___________________ %。
(6)我国科学家对新型二维半导体芯片材料——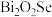 的研究取得了突破性进展。
的研究取得了突破性进展。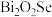 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为
),已知晶胞为竖直的长方体,高为 ,晶体密度为
,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长
为阿伏加德罗常数的值,则晶胞底边边长
_______________ (填含 、
、 、
、 的计算式,不必化简)。
的计算式,不必化简)。

 )是一种可测定锰的强氧化剂。由辉铋矿(主要成分为
)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下:
的工艺流程如下:
已知:①
 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的
 如表:
如表:| 金属离子 |  |  |  |  |
开始沉淀的 | 7.6 | 2.7 | 4.8 | 4.5 |
沉淀完全的 | 9.6 | 3.7 | 6.4 | 5.5 |
(1)基态
 的
的 电子轨道表示式为
电子轨道表示式为(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是
 发生反应的化学方程式为
发生反应的化学方程式为(3)已知
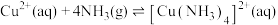 ,
, 中配体的空间结构为
中配体的空间结构为
 (填“>”、“<”或“=”),原因是
(填“>”、“<”或“=”),原因是(4)“氧化”过程发生反应的离子方程式为
(5)取
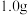 制得的
制得的 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应:
稀溶液,发生反应: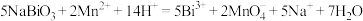 ,完全反应后再用
,完全反应后再用 的
的 标准溶液滴定生成的
标准溶液滴定生成的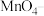 ,当溶液紫红色恰好褪去时,消耗
,当溶液紫红色恰好褪去时,消耗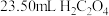 标准溶液,则产品的纯度为
标准溶液,则产品的纯度为(6)我国科学家对新型二维半导体芯片材料——
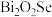 的研究取得了突破性进展。
的研究取得了突破性进展。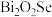 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为
),已知晶胞为竖直的长方体,高为 ,晶体密度为
,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长
为阿伏加德罗常数的值,则晶胞底边边长
 、
、 、
、 的计算式,不必化简)。
的计算式,不必化简)。
您最近一年使用:0次