解题方法
1 . 小组同学探究 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。
实验:向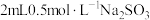 溶液中加入
溶液中加入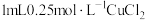 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。
已知:i.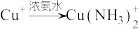 (无色)
(无色)
ii.
(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是 ,试剂
,试剂 是
是______ 。
②无色溶液在空气中放置变为深蓝色,反应的离子方程式为______ 。
(2)经检验,沉淀 不含
不含 。推测沉淀
。推测沉淀 能转化为沉淀
能转化为沉淀 与
与 有关,为研究沉淀
有关,为研究沉淀 的成分及沉淀
的成分及沉淀 转化为
转化为 的原因,实验如下。
的原因,实验如下。 中含有
中含有 ,补充实验:向少量洗净的沉淀
,补充实验:向少量洗净的沉淀 中加入稀硫酸,证实沉淀
中加入稀硫酸,证实沉淀 中含有
中含有 的现象是
的现象是______ 。
②无色溶液中含有 ,推测
,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验过程中 氧化
氧化 ;
;
途径2:______ (将途径补充完整)。
经研究,途径1不合理,途径2合理。
③解释 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:______ 。
(3) 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是______ 。
用 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
(4)根据上述实验得出 和
和 反应的结论:
反应的结论:______ 。(任答一点)
 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。实验:向
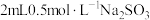 溶液中加入
溶液中加入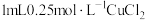 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。已知:i.
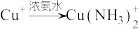 (无色)
(无色)ii.

(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是
 ,试剂
,试剂 是
是②无色溶液在空气中放置变为深蓝色,反应的离子方程式为
(2)经检验,沉淀
 不含
不含 。推测沉淀
。推测沉淀 能转化为沉淀
能转化为沉淀 与
与 有关,为研究沉淀
有关,为研究沉淀 的成分及沉淀
的成分及沉淀 转化为
转化为 的原因,实验如下。
的原因,实验如下。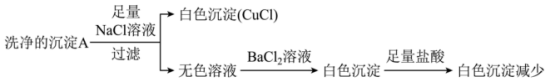
 中含有
中含有 ,补充实验:向少量洗净的沉淀
,补充实验:向少量洗净的沉淀 中加入稀硫酸,证实沉淀
中加入稀硫酸,证实沉淀 中含有
中含有 的现象是
的现象是②无色溶液中含有
 ,推测
,推测 的产生有两个途径:
的产生有两个途径:途径1:实验过程中
 氧化
氧化 ;
;途径2:
经研究,途径1不合理,途径2合理。
③解释
 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:(3)
 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是用
 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。(4)根据上述实验得出
 和
和 反应的结论:
反应的结论:
您最近一年使用:0次
名校
2 . 钛白粉(纳米级)广泛应用于功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料。具有优良的遮盖力和着色牢度,适用于不透明的白色制品。其制备原料钛铁矿( )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: 形式存在;
形式存在;
②强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;
③ 不溶于水和稀酸。
不溶于水和稀酸。
(1)要提高酸浸速率,可采取的措施是________ (写出一条即可)。
(2)滤渣①中除铁粉外,还可能含有的成分是________ 。
(3)酸浸过程中, 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。
①在其他条件不变的情况下,体系中Fe(III)[指 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以________ (填微粒化学式,已知pH>3时近似认为 沉淀完全)形式存在。
沉淀完全)形式存在。________ 。________ 。在实验室中,滤渣③一般在________ (填仪器名称)中灼烧。
 )中往往含有
)中往往含有 、MgO、CaO、
、MgO、CaO、 、
、 等杂质。一种硫酸法制取白色颜料钛白粉(
等杂质。一种硫酸法制取白色颜料钛白粉( )的生产工艺如图:
)的生产工艺如图: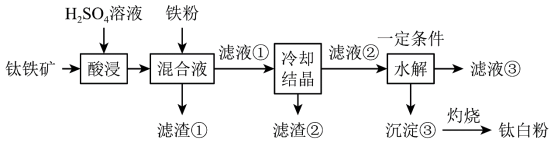
 形式存在;
形式存在;②强电解质
 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子;
和一种阳离子;③
 不溶于水和稀酸。
不溶于水和稀酸。(1)要提高酸浸速率,可采取的措施是
(2)滤渣①中除铁粉外,还可能含有的成分是
(3)酸浸过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(4)加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做了如下尝试。
。为探究最佳反应条件,某实验室做了如下尝试。①在其他条件不变的情况下,体系中Fe(III)[指
 和
和 等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以
等含正三价铁元素的微粒]含量随pH变化如图,试分析,在pH介于4~6之间时,Fe(III)主要以 沉淀完全)形式存在。
沉淀完全)形式存在。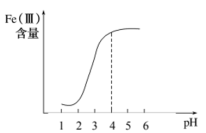
您最近一年使用:0次
名校
解题方法
3 . 绿矾(FeSO4⋅7H2O))是一种重要的药物,也是一种工业原料。一种以黄铜矿(主要成分是CuFeS2,含SiO2、Al2O3等杂质)为原料制备绿矾的流程如图:
(1)“焙烧”时,需将黄铜矿粉碎,其目的是_______ ;高温“焙烧”过程中生成了三种氧化物,其化学方程式是_______ 。
(2)滤渣1的主要成分为_______ (填化学式,下同);滤渣2的主要成分为_______ 。
(3)“一系列操作”为:_______ 、_______ 、过滤、洗涤、干燥。
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为_______ 。
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中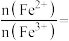
_______ 。
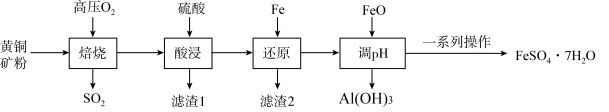
(1)“焙烧”时,需将黄铜矿粉碎,其目的是
(2)滤渣1的主要成分为
(3)“一系列操作”为:
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中
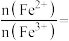
您最近一年使用:0次
解题方法
4 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。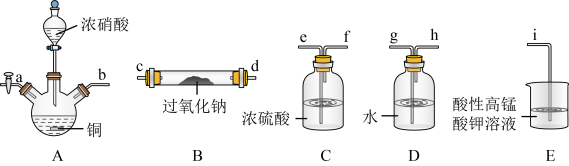
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近一年使用:0次
名校
解题方法
5 . 氮氧化物(NO、 )、
)、 是大气污染物,但在生活、生产中又有着广泛应用。
是大气污染物,但在生活、生产中又有着广泛应用。
Ⅰ.如图所示是酸雨的形成示意图。_______ (用化学方程式表示)。
(2)你认为减少酸雨的产生可采取的措施是_______(填字母)。
①减少用煤作燃料②开发新能源③化石燃料脱硫④在已酸化的土壤中洒石灰⑤监测并治理汽车排出的大量尾气⑥收集大气中氮氧化物制备硝酸
Ⅱ.某学习小组在实验室中利用下图装置制备 并进行相关性质的探究。
并进行相关性质的探究。_______ ;装置A中反应的化学方程式为_______ 。
(4)装置B是为了观察气体的流速,则试剂M为_______(填字母)。
(5)装置E中出现_______ (填现象)可说明 具有还原性。
具有还原性。
(6)装置F中过量的NaOH溶液吸收尾气发生的离子方程式为_______ 。
(7)装置C中反应的离子方程式是_______ ,甲同学设计了以下三个方案用于证实此反应中 具有还原性,你认为方案正确的是
具有还原性,你认为方案正确的是_______ 。
a.反应后溶液由黄色变为浅绿色
b.取反应后的少许溶液于试管中,加入 溶液,产生白色沉淀
溶液,产生白色沉淀
c.取反应后的少许溶液于试管中,加入 溶液,产生白色沉淀
溶液,产生白色沉淀
乙同学查阅资料发现反应分为两步:
第一步: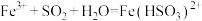 (棕红色)
(棕红色)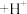 (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
由此乙同学预测实验现象是_______ 。
(8)实验开始后,发现装置D中的溶液迅速变黄,继续通入 ,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: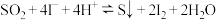 。有同学认为除
。有同学认为除 的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(
的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证( 体积已折算为标准状况下体积)。
体积已折算为标准状况下体积)。
限选试剂:0.1mol/LKI溶液、1.0mol/LKI溶液、2.0mol/LKI溶液、蒸馏水、浓硝酸、浓盐酸
Ⅲ.电化学法处理 是目前研究的热点。利用过氧化氢吸收
是目前研究的热点。利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示(质子即
污染,设计装置如图所示(质子即 )。
)。_______ (填“正极”或“负极”)。
(10)石墨2的电极反应式为_______ 。
(11)若22.4L(标准状况) 参与反应,则迁移
参与反应,则迁移 的物质的量为
的物质的量为_______ mol。
Ⅳ.
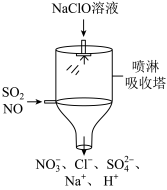
(12)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。其中,脱硝(NO)反应的离子方程式为_______ 。
 )、
)、 是大气污染物,但在生活、生产中又有着广泛应用。
是大气污染物,但在生活、生产中又有着广泛应用。Ⅰ.如图所示是酸雨的形成示意图。

| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.75 | 4.60 | 4.58 | 4.50 | 4.50 |
(2)你认为减少酸雨的产生可采取的措施是_______(填字母)。
①减少用煤作燃料②开发新能源③化石燃料脱硫④在已酸化的土壤中洒石灰⑤监测并治理汽车排出的大量尾气⑥收集大气中氮氧化物制备硝酸
| A.①②③④⑤⑥ | B.①②③⑤ | C.①②③④⑤ | D.②③⑤⑥ |
Ⅱ.某学习小组在实验室中利用下图装置制备
 并进行相关性质的探究。
并进行相关性质的探究。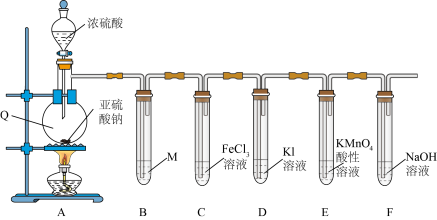
(4)装置B是为了观察气体的流速,则试剂M为_______(填字母)。
| A.NaOH溶液 | B.饱和 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
(5)装置E中出现
 具有还原性。
具有还原性。(6)装置F中过量的NaOH溶液吸收尾气发生的离子方程式为
(7)装置C中反应的离子方程式是
 具有还原性,你认为方案正确的是
具有还原性,你认为方案正确的是a.反应后溶液由黄色变为浅绿色
b.取反应后的少许溶液于试管中,加入
 溶液,产生白色沉淀
溶液,产生白色沉淀c.取反应后的少许溶液于试管中,加入
 溶液,产生白色沉淀
溶液,产生白色沉淀乙同学查阅资料发现反应分为两步:
第一步:
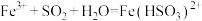 (棕红色)
(棕红色)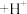 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)由此乙同学预测实验现象是
(8)实验开始后,发现装置D中的溶液迅速变黄,继续通入
 ,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应:
,装置D中出现乳黄色浑浊。该小组同学查阅资料得知,存在可逆反应: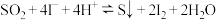 。有同学认为除
。有同学认为除 的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证(
的浓度外,其他离子的浓度对该可逆反应也有影响。完成实验设计进行验证( 体积已折算为标准状况下体积)。
体积已折算为标准状况下体积)。限选试剂:0.1mol/LKI溶液、1.0mol/LKI溶液、2.0mol/LKI溶液、蒸馏水、浓硝酸、浓盐酸
| 影响因素 | 编号 | 操作 | 现象 |
 | i | 取50mL | 溶液变为浅黄色 |
| ii | 取50mL1.0mo1/LKI溶液于锥形瓶中,向其中通入20mL | 溶液迅速变黄 | |
 | iii | 取50mL1.0mol/LKI溶液和 | 溶液迅速变黄 |
| iv | 取50mL1.0mol/LKI溶液和5mL | 溶液迅速变黄且出现乳黄色浑浊 |
Ⅲ.电化学法处理
 是目前研究的热点。利用过氧化氢吸收
是目前研究的热点。利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示(质子即
污染,设计装置如图所示(质子即 )。
)。
(10)石墨2的电极反应式为
(11)若22.4L(标准状况)
 参与反应,则迁移
参与反应,则迁移 的物质的量为
的物质的量为Ⅳ.
(12)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。其中,脱硝(NO)反应的离子方程式为
您最近一年使用:0次
名校
解题方法
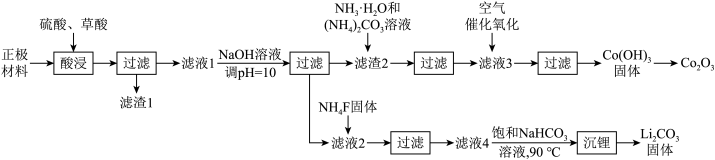
6 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3.工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积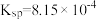 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为___________ ;基态Co原子的价层电子表示式为___________ 。
(2)“酸浸”时发生反应: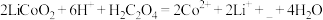 ,补充完整上述离子方程式
,补充完整上述离子方程式___________ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中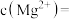
___________ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为___________ 。
(5)沉锂操作过程中的存在反应: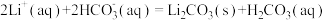 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是___________ 。
(6)由 进一步制得的
进一步制得的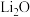 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞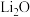 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ pm。
 如下表:
如下表:| 物质 |  |  |  |  |
 | 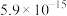 | 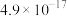 | 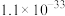 | 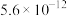 |
 的溶度积
的溶度积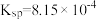 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
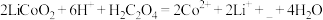 ,补充完整上述离子方程式
,补充完整上述离子方程式(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中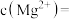
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
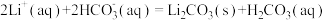 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。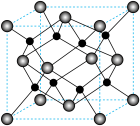
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
您最近一年使用:0次
解题方法
7 . 为回收利用废钒催化剂(含有V2O5、VOSO4、SiO2、Fe3O4以及钾和铝的硅酸盐),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
ii.VOSO4可溶、(VO2)2SO4易溶、V2O5和NH4VO3难溶; +2OH-=
+2OH-= +H2O
+H2O
(1)“酸浸氧化”时,VO2+转化成 反应的离子方程式为
反应的离子方程式为______ ,同时V2O5转化为 。滤渣①主要成分是
。滤渣①主要成分是______ 。
(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有______ 。
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式______ 。
(4)“调pH”中滤渣④的主要成分是______ 。
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。______ 。
②放电过程中,右槽溶液颜色变化的情况是______ 。
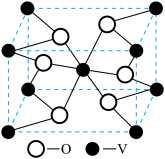
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为______ 。若该晶胞的密度为ρg/cm3,且用NA表示阿伏加德罗常数,则该晶胞的边长为______ nm。
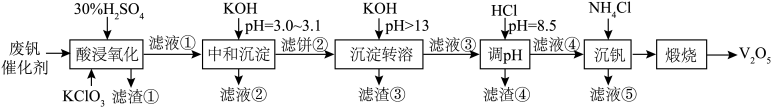
| 金属离子 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
 +2OH-=
+2OH-= +H2O
+H2O(1)“酸浸氧化”时,VO2+转化成
 反应的离子方程式为
反应的离子方程式为 。滤渣①主要成分是
。滤渣①主要成分是(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式
(4)“调pH”中滤渣④的主要成分是
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。
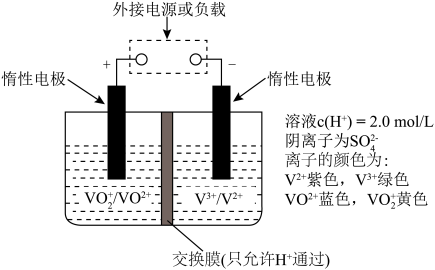
②放电过程中,右槽溶液颜色变化的情况是
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为
您最近一年使用:0次
8 . 某中学研究性学习小组的以黄铁矿 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程:
(1)在空气中焙烧黄铁矿的化学方程式为:__________________________ 。
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示( )。
)。__________ 。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式_____________________ 。检验反应Ⅱ所得的滤液中所含阴离子的方法是____________________________ 。
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得 的操作为:
的操作为:__________ 、__________ 、过滤、洗涤、干燥。
(5)反应①反应方程式是______________ 。从反应①至④制取高纯多晶硅的过程中可以循环利用的物质有____________________ 。
 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程: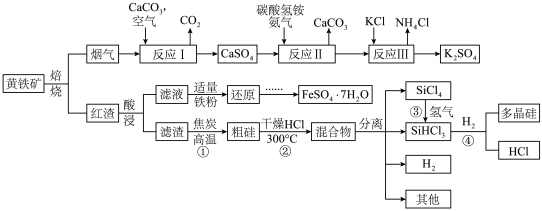
(1)在空气中焙烧黄铁矿的化学方程式为:
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示(
 )。
)。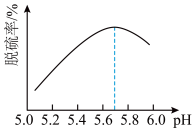
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得
 的操作为:
的操作为:(5)反应①反应方程式是
您最近一年使用:0次
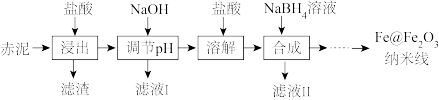
9 . Fe@Fe2O3纳米线是一种新型铁基材料,在催化、生物医药、环境科学等领域具有广阔应用前景。某研究小组以赤泥(铝土矿提取氧化铝过程中产生的固体废弃物,含SiO2、Fe2O3、Al2O3)为原料,设计下列流程制备Fe@Fe2O3纳米线并探究其在水处理中的应用。
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:___________ 。
②盐酸起始浓度为2 mol·L-1时,铁的浸出率很低,原因是___________ 。
(2)铁的晶胞如图所示,若该晶体的密度是a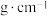 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为___________ cm(设NA为阿伏加德罗常数的值)。 AlO
AlO + H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为
+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为___________ (设调节pH过程中溶液体积不变)。
(4)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液II中含B(OH)3,合成铁核的离子方程式为___________ 。
②“合成”后,经过滤、___________ 、___________ 获得Fe@Fe2O3纳米线。
(1)“浸出”实验中,盐酸起始浓度对铁、铝浸出率的影响如图所示:
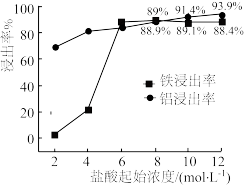
②盐酸起始浓度为2 mol·L-1时,铁的浸出率很低,原因是
(2)铁的晶胞如图所示,若该晶体的密度是a
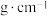 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为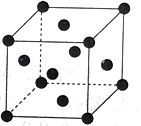
 AlO
AlO + H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为
+ H+ + H2O K=4×10-13。若浸出液c(Al3+) = 0.04 mol·L-1,“调节pH”时,pH最小应为(4)Fe@Fe2O3纳米线为壳层结构(核是Fe、壳是Fe2O3),壳是由中心铁核在合成过程中被氧化而形成。
①“合成”时滴加NaBH4溶液过程中伴有气泡产生,滤液II中含B(OH)3,合成铁核的离子方程式为
②“合成”后,经过滤、
您最近一年使用:0次
名校
解题方法
10 . 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。回答下列问题:___________ ;B中圆底烧瓶收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”)。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气极易溶于水且水溶液显___________ 性。
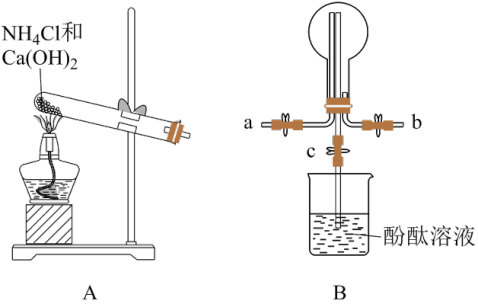
(3)将前面收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子 、
、 夹好)。
夹好)。___________ 。
(4)NO2与水反应的化学方程式___________ ,其中氧化剂与还原剂的物质的量之比是___________ 。
(5)久置的浓HNO3呈黄色的原因是?用化学方程式解释___________ 。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气极易溶于水且水溶液显
(3)将前面收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子
 、
、 夹好)。
夹好)。
(4)NO2与水反应的化学方程式
(5)久置的浓HNO3呈黄色的原因是?用化学方程式解释
您最近一年使用:0次



