名校
解题方法
1 . 在催化剂作用下, 氧化HCl可发生:
氧化HCl可发生:
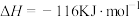 。海带可用于提取碘,
。海带可用于提取碘, 与
与 发生反应:
发生反应: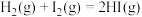
 。下列说法正确的是
。下列说法正确的是
 氧化HCl可发生:
氧化HCl可发生:
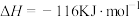 。海带可用于提取碘,
。海带可用于提取碘, 与
与 发生反应:
发生反应: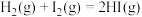
 。下列说法正确的是
。下列说法正确的是A. ( ( 表示键能) 表示键能) |
B.体系中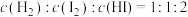 ,说明该反应达到平衡状态 ,说明该反应达到平衡状态 |
| C.增大压强,正、逆反应速率均不变 |
D.反应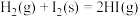 的 的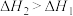 |
您最近一年使用:0次
名校
2 . 下列图示与对应的叙述相符的是
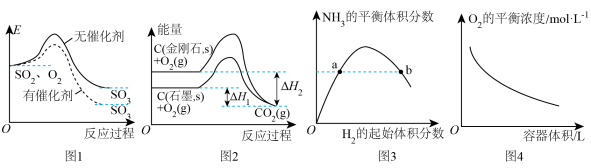

A.图1表示 分别在有、无催化剂的情况下氧化反应过程中的能量变化 分别在有、无催化剂的情况下氧化反应过程中的能量变化 |
B.由图2可知,反应C(金刚石,s)=C(石墨,s)的焓变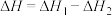 |
C.图3表示一定条件下的合成氨反应中, 的平衡体积分数随 的平衡体积分数随 的起始体积分数( 的起始体积分数( 的起始量恒定)的变化,图中a点 的起始量恒定)的变化,图中a点 的转化率小于b点 的转化率小于b点 |
D.图4表示同一温度下,在不同容积的容器中进行反应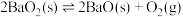 , , 的平衡浓度与容器容积的关系 的平衡浓度与容器容积的关系 |
您最近一年使用:0次
2023-10-14更新
|
135次组卷
|
2卷引用:江苏省常州高级中学2023~2024 学年高二上学期10月阶段检测化学试题
解题方法
3 . CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
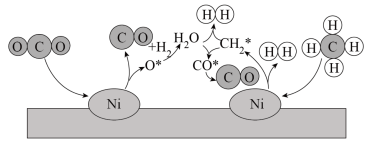
(1)1991年,Ashcroft提出了甲烷二氧化碳重整的技术理论:气体分子吸附至催化剂表面后发生反应。500℃时,反应原理如下。
主反应:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH
副反应:
Ⅰ.H2(g)+CO2(g)=CO(g)+H2O(g) ΔH1=41.2kJ/mol
Ⅱ.2CO(g)=CO2(g)+C(s) ΔH2=-172.5kJ/mol
Ⅲ.CH4(g)=C(s)+2H2(g) ΔH3=74.0kJ/mol
其中,副反应Ⅱ、Ⅲ形成的积碳易导致催化剂失去活性。
①ΔH=_______ 。
②在原料气中添加微量O2有利于保持催化剂的活性,其原因是_______ 。
③主反应过程机理模型如图所示(*表示吸附在催化剂表面的活性物种)。根据反应机理,生成CO的过程可描述为_______ 。
(2)我国科学家以Si/Bi材料作光电阴极、CO2饱和的0.5mol/L的KHCO3溶液作电解液(pH=7.4),将CO2转化为HCOOH,原理如图所示。

①根据图示,写出光电阴极电极反应式:_______ 。
②从能源利用和资源综合利用角度分析该方法优点是_______ 。
(3)Li-CO2电池能将二氧化碳(CO2)高效转化,研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2 ;
;
Ⅱ.C2 =CO2+C
=CO2+C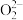 ;
;
Ⅲ._______ ;
Ⅳ.C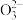 +2Li+=Li2CO3。
+2Li+=Li2CO3。
(1)1991年,Ashcroft提出了甲烷二氧化碳重整的技术理论:气体分子吸附至催化剂表面后发生反应。500℃时,反应原理如下。
主反应:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH
副反应:
Ⅰ.H2(g)+CO2(g)=CO(g)+H2O(g) ΔH1=41.2kJ/mol
Ⅱ.2CO(g)=CO2(g)+C(s) ΔH2=-172.5kJ/mol
Ⅲ.CH4(g)=C(s)+2H2(g) ΔH3=74.0kJ/mol
其中,副反应Ⅱ、Ⅲ形成的积碳易导致催化剂失去活性。
①ΔH=
②在原料气中添加微量O2有利于保持催化剂的活性,其原因是
③主反应过程机理模型如图所示(*表示吸附在催化剂表面的活性物种)。根据反应机理,生成CO的过程可描述为

(2)我国科学家以Si/Bi材料作光电阴极、CO2饱和的0.5mol/L的KHCO3溶液作电解液(pH=7.4),将CO2转化为HCOOH,原理如图所示。

①根据图示,写出光电阴极电极反应式:
②从能源利用和资源综合利用角度分析该方法优点是
(3)Li-CO2电池能将二氧化碳(CO2)高效转化,研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2
 ;
;Ⅱ.C2
 =CO2+C
=CO2+C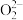 ;
;Ⅲ.
Ⅳ.C
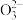 +2Li+=Li2CO3。
+2Li+=Li2CO3。
您最近一年使用:0次
4 . 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+ O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3;S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+ O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
①C(s)+
 O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2
O2(g)=CO(g) ΔH1;C(s)+O2(g)=CO2(g) ΔH2②S(s)+O2(g)=SO2(g) ΔH3;S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+
 O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5;2H2(g)+O2(g)=2H2O(l) ΔH6④CaCO3(s)=CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
您最近一年使用:0次
5 . 下列实验结论正确且能作为相应定律或原理证据的是
| 选项 | A | B | C | D |
| 定律或原理 | 勒夏特列原理 | 元素周期律 | 盖斯定律 | 盐类水解原理 |
| 实验方案 | 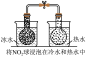 2NO2  N2O4 ΔH<0 N2O4 ΔH<0 | 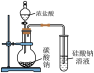 | 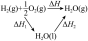 | 取pH试纸于玻璃片上,用玻璃棒蘸取少量次氯酸钠溶液,点在试纸上观察颜色测pH |
| 实验结论 | 气体颜色左球加深、右球变浅 | 验证元素非金属性:C > Si | 测得:ΔH=ΔH1+ΔH2 | 验证:次氯酸为弱酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 下列说法正确的是
已知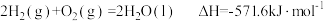
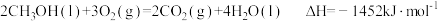
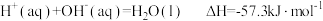
已知
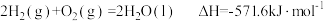
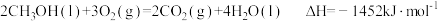
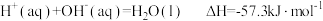
| A.H2(g)的燃烧热ΔH=-571.6kJ•mol-1 |
B.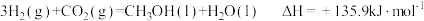 |
C.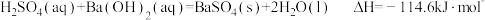 |
| D.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
您最近一年使用:0次
2023-10-05更新
|
63次组卷
|
2卷引用:江苏省常州市前黄高级中学2022-2023学年高二上学期第二次阶段考试化学试题
名校
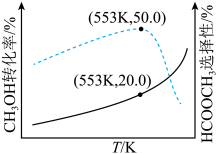
7 . 甲醇脱氢法制HCOOCH3工艺过程涉及如下反应:
反应I:2CH3OH(g)=HCOOCH3(g)+2H2(g);ΔH1=+135.4kJ·mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g);ΔH2=+106.0kJ·mol-1
向容积为10L的恒容密闭容器中通入1.0molCH3OH气体发生上述反应,反应相同时间,测得CH3OH的转化率和HCOOCH3的选择性随温度变化如图所示。
(已知:HCOOCH3的选择性=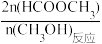 ×100%)。下列说法正确的是
×100%)。下列说法正确的是
反应I:2CH3OH(g)=HCOOCH3(g)+2H2(g);ΔH1=+135.4kJ·mol-1
反应Ⅱ:CH3OH(g)=CO(g)+2H2(g);ΔH2=+106.0kJ·mol-1
向容积为10L的恒容密闭容器中通入1.0molCH3OH气体发生上述反应,反应相同时间,测得CH3OH的转化率和HCOOCH3的选择性随温度变化如图所示。

(已知:HCOOCH3的选择性=
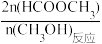 ×100%)。下列说法正确的是
×100%)。下列说法正确的是| A.HCOOCH3(g)=2CO(g)+2H2(g)的ΔH=-76.6kJ·mol-1 |
| B.实线代表的是HCOOCH3的选择性 |
| C.553K时,HCOOCH3的产量为0.1mol |
| D.低于553K时,温度越高,生成的HCOOCH3越多。高于553K时,温度越高,生成的CO越多 |
您最近一年使用:0次
2023-09-11更新
|
347次组卷
|
4卷引用:江苏省常州高级中学2023-2024学年高三上学期开学考试化学试题
名校
8 . 利用CO2和H2合成甲醇时主要涉及以下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH1=-58kJ·mol-1
CH3OH(g)+H2O(g);ΔH1=-58kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g);ΔH2=41kJ·mol-1
CO(g)+H2O(g);ΔH2=41kJ·mol-1
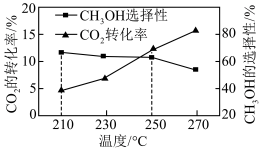
向含有催化剂的密闭容器中充入充入物质的量之比为1∶3的CO2和H2混合气体,其他条件一定,反应相同时间,测得CO2的转化率和CH3OH的选择性[ ×100%]与温度的关系如图所示。下列说法正确的是
×100%]与温度的关系如图所示。下列说法正确的是
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);ΔH1=-58kJ·mol-1
CH3OH(g)+H2O(g);ΔH1=-58kJ·mol-1CO2(g)+H2(g)
 CO(g)+H2O(g);ΔH2=41kJ·mol-1
CO(g)+H2O(g);ΔH2=41kJ·mol-1向含有催化剂的密闭容器中充入充入物质的量之比为1∶3的CO2和H2混合气体,其他条件一定,反应相同时间,测得CO2的转化率和CH3OH的选择性[
 ×100%]与温度的关系如图所示。下列说法正确的是
×100%]与温度的关系如图所示。下列说法正确的是
A.反应CO(g)+2H2(g) CH3OH(g)的ΔH=+99kJ·mol-1 CH3OH(g)的ΔH=+99kJ·mol-1 |
| B.250℃时容器中CH3OH的物质的量小于210℃时容器中 |
| C.平衡时CO2的转化率为20%,CH3OH的选择性为75%,则H2的转化率为33.4% |
| D.研发低温下催化活性强、对CH3OH的选择性高的催化剂有利于CH3OH的合成 |
您最近一年使用:0次
9 . 利用水煤气(主要成分 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
反应Ⅰ:
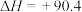 kJ⋅mol
kJ⋅mol
反应Ⅱ: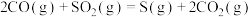
 kJ⋅mol
kJ⋅mol
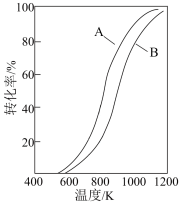
在恒压条件下用水煤气还原 ,起始时
,起始时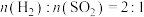 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
 、CO)可将
、CO)可将 在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:
在高温下还原成硫单质,从而实现脱硫。主要发生了下列反应:反应Ⅰ:

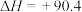 kJ⋅mol
kJ⋅mol
反应Ⅱ:
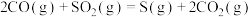
 kJ⋅mol
kJ⋅mol
在恒压条件下用水煤气还原
 ,起始时
,起始时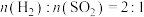 条件下,
条件下, 和
和 的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
A.反应Ⅰ的平衡常数可表示为 |
B.反应Ⅱ的 |
C.曲线B表示 的平衡转化率随温度的变化 的平衡转化率随温度的变化 |
D. 的 的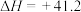 kJ⋅mol kJ⋅mol |
您最近一年使用:0次
名校
10 . 乙苯被吸附在催化剂表面发生脱氢可生成苯乙烯、苯甲醛等,生成苯乙烯的相关反应如下。
反应1:C6H5CH2CH3(g)=C6H5CH=CH2(g)+H2(g) △H1=117.6kJ•mol-1
反应2:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=41.2kJ•mol-1
反应3:2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ•mol-1
(1)反应4:C6H5CH2CH3(g)+ O2(g)=C6H5CH=CH2(g)+H2O(g) △H4=
O2(g)=C6H5CH=CH2(g)+H2O(g) △H4=_______ kJ•mol-1。
(2)较低温度下,向乙苯脱氢的反应体系中加入少量O2,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是________ 。
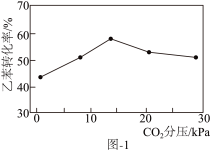
(3)向乙苯脱氢反应体系中加入CO2,乙苯转化率与体系中CO2分压强的关系如图1所示。随CO2的增加,乙苯转化率先增大后减小的可能原因为_______ 。
(4)研究发现在V2O5/MgO催化剂表面进行CO2的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。
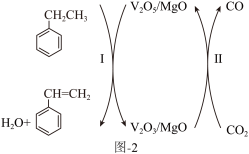
①转化Ⅰ发生反应的化学方程式为_______ 。反应一段时间后,催化剂活性有所下降,原因可能有反应过程产生的积碳覆盖在活性中心表面和_______ 。
②简述转化Ⅱ的作用_______ 。
③CO2参与的乙苯脱氢机理如图3所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。
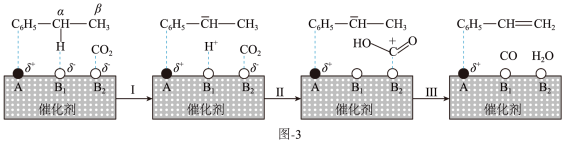
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为________ 。
反应1:C6H5CH2CH3(g)=C6H5CH=CH2(g)+H2(g) △H1=117.6kJ•mol-1
反应2:CO2(g)+H2(g)=CO(g)+H2O(g) △H2=41.2kJ•mol-1
反应3:2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ•mol-1
(1)反应4:C6H5CH2CH3(g)+
 O2(g)=C6H5CH=CH2(g)+H2O(g) △H4=
O2(g)=C6H5CH=CH2(g)+H2O(g) △H4=(2)较低温度下,向乙苯脱氢的反应体系中加入少量O2,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是
(3)向乙苯脱氢反应体系中加入CO2,乙苯转化率与体系中CO2分压强的关系如图1所示。随CO2的增加,乙苯转化率先增大后减小的可能原因为

(4)研究发现在V2O5/MgO催化剂表面进行CO2的乙苯脱氢反应中,V(+5价)是反应的活性中心,转化过程如图2所示。

①转化Ⅰ发生反应的化学方程式为
②简述转化Ⅱ的作用
③CO2参与的乙苯脱氢机理如图3所示(α、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位点,其中A位点带部分正电荷,B1、B2位点带部分负电荷)。

图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为
您最近一年使用:0次
2023-05-29更新
|
444次组卷
|
3卷引用:江苏省常州市联盟学校2023-2024学年高三上学期10月学情调研化学试题



