名校
1 . 向2l恒温恒容容器中加入2molMgSO4并充入2molCO,发生反应:MgSO4(s)+ CO(g) MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

 MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
| A.0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1·min-1 |
| B.2 ~4min内容器内气体的密度没有变化 |
| C.该温度下,反应的平衡常数为1.8 |
| D.保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)>0.60 mol |
您最近一年使用:0次
2017-11-11更新
|
445次组卷
|
6卷引用:江西省南昌县莲塘一中2018届高三11月质量检测化学试题
名校
解题方法
2 . Ⅰ.在容积为2.0 L的密闭容器内,物质D在T℃ 时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:

(1)从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为________________ 。
(2)第5 min时,升高温度,A、B、D的物质的量变化如图,则降温该反应的平衡常数______ 。(填“增大”“减小”或“不变”)。
(3)若在第7 min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是______________ (用图中a、b、c的编号回答)。
Ⅱ.碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+ I2(g) WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。

(4)该反应是__________ (填写“放热”、“吸热”)反应。在450℃时,该反应的平衡常数K=________ 。
(5)若t2时温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量______________ (填“变大”、“不变”或“变小”)。
(6)若t2时温度不变,向该容器中再加入0.002molW、0.0006molI2、0.0054mol WI2,则化学平衡________________ (填“正向移动”、“不移动”或“逆向移动”)。

(1)从反应开始到第一次达到平衡时,用A物质表示的平均反应速率为
(2)第5 min时,升高温度,A、B、D的物质的量变化如图,则降温该反应的平衡常数
(3)若在第7 min时增加D的物质的量,其他条件不变,则A的物质的量图象变化正确的是
Ⅱ.碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+ I2(g)
 WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
WI2(g),为模拟上述反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。下图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
(4)该反应是
(5)若t2时温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量
(6)若t2时温度不变,向该容器中再加入0.002molW、0.0006molI2、0.0054mol WI2,则化学平衡
您最近一年使用:0次
2017-11-09更新
|
312次组卷
|
2卷引用:江西省永丰县永丰中学2022-2023学年高二上学期1月期末期末化学(A班)试题
名校
解题方法
3 . (1)下列关于H2S和SO2的说法正确的是______________
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
①这段时间内CO的反应速率为_________________ 。
②该反应平衡常数______________ (保留两位有效数字)。
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将_____________ (填“正向”、“逆向”或“不”)移动。判断理由是_________________ 。
④若升温发现体系气体平均相对分子质量增大,则该反应的△H______ 0(填“>”、“<”或“=”)。
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率____________ (填“增大”、“减小”或“不变”)。
A.两气体都可用浓硫酸干燥
B.两气体均可以用NaOH溶液吸收
C.两气体按体积比1:2混合可完全转化为S
D.将两气体通入溴水或酸性KMnO4溶液中,可通过颜色变化鉴别两气体
(2)目前治理汽车尾气是在催化剂条件下发生反应2NO+2CO
 N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:
N2+2CO2,现在实验室模拟上述反应,已知在t℃时在2L恒容密闭容器中加入2 molNO和1mol CO气体,经l0min达到平衡,测得此时CO2的体积分数为1/7,回答下列问题:①这段时间内CO的反应速率为
②该反应平衡常数
③平衡后再向密闭容器通入0.4molCO和0.4molCO2,平衡将
④若升温发现体系气体平均相对分子质量增大,则该反应的△H
⑤维持条件不变,向平衡后的容器再充入0.2molNO和0.1molCO,达到新平衡,则与原平衡相比NO的转化率
您最近一年使用:0次
名校
4 . 在373k时,把11.5gN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色的NO2气体,反应原理为N2O4 2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
(1)开始2s内,以N2O4表示的反应速率为___ mol·L-1·s-1。
(2)达到平衡时,体系的压强是开始时的____ 倍。
(3)平衡时还有_______ mol N2O4。
(4)平衡后若压缩容器体积,则再达到平衡后NO2的浓度将_______ (填“增大”、“减少”或“不变”)。
 2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:(1)开始2s内,以N2O4表示的反应速率为
(2)达到平衡时,体系的压强是开始时的
(3)平衡时还有
(4)平衡后若压缩容器体积,则再达到平衡后NO2的浓度将
您最近一年使用:0次
真题
名校
5 . 某温度时,2NO(g)+O2(g)=2NO2(g)反应到2 s后,NO的浓度减少了0.06 mol·L-1,则以O2表示该时段的化学反应速率是
| A.0.03 mol·L-1·s-1 | B.0.015 mol·L-1·s-1 |
| C.0.12 mol·L-1·s-1 | D.0.06 mol·L-1·s-1 |
您最近一年使用:0次
2017-11-03更新
|
1473次组卷
|
19卷引用:江西省樟树中学2017-2018学年高二下学期第三次月考化学试题
江西省樟树中学2017-2018学年高二下学期第三次月考化学试题2015年10月浙江省普通高校招生选考科目考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.7 化学反应速率和化学平衡浙江省宁波诺丁汉大学附属中学2017-2018学年高一下学期期末考试化学试题浙江省慈溪市三山高级中学2018-2019学年高二上学期期初考试化学试题(已下线)考点11 化学反应速率——备战2019年浙江新高考化学考点浙江省上海外国语大学附属宏达高级中学2020-2021学年高二10月月考化学(选考)试题浙江省东阳中学2020-2021学年高二上学期期中考试化学试题福建省南安市侨光中学2020-2021学年高一下学期第一次阶段考试化学试题(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00140】浙江省平阳县万全综合高级中学2021-2022学年高二上学期第一次月考化学试题(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)浙江省台州市路桥区东方理想学校2021-2022学年高二10月阶段性考试化学试题浙江省吴兴高级中学高二 2021-2022学年上学期10月月考化学试题福建省宁德市同心顺联盟2021-2022学年高一下学期期中联合考试化学试题辽宁省沈阳市新民市第一高级中学2021-2022学年高二上学期期末考试化学试题(已下线)6.2.1 化学反应速率及影响因素——同步学习必备知识广东省汕头市潮阳区河溪中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【十一中】【高中化学】【李雪收集】
名校
6 . 向容积为2L的密闭容器中充入2molA气体和1mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
3C(g);经2s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
| A.①②③ | B.①③ | C.②④ | D.①④ |
您最近一年使用:0次
2017-11-02更新
|
1089次组卷
|
10卷引用:江西省上饶市横峰中学2019-2020学年高一(统招班)下学期入学考试化学试题
江西省上饶市横峰中学2019-2020学年高一(统招班)下学期入学考试化学试题青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题安徽省定远重点中学2017-2018学年高一下学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高一(理)下学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第三次月考化学试题天津市第二南开学校2019-2020学年高一下学期阶段性检测化学试题辽宁省锦州市黑山县黑山中学2019-2020学年高一下学期线上教学检测化学试题云南省昆明市官渡区第一中学2019-2020学年高二上学期开学考试化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题山西省大同市浑源七中2022-2023学年高一下学期第三次月考化学试题
名校
解题方法
7 . 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
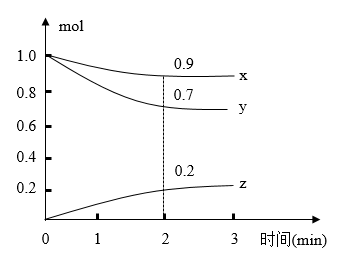
(1)计算反应开始2min内的v(x)=_________ ,v(y)=_________ ,v(z)=___________ 。
(2)容器内的反应物是______________ 。
(3)写出该反应的化学方程式_____________________________ 。

(1)计算反应开始2min内的v(x)=
(2)容器内的反应物是
(3)写出该反应的化学方程式
您最近一年使用:0次
2017-10-28更新
|
328次组卷
|
5卷引用:江西省九江市2017-2018学年高二上学期第一次阶段联考化学试题
江西省九江市2017-2018学年高二上学期第一次阶段联考化学试题内蒙古赤峰市翁牛特旗乌丹第二中学2020-2021学年高二上学期期中考试化学试题(已下线)6.1.1 化学反应速率(第1课时 化学反应速率的概念和简单计算)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)内蒙古自治区赤峰学院附属中学2020-2021学年高二下学期期中考试化学试题2.1.1化学反应速率的表示方法 课前
名校
解题方法
8 . 向一容积不变的密闭容器中充入一定量A和B,发生如下反应: x A(g)+2B(s)  y C(g);△H <0。在一定条件下,容器中 A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g);△H <0。在一定条件下,容器中 A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:

(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=______________ ;
(2)根据图示可确定x:y=______________ ;
(3)0~l0min容器内压强______________ (填 “变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是______________ (填序号);第16min引起曲线变化的反应条件可能是______________ (填序号);
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
 y C(g);△H <0。在一定条件下,容器中 A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
y C(g);△H <0。在一定条件下,容器中 A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)=
(2)根据图示可确定x:y=
(3)0~l0min容器内压强
(4)推测第l0min引起曲线变化的反应条件可能是
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
您最近一年使用:0次
2017-10-27更新
|
209次组卷
|
4卷引用:江西省宜春市上高二中2017-2018学年高二第一次月考化学试题
名校
9 . 五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:
PCl3(g)+Cl2(g) PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
(1)0~150 s内的平均反应速率v(PCl3)=________ mol·L-1·s-1。
(2)该温度下,此反应的化学平衡常数的数值为____ (可用分数表示)。
(3)反应至250 s时,该反应放出的热量为________ kJ。
(4)下列关于上述反应的说法中,正确的是______ (填字母)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300 s时,升高温度,正、逆反应速率同时增大
c.350 s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0 mol PCl3和0.2 mol Cl2,达到化学平衡状态时,n(PCl5)<0.20 mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如上。其他条件相同,请在上图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线________ 。

PCl3(g)+Cl2(g)
 PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) ΔH=-93.0 kJ·mol-1。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~150 s内的平均反应速率v(PCl3)=
(2)该温度下,此反应的化学平衡常数的数值为
(3)反应至250 s时,该反应放出的热量为
(4)下列关于上述反应的说法中,正确的是
a.无论是否达平衡状态,混合气体的密度始终不变
b.300 s时,升高温度,正、逆反应速率同时增大
c.350 s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0 mol PCl3和0.2 mol Cl2,达到化学平衡状态时,n(PCl5)<0.20 mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如上。其他条件相同,请在上图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线

您最近一年使用:0次
名校
解题方法
10 . 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) ΔH<0。若该反应在不同条件下的密闭容器中进行,测得下列不同反应速率,其中反应最快的一项是
2N2(g)+3H2O(g) ΔH<0。若该反应在不同条件下的密闭容器中进行,测得下列不同反应速率,其中反应最快的一项是
 2N2(g)+3H2O(g) ΔH<0。若该反应在不同条件下的密闭容器中进行,测得下列不同反应速率,其中反应最快的一项是
2N2(g)+3H2O(g) ΔH<0。若该反应在不同条件下的密闭容器中进行,测得下列不同反应速率,其中反应最快的一项是| A.υ(NH3)=0.2 mol·L-1·min-1 | B.υ(NO2)=0.2mol·L-1·min-1 |
| C.υ(H2O)=0.005 mol·L-1·s-1 | D.υ(N2)=0.005 mol·L-1·s-1 |
您最近一年使用:0次



